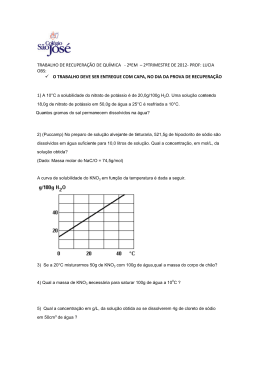
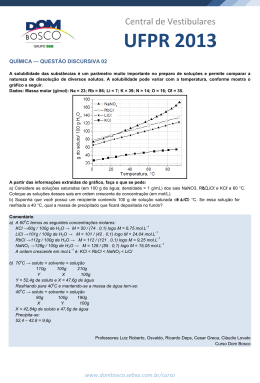
Lista 2-Estequiometria/ Solubilidade/Unidades de Concentração e Diluição 1- A combustão incompleta do etanol (C2H5OH), também chamado de álcool combustível está representada pela equação que não está balanceada. Massas molares (g/mol): C2H5OH=46; O2=32; CO=28g ; H2O=18; __C2H5OH (g) + __O2(g) __CO (g) + __H2O(g) a) Faça o balanceamento da equação química b) Qual é a massa de oxigênio necessário para produzir 560g de monóxido de carbono (CO)? 2. 50g de cloreto de sódio (NaCl, massa molar = 58,5 g/mol) foram dissolvidos em água volume final da solução é de 500 mL. Calcule : a) a contração em g/L b) em % (m/v) c) molaridade em (mol/L). 3. Deseja-se adicionar água a 50 mL de uma solução de cloreto de sódio (NaCl) 0,9 mol/L para diminuir a concentração para 0,25 mol/L. Qual deve ser o volume final? Dados: Na= 23 g/mol ; Cl = 35,5 g/mol; 4- 500 mL de água são adicionados a 100 mL de solução 6% de ácido clorídrico. Calcule a concentração da solução resultante. 5- Em relação ao gráfico ao lado responda a) Qual é a substância mais solúvel a uma temperatura de 40o C em 100g de água? b) Qual é a relação entre temperatura e solubilidade em para a maioria desses sais? c) O aquecimento da substância do NaCl aumentaria sua solubilidade? d) Foram colocados 100g de NaNO3 em 100g de água a uma temperatura de 20oC. Classifique a solução resultante como: insaturada, saturada com ou sem corpo de fundo. Caso haja corpo de fundo qual seria a quantidade de material precipitado. Gabarito: 1- a)--- b)460g 2-)a) 100g/L b) 10% c) 1,7 mol/L a) ---b) 135 g / 3) 180mL 4) 1% 5. a) NaNO3.b)Quanto maior a T maior a solubilidade; c) Não d) Solução Saturada com corpo de fundo de aproximadamente 12g.
Baixar