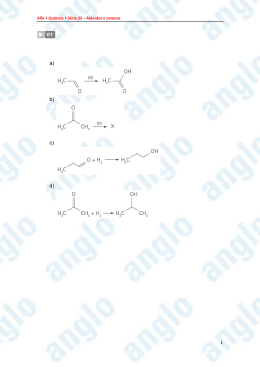
Aldeídos e cetonas Nomes Comuns O C O CH3 C CH3 acetofenona acetona O C benzofenona CH3 Nomes comuns dos aldeídos Use o nome comum do ácido. Deixe cair o ácido -ic e adicione -aldeído. 1 C: ácido fórmico, formaldeído 2 C’s: ácido acético, acetaldeído 3 C’s: ácido propiónico, propionaldeído 4 C’s: ácido butírico, butiraldeído. Estrutura do carbonilo Carbono tem hibridação sp2. Ligação C=O é mais pequena, forte e mais polar que a ligação C=C dos alcenos. Propriedades físicas dos aldeídos e cetonas Oxigénio é mais electronegativo que o carbono; portanto, o ligação carbono– oxigénio é polar: H C H O Propriedades físicas dos aldeídos e cetonas Atracções dípolo–dípolo • Aldeídos e cetonas têm pontos de ebulição e de fusão superiores aos hidrocarbonetos de pesos moleculares semelhantes: 2 Moléculas de acetona Propriedades físicas dos aldeídos e cetonas Ligações de hidrogénio • Par de electrões não ligantes do oxigénio podem participar na ligação de hidrogénio mas não podem formar ligações de hidrogénio com outra molécula igual. • Pontos de fusão e de ebulição tendem a ser inferiores aos álcoois de pesos moleculares semelhantes. O C H O H Pontos de ebulição Mais polar, portanto ponto de ebulição mais elevado que éteres e alcanos comparáveis. Não podem formar pontes de hidrogénio entre si o que diminui o ponto de ebulição comparativamente aos álcoois. Solubilidade Bom solvente para álcoois. O par de electrões do oxigénio do carbonilo pode aceitar a ligação do hidrogénio do grupo O-H ou N-H. Acetona e acetaldeído são misciveis com a água. Resumo da Sintesis Oxidação Álcool 2 + Na2Cr2O7 cetona Álcool 1 + PCC aldeído Cetonas apartir de Nitrilos Um Grignard ou reagente organolium ataca o carbono do nitrilo. O sal imino é então hidrolizado para formar a cetona. N MgBr C CH3CH2MgBr + N et her C CH2CH3 O H3O + C CH2CH3 Reactividade Adição Nucleofílica Um nucleófilo forte ataca o carbono do carbonilo formando um ião alcóxido que depois é protonado. Um nucleófilo fraco ataca o carbonilo que foi protonado aumentando assim a sua reactividade. Aldeídos são mais reactivos que as cetonas. Adição de água Em ácido, água é o nucleófilo. Em base, hidróxido é o nucleófilo. Aldeídos são mais electrofílicos dado que têm menos grupos alquilo como doadores de electrões. O H C + H2O H O CH3 OH HO C C H HO + H2O CH3 K = 2000 H CH3 OH C CH3 K = 0.002 Adição de HCN HCN é altamente tóxico. Use NaCN ou KCN em base para adicionar o cianeto depois protone o oxigénio Reactividade do formaldeído > aldeídos > cetonas >> cetonas volumosas. O CH3CH2 C HO CH3 + HCN CH3CH2 CN C CH3 Formação de iminas Adição nucleofílica da amónia ou amina primária, seguido de eliminação da molécula de água. C=O torna-se C=N-R CH3 H3C RNH2 R _ C H2N O + Ph C O Ph CH3 R N H C Ph R OH N C OH H Ph CH3 R N CH3 C Ph Dependia do pH A perda de água é catalisada por ácido, mas o ácido destrói os nucleófilos. NH3 + H+ NH4+ (não é nucleófilo) pH óptimo é cerca de 4.5 Outras condensações => Adição de álcool Mecanismo Tem que ser catalisada por ácido. Adição de H+ ao carbonilo torna-o mais reactivo com um nucleófilo fraco, ROH. Hemiacetal forma-se primeiro depois a catálise ácida perde a água, depois da segunda molécula de ROH forma o acetal. Todos os passos são reversiveis. Mecanismo do hemiacetal O + OH + H+ H OH + OH HO HOCH3 HO OCH3 + HOCH3 OCH3 + + H2OCH3 Hemiacetal a Acetal HO OCH3 + HO H OCH3 OCH3 + H+ + HOH HOCH3 OCH3 HOCH3 + + CH3O H OCH3 CH3O OCH3 Oxidação de aldeídos Fácilmente oxida a ácido carboxilico. Reagentes de redução Borohidreto de sódio, NaBH4, reduz o C=O, mas não o C=C. Hidreto de aluminio e litio, LiAlH4, mais forte e dificil de lidar. O hidrogénio gasoso com catalisador também reduz a ligação C=C. Hidrogenação catalítica Largamente utilizada na indústria. Raney níquel finamente dividido e saturado com hidrogénio gasoso. Pt e Rh também usado como catalisador. O OH Raney Ni H Fim do capítulo 18
Baixar