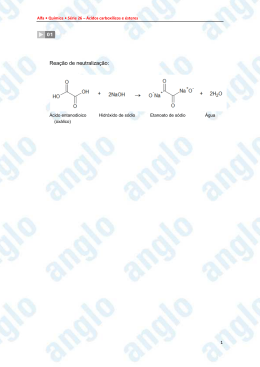
Substituição Aromática Eletrofílica: Mecanismo Geral + EA d+ d- E E E H H H + + Etapa 1 (lenta) Íon Arênio (complexo s) + E E H A Etapa 2 (rápida) + HA Sustituição Eletrofílica E1 E1 E1+ E2+ E2 E1 ?? + E2 ?? ?? E1 E1 E1 E2 E2 orto meta E2 para Grupos Ativadores – Doadores de elétrons (Bases de Lewis) • São todos os compostos capazes de estabilizar os intermediários catiônicos, e podem fazê-lo por efeito de indução ou ressonância • Efeito de indução: Grupos alquila (CH3—) • Efeito de ressonância: Nitrogênio e Oxigênio ligados diretamente ao anel. • O efeito de ressonância é mais importante (efetivo) que o de indução • São orto-, para- dirigentes. Teoria dos Efeitos dos Substituintes sobre a Substituição Aromática Eletrofílica Efeito Indutivo d R d+ R = F, Cl ou Br O NR3+ CX3 Ressonância NO2 CG G = H, R, OH ou OR R+ R + E E H H NH2 NH2 OH OR X Grupos Ativadores A A+ A+ d A A+ d d d Grupos Desativadores – Receptores de elétrons (Ácidos de Lewis) • São todos os compostos que desestabilizam os intermediários catiônicos, e podem fazê-lo por efeito de indução • Todo grupo com um átomo ligado diretamente ao anel e que possua carga parcial positiva será um grupo desativador. • São meta- dirigentes. Exceção ao cloro, que é orto- e para- dirigente. Grupos Desativadores N d- - - d O C d+ Cd+ d O H Cd+ R - d O Cd+ OH Também ésteres, cloretos de acila e amidas O N O O O O S 2+ Grupos Desativadores D D- D- D- d D d d d Orientador vs Ativador • O termo Orientador, refere-se à posição relativa dos grupos em um anel Benzênico. • O termo Ativador, refere-se ao aumento na velocidade de reação do anel Benzênico frente a um substituinte. Teoria dos Efeitos dos Substituintes sobre a Substituição Aromática Eletrofílica Quando benzenos substituídos sofrem ataque eletrofílico, os grupos já presentes no anel afetam tanto a velocidade da reação, quanto o sítio de ataque. Dizemos, portanto, que grupos substituídos afetam tanto a reatividade como a orientação nas SAE. Grupos Ativadores Orientadores orto-para Grupos Desativadores Orientadores meta Teoria dos Efeitos dos Substituintes sobre a Substituição Aromática Eletrofílica Exemplos: CH3 CH3 CH3 CH3 NO 2 HNO3 + H2SO4 + NO 2 Ativador orto-para NO 2 o-nitrotolueno 59% NO 2 m-nitrotolueno 4% NO 2 HNO3 p-nitrotolueno 37% NO 2 NO 2 NO 2 + H2SO4 + NO 2 Desativador meta NO 2 o-dinitrobenzeno 6% m-dinitrobenzeno 93% p-dinitrobenzeno 1% Teoria dos Efeitos dos Substituintes sobre a Substituição Aromática Eletrofílica Orientadores orto-para Orientadores meta Ativadores Fortes Desativadores Moderados -NH2, -NHR, -NR2, -OH, -O - -CN, -SO3H, -CO2H, -CO2R, -CHO, -COR Ativadores Moderados Desativadores Fortes -NHCOCH3, -NHCOR, -OCH3, -OR -NO2, -NR3+, -CF3, -CCl3 Ativadores Fracos -CH3, -C2H5, -R, -C6H5 Desativadores Fracos -F, -Cl, -Br, -I Teoria dos Efeitos dos Substituintes sobre a Substituição Aromática Eletrofílica Reatividade Teoria dos Efeitos dos Substituintes sobre a Substituição Aromática Eletrofílica Orientação Orientadores meta Exemplo: CF3 Orientadores orto-para Exemplo: NH 2 Bibliografia 1. SOLOMONS, T.W.G.; FRYHLE, C.B. Química Orgânica. Rio de Janeiro: LTC Editora. Vol 1, 7.ed., 2001; Vol 2, 7a ed., 2002. (Capítulos 14 e 15). 2. VOLLHARDT, K.P.C.; SCHORE, N.E. Química Orgânica: Estrutura e Função. Porto Alegre: Bookman. 4.ed., 2004. (Capítulos 15 e 16). 3. BARBOSA, L.C.A. Introdução à Química Orgânica. São Paulo: Prentice Hall. 2004. (Capítulo 5). 4. McMURRY, J. Química Orgânica. São Paulo: Pioneira Thomson Learning. Vol 1, 2005; Vol 2, 2005. (Capítulos 15 e 16). Compostos Carbonílicos Compostos Carbonílicos O R R Aldeído R O O H Grupo carbonílico R' O HO Cetona R Ácido Carboxílico O R'O Éster Carboxilato Nomenclatura – Aldeídos No sistema IUPAC, os aldeídos são nomeados substitutivamente, trocandose o final -o do nome do alcano correspondente por -al. Uma vez que o grupo aldeído está no final da cadeia carbônica, não há necessidade de indicar sua posição. Quando outros substituintes estão presentes, entretanto, dá-se ao C do grupo carbonílico a posição 1. Os aldeídos, cujo grupo –CHO é ligado a um sistema cíclico, são nomeados substitutivamente adicionando-se o sufixo carbaldeído. O H O C H3C H C CH3CH2 C H formaldeído CH3 O etanal (acetaldeído) CH3CHCH2 C H H propanal 3-metilbutanal O O C H O benzenocarbaldeído (benzaldeído) C cicloexanocarbaldeído H Nomenclatura – Cetonas As cetonas são denominadas substitutivamente trocando-se o final -o do nome do alcano correspondente por –ona. A cadeia carbônica é numerada de modo que o átomo de C da carbonila tenha o menor número possível, este numero é utilizado para designar sua posição. Nomes comuns para cetonas são obtidos nomeando-se separadamente os dois grupos ligados ao grupo carbonílico, adicionando-se a palavra cetona como uma palavra separada. O O CH3CCH3 CH3CCH2CH2CH3 propanona ou acetona (dimetil cetona) 2-pentanona (metil propil cetona) O O CH3CH2CCH3 CH3CCH2CH=CH2 butanona (etil metil cetona) 4-penten-2-ona (alil metil cetona) Propriedades Físicas de Aldeídos e Cetonas O O CH3CH2CH2CH3 CH3CH2CH CH3CCH3 CH3CH2CH2OH butano p.e. – 0,5 C (MM = 58) propanal p.e. 49 C (MM = 58) acetona p.e. 56,1 C (MM = 58) propanol p.e. 97,2 C (MM = 60) Ligação de hidrogênio (aldeídos e cetonas X álcoois) Solúveis em água: (ligações de hidrogênio entre as moléculas dos aldeídos e/ou cetonas com moléculas de água). Reações de Oxidação-Redução em Química Orgânica A redução de uma molécula orgânica corresponde, normalmente, ao aumento de seu conteúdo de hidrogênio ou à diminuição de seu conteúdo de oxigênio. [H] é o símbolo utilizado para indicar que houve redução sem especificar o agente redutor. A oxidação de uma molécula orgânica corresponde, normalmente, ao aumento de seu conteúdo de oxigênio ou à diminuição de seu conteúdo de hidrogênio. [O] é o símbolo utilizado para indicar que houve oxidação sem especificar o agente oxidante. Síntese de Aldeídos O [O] R-CH2OH O [O] RCH RCOH [H] [H] álcool 1ário aldeído ácido carboxílico Aldeídos por oxidação de álcoois primários O PCC R-CH2OH RCH PCC = clorocromato de piridínio CH2Cl2 Aldeídos por redução de ácidos carboxílicos O RCOH LiAlH4 O RCH LiAlH4 R-CH2OH Síntese de Cetonas Cetonas a partir de alcinos C C + HOH HgSO4 H2SO4 H H C C C C O H OH álcool vinílico (instável) cetona Tautomerização ceto-enólica H + O H H H + O H C C C OH forma enólica H H C + O H H H C H C O forma cetônica + H3O+ Grupo Carbonílico C O + C O estruturas de ressonância ou C d+ O d híbrido O oxigênio (mais eletronegativo) atrai fortemente os elétrons de ambas as ligações s e , fazendo com que o grupo carbonílico seja altamente polarizado. O átomo de carbono carrega uma carga parcial positiva substancial e o átomo de oxigênio carrega uma carga parcial negativa substancial. A polarização da ligação pode ser representada pelas estruturas de ressonância. Adição Nucleofílica à Ligação Dupla Carbono-Oxigênio Nu R + Nu C R' O d+ d C R O H Nu Nu C R R' OH + Nu R' nucleófilo forte Os aldeídos são mais reativos em adições nucleofílicas do que as cetonas (fatores estéricos). Ácidos Carboxílicos e Derivados (Compostos Acílicos) O grupo carboxílico C OH O grupo carboxílico é o grupo gerador de uma família enorme de compostos chamados de compostos acílicos ou derivados de ácido carboxílico. Estrutura Nome do composto acílico O C R cloreto de acila (ou cloreto de ácido) Cl O O C C R anidrido de ácido R' O O C R R OR' R C N éster nitrila O O O C C C NH2 R NHR' R NR'R'' amida Nomenclatura - Ácidos Carboxílicos No sistema IUPAC, substitui o sufixo –ano do nome do alcano equivalente, que corresponde à maior cadeia do ácido, pela adição –óico precedida pela palavra ácido. CH3 O O CH3CH2CHCH2CH2COH CH3CHCHCH2CH2COH ácido 4-metilhexanóico ácido 4-hexenóico Substância Nome sistemático Nome comum p.e. (oC) HCOOH ác. metanóico ác. fórmico 100,5 H3CCOOH ác. etanóico ác. acético 118 H3C(CH2)2COOH ác. butanóico ác. butírico 164 H3C(CH2)3COOH ác. pentanóico ác. valérico 187 H3C(CH2)4COOH ác. hexanóico ác. capróico 205 H3C(CH2)16COOH ác. octadecanóico ác. esterárico 383 Sais de Ácidos Carboxílicos Nomenclatura: São caracterizados pela terminação –ato, tanto na sistemática IUPAC quanto na comum, substituindo-se o –ico do nome e retirando a palavra ácido da frente. CH3COONa: acetato de sódio ou etanoato de sódio Os sais de sódio e de potássio da maioria dos ácidos carboxílicos são facilmente solúveis em água, mesmo os de cadeias longas (principais componentes dos sabões). Acidez dos Ácidos Carboxílicos A maioria dos ácidos carboxílicos não-substituídos possui valores de pKa na faixa de 4-5. Esta acidez relativa explica porque os ácidos carboxílicos reagem facilmente com soluções aquosas de NaOH e NaHCO3 para formar sais de sódio solúveis. COOH + NaOH H2O COONa+ + H2O pKa 4,19 COOH + NaHCO3 H2O COONa+ + CO2 + H2O Cl Cl C Cl COOH Cl Cl C H COOH H Cl C H COOH H H C COOH H ác. tricloroacético ác. dicloroacético ác. cloroacético ác. acético pKa 0,70 pKa 1,48 pKa 2,86 pKa 4,76 Os ácidos carboxílicos que possuem grupos retirantes de elétrons são mais fortes que os ácidos não-substituídos, devido ao efeito indutivo. Ésteres O O Ésteres são produtos de uma reação de condensação entre um ácido carboxílico e + HOR' + H RCOR' um álcool. Os ésteres são nomeados como se fossem “sais de alquila” dos ácidos RCOH 2O carboxílicos. O O RCOH + HOR' RCOR' + H2O Os nomes dos ésteres são formados a partir do ácido de onde provêm (com terminação –ato ou –oato) e dos nomes do álcool (com a terminação –ila). A palavra ácido do nome do ácido carboxílico é retirada e a contribuição do nome relacionado ao álcool vem em segundo lugar. O O O C CH3CH2 C H3C O OC(CH3)3 acetato de etila ou etanoato de etila propanoato de terc-butila C OCH2CH3 C H3C OCH2CH3 Cl OCH=CH2 acetato de vinila ou etanoato de vinila p-clorobenzoato de etila Anidridos Carboxílicos Os anidridos são, formalmente, derivados de duas moléculas de ácido carboxílico pela remoção de uma molécula de água. O O RCOH RCOH O O O O O O RCOCR' + H2O + HOCR' RCOCR' + H2O + HOCR' Os nomes da maioria dos anidridos são formados retirando-se a palavra ácido do nome dos ácidos caboxílicos, e depois se adiciona a palavra anidrido. O H3C C O H3C C O H3C C O H3CH 2CH 2C O anidrido acético ou anidrido etanóico O H2C H2C C O anidrido acético-butírico ou anidrido butanóico-etanóico C O C O anidrido succínico Cloretos de Acila ou Cloretos de Ácido Seus nomes são formados pela substituição da palavra ácido pela palavra cloreto, e da terminação –ico pela terminação –ila. O O O C H3C Cl cloreto de etanoila ou cloreto de acetila C H5 C6 C H3CH2C Cl Cl cloreto de benzoíla cloreto de propanoila Amidas Os nomes das amidas que não possuem substituintes no átomo de N são formados pela retirada da palavra ácido e terminação –ico do nome comum do ácido (ou –óico do nome substitutivo), e então adiciona-se – amida. Os grupos alquila no átomo de N das amidas são nomeados como substituintes, sendo precedidos por –N ou –N,N. H3C O O C C H 5C 6 NH2 acetamida O C NH2 benzamida O H3C N CH3 CH3 N,N-dimetilacetamida C H3C N C 6H 5 CH2CH2CH3 NHC2H5 N-etilacetamida N-fenil-N-propilacetamida C H3C O Nitrilas Na nomenclatura substitutiva da IUPAC, as nitrilas acíclicas são denominadas pela adição do sufixo –nitrila ao nome do hidrocarboneto correspondente. O átomo de carbono do grupo –C N é assinalado como o número 1. H3C C N etanonitrila (acetonitrila) H3CH2CH2C C N butanonitrila H2C=HC C N Propenonitrila (acrilonitrila) Nitrilas cíclicas são nomeadas adicionando-se o sufixo –carbonitrila ao nome do sistema de anel ao qual o grupo –CN está ligado. CN benzenocarbonitrila (benzonitrila) Preparação de ácidos carboxílicos Por oxidação dos alcenos RCH=CHR’ (1) KMnO4, OHRCOOH + R’COOH calor (2) H3O+ Por oxidação de aldeídos e álcoois primários (1) Ag2O R-CHO RCOOH (2) H3O+ RCH2OH (1) KMnO4, OHcalor (2) H3O+ RCOOH Preparação de ácidos carboxílicos Por oxidação de alquilbenzenos CH3 (1) KMnO4, OHcalor (2) H3O+ COOH Por oxidação de metil cetonas O C Ar O (1) X2/NaOH CH3 (2) H3O+ + CHX3 C Ar OH Por hidrólise de cianoidrinas e outras nitrilas R O R' OH R + HCN C R' CN HA H2O OH R C R' COOH Ésteres Os ácidos carboxílicos reagem com álcoois para formar ésteres através de uma reação de condensação conhecida como esterificação. Estas reações são catalisadas por ácidos. O O HA + R'OH C R C R OH + HOH OR' Mecanismo: esterificação catalisada por ácido H H O + H + O H OH H 2 etapas H5C6 O H CH3 H C - CH3OH H5C6 OH O H + O H C H5C6 + O + CH3OH H 5C 6 H O C O H C H5C6 + OCH3 H O + C O O H O - H3O+ + H3O+ CH3 C H5C6 OCH3 Ésteres Ésteres a partir de cloretos de acila Desde que cloretos de acila são muito mais reativos do que os ácidos carboxílicos na reação adição-eliminação, a reação entre um cloreto de acila e um álcool ocorre rapidamente e não necessita de um catalisador ácido. O O + R'OH C R + HCl C R Cl OR' Ésteres a partir de anidridos de ácidos carboxílicos O R C O O + R'OH R O + C R C O OR' C R OH Ésteres Hidrólise de éster catalisada por ácido O C R O H3O+ + H2O OR' C R + R'OH OH Se necessitamos esterificar um ácido carboxílico, usamos um excesso de álcool e, se possível, removemos a água assim que é formada. Se necessitamos hidrolisar um éster, usamos um grande excesso de água; isto é, refluxamos o éster com HCl aquoso diluído ou H2SO4 aquoso diluído. Ésteres Hidrólise de éster promovida por base: Saponificação Refluxando um éster com NaOH aquoso, produzimos um álcool e o sal de sódio do ácido: O + NaOH C R O H2O C R OR' + R'OH O Na+ Mecanismo: hidrólise de um éster promovida por base O O + C R O R' O H R O O lenta C O O R' H C R + OO H R' C R O + HO R' Bibliografia 1. SOLOMONS, T.W.G.; FRYHLE, C.B. Química Orgânica. Rio de Janeiro: LTC Editora. Vol 1, 7.ed., 2001; Vol 2, 7a ed., 2002. (Capítulos 16, 17 e 18). 2. VOLLHARDT, K.P.C.; SCHORE, N.E. Química Orgânica: Estrutura e Função. Porto Alegre: Bookman. 4.ed., 2004. (Capítulos 17 a 20). 3. BARBOSA, L.C.A. Introdução à Química Orgânica. São Paulo: Prentice Hall. 2004. (Capítulos 12 e 13). 4. McMURRY, J. Química Orgânica. São Paulo: Pioneira Thomson Learning. Vol 1, 2005; Vol 2, 2005. (Capítulos 19 a 23).
Baixar