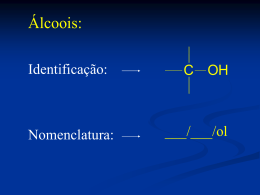
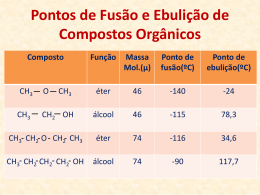
Alcenos e Alcinos Grupo Funcional Ligação π é o grupo funcional. Mais reactivo que a ligação sigma. Energia de dissociação: C=C BDE C-C BDE Ligação π 146 kcal/mol 83 kcal/mol 63 kcal/mol (146kcal/mol-83kcal/mol) Comprimentos e ângulos da ligação Orbitais híbridas têm mais carácter s. A orbital π torna os átomos de carbono mais próximos. Ângulo de ligação aumenta com a presença da orbital π. Ângulo C=C-H é 121.7 Ângulo H-C-H é 116. 6 Ligação π A sobreposição lado a lado das orbitais p. Não é possível rotação sem quebrar a ligação π (63 kcal/mole). Se houver rotação de 90º ocorre a quebra da ligação. Alcenos CH2 CH CH2 CH3 1-buteno CHCH2CH3 CH3 C CH CH3 CH3 H3C 2-sec-butil-1,3-ciclohexadieno 2-metil-2-buteno CH3 3-metilciclopenteno 3-n-propil-1-hepteno Alcenos como substituintes = CH2 metileno (metilideno) Name: - CH = CH2 vinil (etenil) - CH2 - CH = CH2 alil (2-propenil) Nomes comuns Usados para moléculas pequenas. Exemplos: CH3 CH2 CH2 ethylene CH2 CH CH3 propylene CH2 C CH3 isobutylene Isomerismo cis-trans Isomerismo cis-trans Grupos semelhantes do mesmo lado da dupla ligação, o alceno é cis. Grupos semelhantes de lados opostos da dupla ligação, o alceno é trans. Cicloalcenos são cis. Cicloalcenos trans não são estáveis, a menos que o anel tenha pelo menos 8 carbonos. Nomenclatura E-Z Use as regras da prioridade de Cahn-Ingold-Prelog para determinar as prioridades dos grupos ligados a cada carbono na dupla ligação. Se os grupos prioritários estão no mesmo lado o nome é Z (para zusammen). Se os grupos prioritários estão no lado oposto, o nome é E (para entgegen). Nomenclatura E-Z Regras da prioridade 1. Prioridade é baseada no número atómico; quanto maior o número atómico maior é a prioridade. (1) (6) -H -CH3 (7) -N H2 (8) (16) - OH - SH (17) (35) (53) - Cl - Br -I Incre as i n g pri ori ty 2. Se a prioridade não pode ser determinada com base nos átomos ligados a dupla ligação, olhe para os átomos seguintes; a prioridade é estabelecida no primeiro ponto de diferença (1) - CH 2 -H (6) - CH 2 -CH 3 (7) - CH 2 -NH2 Incre asi ng pri ori ty (8) - CH 2 -OH Nomenclatura E-Z 3. Átomos que participam na dupla e na tripla ligação são considerados ligados a número semelhantes por ligações simples. equivalente C -CH=CH2 is treated as O -CH is treated as C -CH-CH2 O C C O H de átomos Exemplo, E-Z 1 1 H3C Cl C C H 2Z 1 H CH2 2 2 Cl 2 CH CH3 C C H 2 1 5E (2Z, 5E)-3,7-dichloro-2,5-octadiene => Estabilidade dos alcenos Medida por calor de hidrogenação: Alceno + H2 Alcano + energia Mais calor libertado, alceno de maior energia. 30.3 kcal 27.6 kcal Efeitos dos substituintes Alcenos mais substituídos são mais estáveis. H2C=CH2 < R-CH=CH2 < R-CH=CH-R < R-CH=CR2 < R2C=CR2 unsub. < monosub. < disub. < trisub. < tetra sub. Grupo alquilo estabiliza a dupla ligação. Alceno menos impedido estereamente. Isómeros Disubstituidos Estabilidade: cis < geminal < isómero trans Isómero menos estável tem uma energia mais elevada, o calor de hidrogenação é exotérmico. Cis-2-buteno CH3 C C H Isobutileno Trans-2-buteno CH3 H (CH3)2C=CH2 H CH3 28.6 kcal C C CH3 H 28.0 kcal 27.6 kcal Propriedades físicas Pontos de ebulição aumentam com a massa. Alcenos com ramificações têm pontos de ebulição mais baixos. Menos densos que a água. Levemente polares Ligação π é polarizável, portanto ocorrem interacções instantâneas dípolo-dípolo. Grupos alquilo são dadores de electrões através da ligação sigma, portanto podem ter um momento dipolar pequeno. Exemplos de polaridade H3C CH3 H C C H CH3 C C H cis-2-bu te n e , bp °C 4 = 0.33 D H3C H trans-2-bu te n e , bp°C 1 =0 Alcinos Introdução Alcinos contêm uma ligação tripla. Formula geral é CnH2n-2 Propriedades físicas Não polar, insoúvel em água Solúvel na maioria dos solventes orgânicos. Pontos de ebulição semelhantes aos alcanos do mesmo tamanho. Menos denso que a água. Até 4 carbonos são gases à temperatura ambiente. Nomes comuns Nomeados como se fossem acetilenos substituídos. CH3 C CH metilacetileno CH3 CH3 CH CH2 CH3 C C CH CH3 isobutilisopropilacetileno Estrutura Electrónica A ligação sigma resulta da sobreposição de orbitais sp-sp. • As ligações pi não são hibridas, resultam da sobreposição das orbitais p a 90, o que origina uma forma cilindrica. Comprimento das ligações Quanto maior o caracter s, mais pequena é a ligação. As três ligações sobrepõem-se, o que as encurta . Ângulo da ligação é 180, geometria linear. Acidez dos alcinos Alcinos terminais, R-CC-H, são mais acidicos que os outros hidrocarbonetos. Acetileno acetilide por NH2-, mas não por OH- ou RO-. Mais caracter s, portanto os pares de electrões no anião estão mais próximos do núcleo. Menos separação de carga, portanto mais estável. Tabela de acidez FIM
Baixar