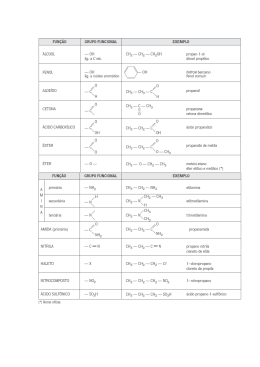
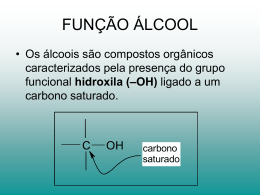
1 COLÉGIO TERESIANO – CAP/PUC Ensino Médio ESTUDO DIRIGIDO DO 1º SEMESTRE DE 2012 DISCIPLINA: QUÍMICA - 2ª Série Profª: Olinda Guida I. CONTEÚDOS TRABALHADOS NO 1º SEMESTRE: QUÍMICA ORGÂNICA O átomo de carbono Classificação do átomo de carbono e nox Classificação das cadeias carbônicas Radicais alquilas e arilas Nomenclaturas dos hidrocarbonetos Haletos orgânicos, Fenóis, Álcoois, Éteres, Aldeídos e Cetonas QUÍMICA INORGÂNICA Estequiometria e seus casos particulares Soluções: medidas das principais concentrações em porcentagens II. O QUE FAZER PARA ESTUDAR OS CONTEÚDOS ACIMA 1. Leia e priorize a teoria da apostila. 2. Complemente a teoria da apostila com anotações e exemplos em dados em seu caderno . 3. Refaça os exercícios do caderno e apostila. 4. Refaça os testes, Teds e provas, principalmente as questões que você errou ou teve mais dificuldade. Avalie seu erro e tente corrigi-lo para evitar reincidência do mesmo. 5. Oriente-se e habitue a usar o índice da apostila. 6. Organize-se nos seus estudos e obedeça rigorosamente a sequência acima proposta. III. CONCEITOS IMPORTANTES A SEREM RELEMBRADOS E DOMINADOS. Reconhecer a nomenclatura adotada pela IUPAC e aplicá-la aos hidrocarbonetos. Reconhecer e aplicar as fórmulas gerais correspondentes aos hidrocarbonetos. Identificar e nomear os hidrocarbonetos a partir das fórmulas em bastão, condensadas e estruturais. Reconhecer os grupamentos funcionais e a nomenclatura adotada pela IUPAC e aplicá-la aos derivados halogenados e compostos oxigenados. Identificar e nomear os derivados halogenados e os compostos oxigenados a partir das fórmulas em bastão, condensadas e estruturais. Resolver problemas que envolvam mais de uma reação química. Resolver problemas que envolvam volume de gases em condições que não sejam as normais. Conceituar, solvente, soluto, coeficiente de solubilidade e solução saturada. Resolver problemas envolvendo sistemas com corpo de fundo. Resolver problemas que envolvam os conceitos de porcentagem em massa, densidade, concentrações em g/L e em mols/L. 2 IV – BIBLIOGRAFIA Se de todas as formas ainda houver necessidade de um aprofundamento maior no conteúdo, consulte o volume único de um dos seguintes livros: a) Química na Abordagem do Cotidiano – Tito & Canto b) Química – Usberco & Salvador V - EXERCÍCIOS 1. Um dos medicamentos desenvolvidos para o tratamento da Aids é o composto denominado AZT, cuja fórmula está representada abaixo: O CH3 HN N O HOCH2 AZT O NH2 a) Quantos átomos de carbono existem em 1,5 mols de AZT ? b) Qual a porcentagem em massa de oxigênio no composto ? c) Qual o número de oxidação do carbono assinalado em sua fórmula estrutural ? 2. A exposição excessiva ao Sol pode trazer sérios danos à pele humana. Para atenuar tais efeitos nocivos, costuma-se utilizar agentes protetores solares, dentre os quais pode-se citar o 2-hidróxi-4-metóxi-benzofenona, cuja fórmula estrutural está representada abaixo: O OH C 2 3 1 O CH3 a) Quantos átomos de hidrogênio existem em 0,5 mol deste composto orgânico ? b) Qual o nox dos carbonos 1, 2 e 3 ? 3 3. O sentido do olfato se baseia num mecanismo complexo, no qual as moléculas das substâncias odoríferas são adsorvidas em sítios específicos existentes na superfície dos cílios olfativos. Esses cílios registram a presença das moléculas e enviam a informação para o cérebro. Em muitos casos, pequenas modificações na estrutura de uma substância podem causar grande alteração no odor percebido. Os compostos abaixo, por exemplo, apresentam estruturas químicas semelhantes, mas claras diferenças quanto ao odor. Odor de amêndoa O C Odor de baunilha O H C H OCH3 OH Vanilina a) Dê o nome do composto que tem odor de amêndoa. b) Quais a funções orgânicas presentes na molécula da vanilina ? 4. O ácido ascórbico (vitamina C) reduz o iodo, conforme a reação química representada a seguir. OH O OH OH O O OH O + I2 HO OH ácido ascórbico + 2 HI O O ácido desidroascórbico Em uma análise de 1,76 g ácido ascórbico contido em um suco de laranja, são consumidas certa quantidade de solução de iodo molecular. Com base nestas informações, calcule: a) a massa de ácido desidroascórbico formado. b) o número de moléculas de ácido iodídrico obtido na reação. 5. Calcule a massa de pirita (FeS2) necessária à obtenção de 320 Kg de anidrido sulfúrico pelo seguinte processo: 4 FeS2 + 11 O2 2 SO2 + O2 2 Fe2O3 + 8 SO2 2 SO3 Qual o volume de oxigênio nas CNTP necessário à reação com a pirita ? 4 6. O álcool tem largo emprego industrial, como solvente, na fabricação de loções e perfumes e, ainda, como combustível para automóveis. A família dos álcoois, no entanto, é muito numerosa e diversificada. Por exemplo, são álcoois substâncias como a glicerina, usada em sabões, em cosméticos, nas tintas de impressão gráfica, como aditivos em alimentos e etc. Dê a formula em bastão e a nomenclatura do menor monoálcool terciário com cadeia aberta, saturado que apresenta em sua estrutura um carbono quaternário. 7. Certa de uma amostra de cloreto de amônio é aquecida com hidróxido de sódio fornecendo 224 L de gás nas CNTP. Quantos mols de cloreto de amônio existem nessa amostra ? NH4Cℓ (ℓ) + NaOH (s) → NaCℓ (s) + NH3 (g) + H2O (ℓ) 8. 600 g de sulfato férrico são adicionados a 624 g de cloreto de bário. Dá-se a reação com precipitação de um sal de bário. Calcule o número de moléculas do precipitado formado. Fe2(SO4)3 (ℓ) + 3 BaCℓ2 (ℓ) → 3 BaSO4 (s) + 2 FeCℓ3 (ℓ) 9. Certa quantidade de alumínio reage com ácido clorídrico e são obtidos 540 L de gás hidrogênio a 27 C e pressão de 0,82 atm. Calcule esta quantidade de alumínio, em gramas, necessária à reação. (Dado: R = 0,082) 2 Aℓ (s) + 6 HCℓ (aq) → 2 AℓCℓ3 (ℓ) + 3 H2 (g) 10. No ataque a 1,25 g de calcário (CaCO3 impuro), é obtido 13,6 g de sulfato de cálcio. Qual a porcentagem de pureza desse calcário ? CaCO3 (s) + H2SO4 (ℓ) → CaSO4 (ℓ) + CO2 (g) + H2O (ℓ) 11. As instruções na bula de um medicamento usado para a reidratação estão resumidas no quadro a seguir. Modo de usar: dissolva o conteúdo do envelope em 500 mL de água Composição: cada envelope contém Cloreto de potássio: 74,5 mg Citrato de sódio decahidratado: 145 mg Cloreto de sódio: 1750 mg Glicose: 10 g Obs: suponha o aumento de volume sendo desprezível. Após a preparação do medicamento, calcule: a) a porcentagem em m/v (massa por volume) da glicose. b) a porcentagem em massa do cloreto de sódio. 5 12. A revolução industrial, iniciada na Grã-Bretanha no fim do século XVIII, representou a transição da sociedade agrária e têxtil para a sociedade industrial, que se baseava no carbono, como combustível, e no ferro, como matéria-prima fundamental para a fabricação das máquinas. Conhecido desde os tempos pré-históricos, o metal dá nome à idade do ferro, período histórico que sucedeu a idade do bronze. Pertencente ao grupo dos metais de transição, o ferro é o quarto elemento químico em abundância na crosta terrestre é obtido a partir da redução da magnetita (Fe3O4), segundo a reação: Fe3O4 (s) + 4 H2 (g) → 3 Fe (s) + 4 H2O (g) Partindo-se de 580 Kg de hematita contendo 20% de impurezas, qual a massa, em Kg, de ferro obtida ? 13. SUBSTÂNCIAS DE ODOR AGRADÁVEL Substância I Substância II Substância III Possui odor de Trata-se da substância amêndoa. Ele pode responsável pelo odor de ser extraído de canela, que é a casca amêndoas amargas odorífera de uma árvore e, por esse motivo, é muito utilizada como conhecido como óleo especiaria. As balas e de amêndoas gomas de mascar com amargas. sabor de canela contêm esta substância. C Trata-se de um dos responsáveis pela fragrância característica do limão. CH3 O H CH CH C O H CH3 C CH3 CH CH2 CH2 C CH C O H Dê as nomenclaturas as substâncias responsáveis pelos odores de amêndoas amargas, canela e limão. 6 14. Dê as nomenclaturas IUPAC dos compostos a seguir: (A) OH (B) O (C) O (D) OH OH (E) Br (F) OH 7 15. A vaselina é um produto fabricado a base de óleos parafínicos, sendo uma massa untuosa, de fibra média, insolúvel em água, levemente solúvel a frio ou a quente em álcool, solúvel em éter, hexano, benzina e clorofórmio. Possui elevada estabilidade físico-química, resiste a ação de agentes oxidantes, como poluição, gases ácidos, produtos alcalinos e é incompatível com água. Uma bisnaga de vaselina a 2%, de massa total 250g, apresenta quantos gramas de solvente? 16. A estrutura de um dos três componentes principais responsáveis pelo aroma das rosas está mostrada a seguir. Eles apresentam 60% da massa do óleo essencial das rosas (essencial = relacionado à essência, ao perfume). CH2OH Citronelol a) Classifique a cadeia carbônica do citronelol. b) Dê a fórmula condensada do citronelol. 17. A fórmula estrutural a seguir representa uma substância resinosa chamada gingerol e possui o gosto picante característico do gengibre. Essa substância é utilizada para aromatizar refrigerantes, cervejas, aguardentes e compotas. CH2 CH2 C O HC CH HC C C C CH2 CH CH2 CH2 CH2 CH2 OH O CH3 OH a) Dê a fórmula estrutural atual (bastão) do gingerol. b) Dê a hibridação do carbono terciário. c) Dê o número de moléculas contidas em 5 mols do composto. CH3 8 18. Dê as nomenclaturas dos compostos a seguir: (A) (B) (C) (D) (E) 19. Dê as fórmulas estruturais planas: a) 3-etil-2,5,5-trimetil-octano b) metil propeno 9 20. Dê as nomenclaturas IUPAC dos compostos a seguir: O a) b) O O c) O d) OH Br e) f) OH
Baixar