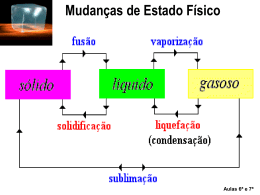
ESTRUTURA DA MATÉRIA A matéria é formada por moléculas, que por sua vez são formadas por partículas minúsculas chamadas de átomos. ESTRUTURA DA MATÉRIA Substância - Corpo - Objeto As Ciências Físicas e Químicas •Fenômenos Físicos e Químicos da matéria •Química do cotidiano •A Constituição da Matéria As Ciências Físicas e Químicas Matéria e seus Estados Físicos Natureza Cinética da Matéria A matéria consiste de átomos e moléculas em movimento. Estados da Matéria • SÓLIDOS — possuem forma rígida e volume fixo. A forma externa pode refletir o arranjo molecular e atômico. – Razoavelmente bem compreendido. • LÍQUIDOS — Não possuem forma fixa e podem não preencher totalmente um recipiente. – Não são bem compreendidos.. • GASES — se expandem para preencher seu recipiente. Estados Físicos PLASMA Plasma é denominado o quarto estado da matéria. Difere-se dos sólidos, líquidos e gasosos por possuir seus átomos separados ao ponto de desprenderem-se dos elétrons. Por este motivo o plasma é também chamado de gás ionizado. Estima-se que 99% de toda matéria existente esteja no estado de plasma, o que faz deste o estado da matéria mais comum e abundante do universo. As Ciências Físicas e Químicas Matéria e seus Estados Físicos As Ciências Físicas e Químicas Mudanças de Estados Físicos da Matéria Mudanças de Estado Físico • As substâncias podem mudar de estado físico (sólido, líquido, gasoso) e isso depende principalmente das condições de pressão e temperatura a que estão expostas. Mudanças Físicas Algumas mudanças físicas: • Ebulição de um líquido • Fusão de um sólido • Dissolução de um sólido em um líquido formando uma mistura homogênea — uma SOLUÇÃO. Mudanças de Estado Físico Ponto de Fusão • O ponto de fusão é Substância o ponto ao água qual uma substância álcool alumínio passa do cloreto de estado sódio sólido ao cobre estado chumbo líquido. enxofre Ponto de Fusão(°C) 0 -114 659 800 1 083 327 119 Ponto de Ebulição •O ponto de ebulição é a temperatura a que um corpo passa do estado líquido ao estado gasoso. Substância Ponto de ebulição (°C) água álcool cobre chumbo 100 78 2 595 1 744 enxofre 445 ferro 3 000 Calor latente Ao receber calor, um bloco de gelo a 0oC derrete, transformando-se em água no estado líquido. Por mais que o gelo receba calor, enquanto está ocorrendo a mudança de estado, sua temperatura permanece constante e, nesse caso, o calor recebido pelo gelo recebe o nome de calor latente. Podemos dizer que calor latente é aquele que provoca mudança de estado de uma substância sem alterar sua temperatura. As experimentações feitas por físicos em laboratórios mostram que a quantidade de calor requerida numa mudança de estado depende da substância (água, ferro, chumbo etc.) e de sua massa. No caso do gelo, são necessárias 80 calorias para que 1 grama passe para o estado líquido. Calor latente Mudanças de Estado Físico Curva de Aquecimento da água T°C G LeG 100 L SeL 0 - 20 S tempo Curva de Resfriamento da água T°C G 100 LeG L SeL 0 - 20 tempo S De Líquido para Gasoso Vaporização De Líquido para Gasoso Vaporização • Divisões da vaporização: a) Evaporação b) Ebulição c) Calefação Divisões da vaporização a) Evaporação: é um processo espontâneo e lento, que se verifica a uma temperatura qualquer e depende da área de contato. Na evaporação, quanto maior a área de contato mais rapidamente se processa a passagem do estado líquido para o gasoso. Divisões da vaporização b) Ebulição: é um processo que se verifica a uma determinada temperatura (a pressão tem influência sobre a temperatura, veremos posteriormente). Logo é um processo forçado. É mais rápido que a evaporação. Divisões da vaporização c) Calefação: ocorre quando uma massa de líquido cai sobre uma superfície aquecida a uma temperatura superior a temperatura de ebulição do líquido. A calefação é um processo quase instantâneo. Ao observarmos gotas d’água caírem sobre uma chapa bem quente, notamos que as gotas vaporizam rapidamente emitindo um chiado característico.
Baixar