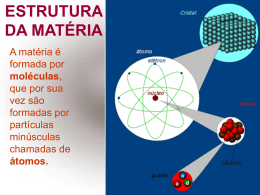
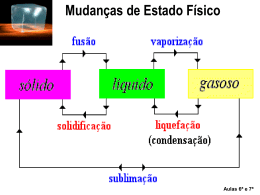
Estados Físicos da Matéria 2ª Série do Ensino Médio Disciplina: Física Professor: Fábio Jaime Raimundo Estrutura da matéria: tudo que existe no universo, desde estrelas e planetas até a poeira de nossas casas, é constituído de matéria, que pode se apresentar das mais variadas formas. Dividindo-se a matéria em pedaços cada vez menores, a menor partícula de matéria sem que a mesma perca suas características originais, é denominada molécula. Se dividirmos a molécula, ela perdera sua característica, obtendo-se, nessa divisão, partículas denominadas átomos. Os átomos são constituídos de prótons, nêutrons e elétrons. Estado sólido: os átomos das moléculas constituintes da matéria estão em um estado de agitação baixo, podendo ser concentrados mais átomos em um mesmo espaço físico. Cristalinos: num sólido cristalino, o arranjo dos átomos, moléculas ou iões é tal, que a soma das forças atrativas globais tem um valor máximo. Estes sólidos apresentam uma organização interna uniforme. Amorfos: a ausência de um padrão de cristalização caracteriza os chamados sólidos nãocristalinos ou amorfos. Entre eles destacam-se os plásticos, os vidros, os sabões, as parafinas e muitos outros compostos orgânicos e inorgânicos. A disposição interna dos componentes materiais dos sólidos amorfos é em grande parte aleatória, semelhante à dos líquidos, que mantêm fixas, contudo, as distâncias de suas ligações moleculares. Estado líquido: ocorre quando as moléculas já estão um pouco mais dispersas, em relação à mesma matéria no estado sólido. Substâncias no estado líquido tem volume fixo, porém a sua forma pode variar. Estado gasoso: acontece quando as partículas que formam a matéria estão bastante afastadas, dispersas no espaço. Por isto elas podem ter a forma e o volume variável. Estados físicos da matéria: estados físicos da matéria ou fases são as diferentes formas de como uma substância pode se apresentar no espaço. Tipos de vaporização: a mudança de estado físico ou de agregação da matéria que ocorre com a passagem do líquido para o gasoso é denominada vaporização. Porém, existem três tipos de vaporização, que são: evaporação, ebulição e calefação. Evaporação: é a mudança de fase do estado líquido para o gasoso de modo gradual, lento. Ela ocorre apenas na superfície do líquido e não é perceptível visualmente, pois não há o surgimento de bolhas nem agitação em seu interior. Ebulição: nesse caso, a passagem do estado líquido para o gasoso é causada por um aumento na temperatura, por isso é mais rápida que a anterior. Há a formação de bolhas, sendo bastante perceptível a olho nu, pois ela ocorre com agitação e em toda a extensão da matéria. Calefação: é uma vaporização muito mais rápida que as duas anteriores. Ocorre quando um líquido entra em contato com uma superfície que está com a temperatura mais elevada que seu ponto de ebulição. Diagrama de fases Calor latente: calor latente é a grandeza física que está relacionada à quantidade de calor que um corpo precisa receber ou ceder para mudar de estado físico. Matematicamente, essa definição fica da seguinte forma: Calor latente de transformação Pressão e mudança de estado: a pressão constante, toda substância sofre mudança de estado a uma determinada temperatura. A pressão constante, durante a mudança de estado a temperatura se mantém constante. Nas mesmas condições, a quantidade de calor recebida (absorvida) ou cedida (liberada) por uma dada substância, durante a mudança de estado, é, em valor absoluto, igual para a unidade de sua massa. Curva de aquecimento Partiu estudos... Vocês estão estudando né pessoal? Bibliografia www.infoescola.com/fisica www.brasilescola.com/fisica www.sofisica.com.br
Baixar