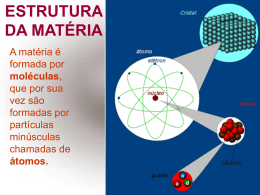
MUDANÇAS DE FASE ESTADO SÓLIDO • Os átomos não sofrem translação, apenas possuem movimento de vibração térmica. • Geralmente se apresentam na forma de cristais. • A mesma substância pode se apresentar em estruturas cristalinas diferentes. SÓLIDOS AMORFOS • Não apresentam regularidade em sua estrutura interna. • Exemplos: vidro, asfalto, plásticos, borracha, etc. Catedral de Notre Dame, Paris, França. FORMAS ALOTRÓPICAS DO CARBONO ESTADO LÍQUIDO • Os átomos podem sofrer pequenas translações. • Na passagem do estado sólido para o estado líquido, a rede cristalina é desfeita. MUDANÇAS DE FASE CRISTAIS LÍQUIDOS Ao serem submetidos a um aumento de temperatura ou a uma voltagem, as moléculas tendem a desordem, aproximando-se da fase líquida. Nessa mudança, notam-se algumas fases intermediárias. Em outros casos, esses materiais podem mudar de cor. LCD – LIQUID CRYSTAL DISPLAY 4ª Fase da Matéria: o Plasma • É um gás de íons. A premissa básica é que o aquecimento de um gás provoca a dissociação das suas ligações moleculares, convertendo-o em seus átomos constituintes. Além disso, esse aquecimento adicional pode levar à ionização (ganho ou perda de elétrons) dessas moléculas e dos átomos do gás, transformando-o em plasma contendo partículas carregadas (elétrons e íons positivos). FUSÃO E SOLIDIFICAÇÃO • A uma dada pressão, a temperatura na qual ocorre a fusão é bem determinada para cada substância. • O calor necessário para uma substância de fundir completamente é característico de cada substância e é denominado calor latente de fusão. (Q=m.Lf) • Durante a fusão, a temperatura do sólido permanece constante. VAPORIZAÇÃO E CONDENSAÇÃO • EVAPORAÇÃO – quando a passagem se faz lentamente. • EBULIÇÃO – quando a passagem se faz rapidamente. • CALEFAÇÃO – quando a passagem é instantânea. LEIS DA VAPORIZAÇÃO • A uma dada pressão, a temperatura na qual ocorre a ebulição é bem determinada para cada substância. • O calor necessário para uma substância vaporizar completamente é característico de cada substância e é denominado calor latente de vaporização (Q=m.Lv). • Durante a ebulição, a temperatura do sólido permanece constante. CURVA DE AQUECIMENTO • O gráfico ao lado representam a variação de temperatura e as mudanças de fase de 1 kg de água. O que representam as linhas horizontais do gráfico? Qual as temperaturas de fusão e ebulição da água, de acordo com o gráfico? Sendo Lf=330.000 J/kg e Lv=2.260.000 J/kg , qual é a quantidade de calor necessária para (a) fundir e (b) vaporizar 1 kg de água? INFLUÊNCIA DA PRESSÃO NA EBULIÇÃO SUBLIMAÇÃO Vamos fazer alguns exercícios? LIVRO PÁGINA: 295 (APLICAÇÃO) e 296 (VERIFICAÇÃO)
Baixar