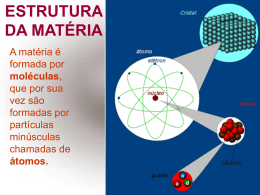
CONSTITUIÇÃO DA MATÉRIA Ciências (Química) – Capítulo 2 Prof. Adriana “Amor” im UNIVERSO = MATERIA + ENERGIA Tudo aquilo que tem massa e ocupa lugar no espaço. TERRA ÁGUA AR MADEIRA OURO Capacidade de realizar trabalho. CINÉTICA LUMINOSA TÉRMICA ELÉTRICA MAGNÉTICA Todas as substâncias são formadas por diferentes tipos de matéria. MATÉRIA: TUDO O QUE MASSA E OCUPA UM LUGAR NO ESPAÇO. CORPO: PORÇÃO LIMITADA DE MATÉRIA OBJETO: CORPO COM FUNÇÃO DEFINIDA Matéria corpo objeto Um mesmo objeto pode ser fabricado com materiais diferentes: A massa de um corpo corresponde a quantidade de matéria contida nele. O volume corresponde a medida do espaço que ele ocupa. A matéria é constituída por partículas muito pequenas denominadas átomos. 1 grão de areia (1mm) / 10.000.000 = tamanho de um átomo Os átomos apresentam vários tipos diferentes, chamados também de elementos químicos. Ex: hidrogênio, oxigênio, ouro, sódio, etc. A união entre átomos é chamada de ligação química. Os átomos de combinam (ligação química) para formar as moléculas ou aglomerados iônicos. H + H H2- Gás hidrogênio O O + O2- Gás oxigênio H + H + o H2O - ÁGUA Um conjunto de espécies químicas iguais – moléculas – forma as substâncias químicas. As substâncias químicas são responsáveis pela constituição de toda e qualquer matéria. Em um fio de cobre, encontramos muitos átomos de cobre. Na grande maioria dos casos, os materiais que constituem um corpo ou um objeto são compostos por várias substâncias químicas diferentes. Ex: No leite encontramos água, lactose, galactose, caseína e albumina, etc. A laranja é constituída por água, frutose, acido cítrico, vitamina C , etc. Na madeira encontramos celulose e lignina, entre outras. A água do mar é constituída água, cloreto de sódio, além e outro vários tipos de sais. PROPRIEDADES DA MATÉRIA A matéria é caracterizada por suas propriedades, podendo ser: GERAIS: quando são comuns a toda espécie de matéria, não importando quais as substâncias a compõem. ESPECÍFICAS: quando dependem das substâncias que a formam, permitindo assim identificar e diferenciar os diversos materiais. Propriedades Gerais • • • • • • Extensão Inércia Massa Impenetrabilidade Divisibilidade Compressibilidade EXTENSÃO É o espaço ocupado por um corpo. Denominamos volume a medida deste espaço. Utilizamos vários produtos comercializados em unidades de medida de volume – como litros e mililitros. INÉRCIA É a propriedade segundo a qual um corpo tende a permanecer na situação em que está, resistindo à variação de seu estado – seja em repouso, seja em movimento – até que uma força atue sobre ele. A bola tende a permanecer parada até que alguém chute. Após o chute, a bola tende a permanecer em movimento, parando quando sofre a ação da força de atrito do solo. MASSA É a quantidade de matéria existente nos corpos. Também pode ser definida como a medida da inércia de um corpo. Muitos produtos são adquiridos em massa Quanto maior for o corpo, maior a dificuldade em movimentá-lo, portanto, maior será sua inércia. IMPENETRABILIDADE Dois corpos não podem ocupar ao mesmo tempo o mesmo lugar no espaço. DIVISIBILIDADE É a propriedade segundo qual a matéria pode ser dividida em porções menores. O almofariz e o pistilo são instrumentos usados em laboratório para macerar sólidos. COMPRESSIBILIDADE A matéria pode ser comprimida, sofrendo redução do seu volume se aplicarmos sobre ela uma força, ou seja, exercermos pressão sobre ela. Propriedades específicas • • • • Propriedades organolépticas Propriedades físicas Propriedades químicas Propriedades funcionais É importante ressaltar que analisando as propriedades especificas, é possível identificar uma substância desconhecida. Propriedades organolépticas: são aquelas que podem ser detectadas pelos órgãos dos sentidos: cor, brilho, odor e sabor. Cor: está relacionada com a luz que ele reflete quando iluminado pela luz branca. Brilho: depende de como o material reflete a luz. Odor: As substâncias podem ser inodoras (sem cheiro), ou odoríferas. SAIBA MAIS: pag. 31 Nunca devemos cheirar substâncias desconhecidas, pois muitas liberam vapores tóxicos que podem provocar náuseas, tonturas e mal estar geral. • Sabor: Algumas substâncias são conhecidas pelo seu sabor característico. • Ácidos comestíveis: ácido cítrico/ ácido acético (vinagre) • Açucares: frutose e sacarose • Amargo: quinino, boldo • Adstringente: caju e banana verde (amarra a boca) • O sabor no entanto não pode ser usado pelos químicos para identificar substâncias desconhecidas, pois elas podem ser tóxicas e venenosas. Propriedades físicas: são elas estados físicos, dureza, maleabilidade, ductibilidade, densidade e solubilidade. 1) ESTADOS FÍSICOS DA MATÉRIA: SÓLIDO No estado sólido, as partículas encontram-se muito próximas e unidas por intensas forças de ligação. Elas vibram em posições fixas. Forma e volume constantes e definidos. Permite pouca compressibilidade. LÍQUIDO As partículas estão mais afastadas uma das outras, reduzindo as forças de ligação que as mantém unidas. Estão mais livres e se movem com facilidade. Forma variável (recipiente) Volume constante GASOSO As partículas encontram-se muito afastadas umas das outras e são praticamente livres. Se movimentam rapidamente em todas as direções e sentidos. A forma e volume são variáveis (de acordo com o recipiente). DUREZA: é a resistência de um material ao ser riscado por outro ou sofrer desgaste quando atritado com outro material. O material mais duro é aquele que consegue fazer um sulco em outro material. É o material de maior dureza e só pode ser riscado por outro diamante. Broca feita com diamante industrial, para perfurar materiais como vidro, granito, aço rochas. MALEABILIADE: é a capacidade que a matéria tem de ser moldada ou transformada em lâminas ou chapas finas para produzir diversos objetos. Comum a maioria dos metais. O ouro é o metal mais maleável que existe. DUCTIBILIDADE: é a propriedade que alguns materiais apresentam de serem transformados em fios. Alguns metais são dúcteis. Utilizados em circuitos elétricos O fio de ouro é utilizado em tratamento estéticos. DENSIDADE: é a propriedade que relaciona a massa de um corpo com o volume que essa massa ocupa. Também chamada da massa específica da matéria. Massas iguais Algodão 1 kg Chumbo 1 kg Volumes diferentes Mesmo volume Massas diferentes Ouro - 19,3 g Alumínio – 2,7g Fórmula da densidade Onde: d= densidade m= massa (g, kg, mg) V= volume (L, mL, cm³, m³) EXEMPLO: se pesarmos 1 litro de água, teremos como massa 1 kg de água. Aplicando a fórmula teremos: d= m/V d= 1 kg/1 L d= 1 kg/L d= 1000g/1000mL d= 1 g/mL • Tabela de densidade de alguns materiais – pág. 35 * Para líquidos, lembre-se de que 1 cm³ equivale a 1 mL: - Álcool – d= 0,8 g/cm³ em cada 1mL de álcool tem massa de 0,8g. - O mercúrio é o metal líquido que apresenta densidade bastante elevada – Cada litro de mercúrio metálico tem massa de 13,5 kg. FLUTUAÇÃO DOS CORPOS - Está relacionada com a sua densidade. - Dois materiais com densidades diferentes: O material mais denso tende a afundar. O material menos denso tende a flutuar. Os icebergs são grandes massas de água no estado sólido, que se deslocam seguindo as correntes marítimas nos oceanos. Em geral, a ponta do iceberg corresponde a menos de 10% do volume total do mesmo. O gelo tem uma densidade ligeiramente menor do que a água. Assim, os icebergs flutuam devido à menor densidade do gelo. • Observe a imagem e responda Por que na água salgada o ovo flutua e na água doce afunda? • O mesmo acontece com a água do mar e da piscina. SOLUBILIDADE Se colocarmos um pouco de óleo em um copo com água, veremos que ele não se dissolve + Entretanto, se colocarmos açúcar em um copo com água, este dissolve-se totalmente no meio líquido. A essa propriedade chamamos solubilidade. da matéria - Todo material que se dissolve é chamada de SOLUTO. - Toda material que dissolve outro material é chamado de SOLVENTE. - O material formado pela interação do soluto e do solvente é chamado de solução. SOLUTO + SOLVENTE = SOLUÇÃO Se colocarmos uma quantidade muito grande de açúcar em um copo com água, o que ocorrerá? AÇUCAR ÁGUA - Parte do açúcar não se dissolveu, ficando no fundo do copo. A solubilidade pode, então, ser definida como a “quantidade máxima de uma substância, denominada soluto, que é possível dissolver em um quantidadepadrão de outra substância, denominada solvente, em dada temperatura.” - Para registrar o valor da solubilidade de um material, verificamos a quantidade de soluto, a quantidade de solvente e a temperatura em que eles se encontram. - Em regra geral, um aumento da temperatura aumenta a solubilidade das substâncias. - Tabela de solubilidade. Pág. 36 - Existem substâncias que não se dissolvem em água e, por isso são chamadas de insolúveis. - O álcool é solúvel em qualquer proporção. - A quantidade de soluto é proporcional a quantidade de solvente, assim em 200g de água, podemos dissolver 72 gramas do cloreto de sódio. MUDANÇAS DOS ESTADOS FÍSICOS DA MATÉRIA • As substâncias podem mudar de estado físico (sólido, líquido, gasoso). • O que diferencia essas substâncias em cada estado físico são as disposições e a agitação das moléculas. • É possível mudar o estado físico de uma substância provocando afastamento e aproximação de suas moléculas, o que é conseguido por meio de alterações na temperatura ou na pressão. • As mudanças de um estado físico para outro recebem denominações específicas FUSÃO Passagem do estado sólido para o estado líquido. Cada substância sofre fusão em um temperatura específica, denominada temperatura de fusão (TF) Tabela de temperaturas de fusão - (TF) Substância TF ao nível do mar água 0ºC ferro 1536ºC ouro 1063ºC alumínio 660ºC chumbo 327ºC prata 950ºC SOLIDIFICAÇÃO Passagem do estado líquido para o estado sólido. É o processo inverso da fusão. Para dada substância, a temperatura de solidificação (TS)coincide com a temperatura de fusão (TF) VAPORIZAÇÃO É a passagem do estado líquido para o estado gasoso. Esse processo pode acontecer de 3 formas diferentes: evaporação, calefação e ebulição EVAPORAÇÃO: passagem lenta e espontânea. Ocorre em qualquer temperatura e é um fenômeno superficial, pois são as moléculas da superfície do líquido que passam para a fase gasosa. Os líquidos apresentam maior ou menor capacidade de evaporação. Exemplos: ciclo da água, roupas no varal, etc. CALEFAÇÃO: é a passagem instantânea. Ocorre quando pequenas porções de líquidos são jogadas em uma superfície muito quente. EBULIÇÃO: é o processo que ocorre em uma temperatura específica para cada substância, chamada de temperatura de ebulição (TE). Ocorre em toda a massa líquida e tem como característica a formação de bolhas. Tabela de temperaturas de ebulição (TE) substância TE ao nível do mar Água 100 ºC Álcool comum 78 ºC Cloreto de sódio 1490 ºC Ferro 3000º C Mercúrio 356 º C CONDENSAÇÃO: também chamada de liquefação, é a passagem do estado gasoso para o líquido. É o processo inverso da ebulição. SUBLIMAÇÃO E RESSUBLIMAÇÃO: passagem do sólido para o gasoso e gasoso para o sólido. ebulição evaporação calefação ressublimação Influência da temperatura e da pressão nas mudanças de estados físicos. - Passando pelos processos de fusão e vaporização e a sublimação é necessário aquecer o material. - Esse aquecimento aumenta a agitação das partículas. - Ocorre o aumento da temperatura e absorção de calor. - Processo chamado de Endotérmico. - Passando pelos processos de solidificação, condensação e ressublimação é necessário reduzir a temperatura do material. - Essa redução da temperatura diminui a agitação das moléculas. - Ocorre diminuição da temperatura e liberação de calor. - Processo denominado Exotérmico. Pressão atmosférica: Toda a massa de ar existente que exerce uma força sobre tudo o que está na superfície da Terra. - Ao nível do mar, a pressão atmosférica atinge o seu valor máximo, que corresponde a 1 atm. - Todas as temperaturas de ebulição e fusão citadas foram consideradas ao nível do mar. O que acontece no processo de ebulição da água? - As moléculas recebem energia em forma de calor e assim agitam-se mais e “escapam” para a atmosfera. - Se a pressão que atua no líquido diminui, as moléculas se desprendem com mais facilidade, ou seja, com menor grau de agitação, reduzindo a temperatura de ebulição. Em Ubatuba a água ferve a 100ºC. Em São José a água ferve a 98º C. No Pico Everest a água ferve a 72ºC.
Baixar