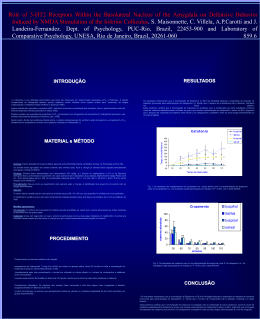
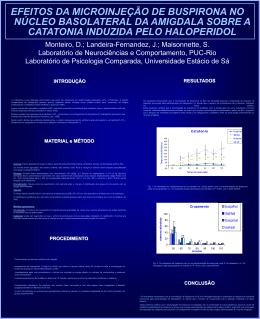
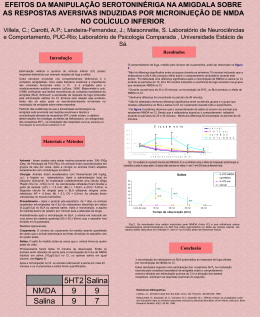
EVIDÊNCIAS DO ENVOLVIMENTO DO SISTEMA GLUTAMATÉRGICO DO COLÍCULO INFERIOR NA CATALEPSIA INDUZIDA POR HALOPERIDOL. Carotti, A.P.; Macedo, M.; Landeira- Fernandez, J.; Maisonnette, S. Laboratório de Neurociências e Comportamento, Puc-Rio; Laboratório de Psicologia Comparada, Universidade Estácio de Sá. Materiais e Métodos Introdução Animais: Foram utilizados 90 ratos, fêmeas Wistar, pesando entre 250-300g criados no Biotério do Dep. de Psicologia da PUC-Rio. Cirurgia: Cada animal foi submetido a uma cirurgia estereotáxica para implantação de uma cânula (26 g.a. Plastics One inc, EUA) no colículo inferior. As coordenadas utilizadas foram: AP=-0.15mm; ML=-0.15 mm; e DV=-0.5mm. Aparato: O campo aberto constitui-se em uma caixa de madeira escura (60 x 60 x 60 cm) cujo assoalho foi dividido em nove quadrados. O catatômetro constitui-se em uma barra horizontal de madeira a 7cm de distância do chão. Medidas operacionais: Cruzamento: O número de cruzamento foi medido através da quantidade de vezes que o animal atravessava as linhas divisórias do assoalho com as quatro patas. Saltos: Foi considerado "salto" todas as vezes que o animal tirava as quatro patas do chão. Catatonia: Tempo em segundos em que o animal permanecia com as duas patas dianteiras no catatômetro. Estudos evidenciam o envolvimento do colículo inferior (CI) nos comportamentos de defesa. Recentemente, foi demonstrado o envolvimento de aminoácidos excitatórios na expressão destas reações (Cardoso e cols.,1992). Microinjeções de N-metil-D-aspartate (NMDA) no CI gerou reações de defesa tais como fuga explosiva acompanhada de saltos. Estes autores descreveram que estes animais apresentavam hiperatividade comportamental alternada com imobilidade tônica indicando alto estado de aversão. O sistema NMDAérgico também têm sido implicado nos processos de memória e déficits motores. A catatonia promovida pela administração de haloperidol tem sido utilizada como modelo para as alterações psicomotoras que ocorrem na doença de Parkinson e na esquizofrenia (Hoffman e Donovan, 1995). Neste sentido, estudos mostram que antagonistas de NMDA revertem a catatonia induzida por bloqueio dopaminérgico (Ozer e cols., 1997). A partir disso, o objetivo desse estudo foi verificar se a imobilidade tônica verificada durante a fuga induzida no CI é equivalente a catatonia induzida pelo haloperidol assim como os efeitos de manipulações NMDAérgicas no colículo inferior sobre a catatonia induzida pelo haloperidol. Resultados Procedimentos Experimento I: Imediatamente após receberem uma injeção i.p. de haloperidol (1.0mg/kg) ou salina, os animais foram submetidos ao teste do campo aberto por 65 minutos. A sessão experimental foi dividida em blocos de 10 minutos, sendo que ao final de cada bloco mediu-se a catatonia. Após 25 minutos, os animais foram retirados do campo aberto, envolvidos gentilmente por um pano e foram microinjetados com 4.1 mol de NMDA (Sigma,EUA) ou salina diretamente no CI. Imediatamente após este procedimento os animais eram recolocados no campo aberto. O desenho experimental dos animais de acordo com as drogas administradas. nmda/hal sal/hal nmda/sal sal/sal Cruzamento 600 349,8 500 400 100 90 80 80,6 70 66,9 58,4 60 57,6 40 45,3 200 34,6 42,4 37,7 24,5 31,8 8,4 30 68,9 31,4 25,1 20 25,8 3,4 10-20 35-45 14,4 9,8 6,8 10 0 50-60 T0 T20 T30 308,7 200 nmda/hal sal/hal sal/nmda sal/sal 234,2 155 123,2 100 61,6 48,2 29,7 87,6 82,3 38,85 Os animais receberam haloperidol i.p. 30 minutos antes de serem submetidos ao teste de campo aberto. Decorrido este tempo os animais receberam uma microinjeção de APV, um antagonista de receptores de NMDA no CI. Imediatamente após este procedimento os animais retornavam ao campo aberto. O desenho experimental dos animais de acordo com as drogas administradas: : APV Salina Haloperidol 10 10 Salina 10 10 * Hoffman, D.C. e Donovan,H. Catalepsy as a rodent model for detecting antipsychotic drugs with extrapyramidal side effect liability. Psychopharmacology, 120:128-133, 1995. * Ozer,H.; Ekinci, A.C. e Starr, M.S. Dopamine D1 and D2-dependent catalepsy in the rat requires functional NMDA receptors in the corpus striatum, nucleus accumbens and substantia nigra pars reticulata. Brain Research, 777:51-59, 1997. T60 T70 7,2 2,4 7,3 4,5 3,8 T80 5,6 2,25 2,1 T90 41,42 apv-hal sal-hal 140 120 100 80 60 40 20 0 apv-sal * * * * 59,4 35,6 0,4 0,25 0,4 0,4 50-60 Tempo de observação F ig . 3 . O s R e s u lta d o s d a c a ta to n ia c o m a c o a d m in is tra ç ã o d e N M D A ( in tra IC ) e h a lo p e rid o l (i.p ) c o m o to ta l d e te m p o e m q u e o ra to p e rm a n e c e im o b iliz a d o no c a ta tô m e tro . Os re s u lta d o s e s tã o e x p re s s a d a s e m m é d ia s e ( p < 0 .0 5 ), c o m o te s te N e w m a n - K e u ls . Conclusões 1. A microinjeção * Cardoso, S.H.; Coimbra, N.C. e Brandão, M.L. Escape behavior induced by microinjections of NMDA into the inferior colliculus. Behav. Brain Res., 63:1724,1993. 35-45 T50 9,4 8,2 4,4 3 Catatonia 0 10_20 T40 13,5 11 6 4 F ig . 4 . O s R e su lta d o s d a ca ta to n ia co m a co -a d m in istra çã o d e A P V (in tra IC ) e h a lo p e rid o l (i.p ) co m o to ta l d e te m p o e m q u e o ra to p e rm a n e ce im o b iliza d o n o ca ta tô m e tro . O s re su lta d o s e stã o e xp re ssa d a s e m m é d ia s e ( p < 0 .0 5 ), co m o te ste N e w m a n -K e u ls. Tempo (s) 400 Tempo (s) Experimento II: Catatonia 209,12 9 6,6 6,5 5,2 Tempo de observação F ig .2 . O s R e s u lta d o s d o co m p o rta m e n to d e c ru za m e n to n o c a m p o a b e rto c o m a c o -a d m in is tra çã o d e N M D A (in tra IC ) e h a lo p e rid o l i.p . O s re s u lta d o s e s tã o e xp re s s a d o s e m m é d ia s e ( p < 0 .0 5 ), c o m o te s te N e w m a n -K e u ls . 300 12,7 9,7 5,8 4 0 Tempo de observação (min) NMDA Salina Haloperidol 9 8 Salina 9 7 apv-hal sal-hal apv-sal sal-sal 50 300 100 Cruzamento de NMDA no CI promove comportamento de fuga, salto, alternados pela imobilidade tônica como previamente descrito na literatura. 2. Microinjeção de APV no CI reverteu a catatonia induzida pelo haloperidol sem alterar a locomoção provavelmente devido ao bloqueio de recetores glutamatérgicos. 3. Microinjeção de NMDA no CI promoveu uma catatonia estatísticamente e operacionalmente similar a catatonia promovida por administração i.p. 4. Estes resultados indicam uma possível interação funcional entre os sistemas glutaminatérgicos e domaminérgicos no CI na expressão da catatonia T0 6,3 11,1 3,5 T20 24,6 10,2 7,9 T30 * 33 15,8 14,1 10,1 T40 83,3 sal-sal 89,7 65,8 51 34,3 15,9 13,8 10,3 T50 19,4 16,2 14,4 T60 23,3 22,4 11,7 10,2 T70 19 11,8 T80 24,56 20,8 10,7 T90 Tempo de observação Abstract: Electrical and chemical stimulation of the inferior colliculus (IC), an auditive structure as suggested by some works in literature related with others motor structures, actuates defensive reactions. The present work examines the interaction between glutamatergic, Nmethyl-D-aspartate (NMDA) microinjection into IC, and dopaminergic systems through catalepsy pharmacologically induced by haloperidol. Thus, in the first experiment, the rats were implanted with cannula in the inferior colliculus for NMDA or saline microinjections. Aversive behaviour responses such as running, jumping, rearing and rotation were observed and measured. Results concludes that NMDA intra IC microinjection promotes intensive escape responses alternating with catalepsy. This characterises as tonic immobility by the horizontal bar test. Haloperidol induced catalepsy through (1 mg/kg) systemic injection did not differ from the catalepsy observed in animals that received NMDA IC microinjection. Furthermore, the second experiment showed the proprieties of microinjection in IC of APV (a NMDA receptor antagonist) in reversing haloperiodol induced catalepsy. Catalepsy behavior results also suggested an interaction between the glutamatergic and dopaminergic system in IC.
Baixar