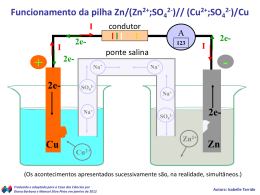
Pilha de Daniell Prof: Alex ([email protected]) Em 1836, o químico e meteorologista inglês John Frederic Daniell construiu uma pilha diferente de Volta, substituindo as soluções ácidas por soluções de sais. John Frederick Daniell construiu uma pilha com eletrodos de cobre e zinco, mas cada eletrodo ficava em uma cela individual, o que aumentava a eficiência da pilha, pois ela possuia um tubo que ligava as duas cubas, este tupo foi chamado de ponte salina. Esta pilha ficou conhecida como pilha de Daniell. Cu2+ + 2e-Cu Dados: Zn2+ + 2e-Zn 2+ Cu Zn + 2e Cu 2+ Zn Zn(s) + + o 2e E = Eo= +0,34 V (mantém) Eo= -0,76 V o E= (inverte) +0,34 V +0,76 V 2+ 2+ Cu (aq) Zn (aq)+ Cu(s) (Equação global da pilha) (ddp= + 1,1 V) Representação IUPAC para a pilha: Zn / Zn2+ // Cu2+ / Cu (ânodo) (cátodo) (S.R.R) (S.R.O) Funcionamento da Pilha Cu2+ + 2e-Cu Zn Zn2+ + 2e- Aumenta a concentraçãoZn2+ de cátions Zn2+ Zn2+ Zn2+ SO42- Zn2+ SO42- SO42-Diminui a concentração de cátions 2SO4 Zn2+ SO42- SO42- Funcionamento da Pilha ddp=Eo=voltagem=fem= Eo(maior) – Eo(menor)= 0,34 – (-0,76)= 1,1 V e- e- e- e- e- e- e- e- e- e- e- e- e- e- V e- E0red Zn = - 0,76 V e- Zn+2 Zn Zn+2 Zn+2 e- E0red Cu = +0,34V -Cl-Cl- K+K+K+K+K+ Cl-Cl-Cl Ponte salina KCl Cl K+ ClClK+ ClK+ ClClK+ ClZn+2 K+ ClSO4-2 Cu2+ + +2 Cl K Zn ClK+ K+ K+ K+ SO4-2 Cl4 Cl Cl Cl SO eee- + Cu SO4-2 Ânodo (-) : Cátodo (+) : Zn0 Zn+2 + 2e- Cu+2 + 2e- Cu0 (Oxidação do zinco metálico) (Redução dos íons cobre) Funcionamento da Pilha O QuickTime™ e um descompressor são necessários para ver esta imagem. A ponte salina O QuickTime™ e um descompressor são necessários para ver esta imagem. Revisão: Pilha de Daniell O QuickTime™ e um descompressor são necessários para ver esta imagem. Revisão: Pilha de Daniell (Inglês) O QuickTime™ e um descompressor são necessários para ver esta imagem.
Baixar
![Pilhas Alcalinas 2[1]](http://s1.livrozilla.com/store/data/000255829_1-8ff48320fd53e545e4e4b0f7acd7661e-260x520.png)