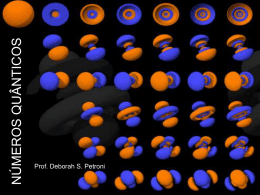
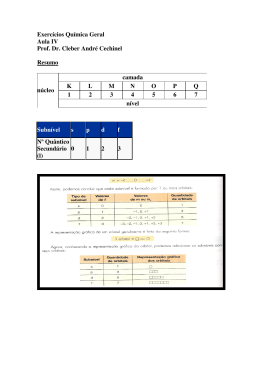
APRIMORAMENTO 01 15/03/14 PROFESSOR OLIVER K. HELFERICH EXERCÍCIO 04 RUTHERFORD (1911) A MASSA ESTÁ CONCENTRADA NO NÚCLEO CONCEITO 1926 Werner Heisenberg (1901-1976) É impossível determinar, simultaneamente, com absoluta precisão, a velocidade e a posição de um elétron em um átomo. NÚMEROS QUÂNTICOS CÓDIGOS MATEMÁTICOS ASSOCIADOS A ENERGIA DO ELÉTRON. A caracterização de cada elétron no átomo é feita por quatro números quânticos: 1. Principal (n) 2. Secundário (ou azimutal)(l) 3. Magnético (m) 4. Spin (s ou ms) 1. Principal (n) Indica o nível de energia do elétron. Em um mesmo átomo não existem dois elétrons com os mesmos números quânticos. 2. Secundário (l) Está associado ao subnível de energia do elétron. Em um mesmo átomo não existem dois elétrons com os mesmos números quânticos. 3. Magnético (m) Está associado à região de máxima probabilidade de se encontrar o elétron, denominada orbital. Cada orbital comporta no máximo 2 elétrons e é representado graficamente por □ ou ○ . Os orbitais estão relacionados com os subníveis; por esse motivo, os valores de m variam de –l a +l. CONCEITO DE ORBITAL REGIÃO DE MÁXIMA PROBABILIDADE DE SE ENCONTRAR O ELÉTRON NO ÁTOMO. ORBITAL S ORBITAL P CONCEITO DE ORBITAL CONCEITO DE ORBITAL O movimento do elétron ao redor do núcleo foi descrito por Erwin Schrödinger, em 1927, mediante equação matemática que relaciona a natureza corpuscular (partícula), a energia, a carga e a massa do elétron. As soluções numéricas para essa equação, denominadas números quânticos, permitem que cada elétron seja caracterizado pela sua quantidade de energia. 4. Spin (s ou ms) Está relacionado à rotação do elétron. Esse número quântico é utilizado para distinguir os elétrons de um mesmo orbital. A um deles atribui-se arbitrariamente o valor +1/2 e ao outro, o valor –1/2. Distribuição eletrônica em orbitais Princípio da exclusão de Pauli Num orbital existem no máximo 2 elétrons com spins opostos. Regra de Hund Os orbitais de um mesmo subnível são preenchidos de modo que se obtenha o maior número possível (desemparelhados). de elétrons isolados Exemplo 01 Os orbitais de um mesmo subnível são preenchidos de modo que se obtenha o maior número possível de elétrons isolados (desemparelhados). Exemplo 02
Baixar