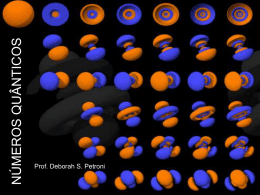
Estrutura eletrônica dos átomos Universidade Federal de Itajubá Nathan Corsini Leitao-15870 Ricardo Paulo Deperon Inard-15889 Professor: Élcio Barrak 05/11/2015 1 Natureza ondulatória da luz Para entender a base da estrutura eletrônica devemos então conhecer um pouco sobre a natureza da luz. A luz que podemos enxergar é um tipo de radiação eletromagnética, que tem características semelhantes às ondas formadas na água após a ação de algum agente esterno. 05/11/2015 O movimento de picos e depressões acontece periodicamente. A distancia entre dois picos ou entre duas depressões é chamada de comprimento de onda. O numero de comprimentos de onda que passam um ponto a cada segundo é chamado de freqüência. 2 A velocidade de uma onda eletromagnética está diretamente relacionada ao comprimento de onda e a freqüência, e podemos achar seu valor através da expressão : Podemos ver a luz, devido a reações químicas que elas provocam em nossos olhos e podem ser caracterizadas pelo comprimento de onda que possuem. 05/11/2015 3 Teoria Quântica Planck deu o nome de quantum à quantidade fixa de energia que podia ser liberada ou absorvida como radiação eletromagnética. Ele considerou que a quantidade de energia E, de um único quantum é igual à constante multiplicada pela freqüência. E=hf 05/11/2015 sendo h=6,63x10^-34 4 Efeito fotoelétrico Em 1905 Einstein usou a teoria quântica para explicar o efeito fotoelétrico, observado em seu experimento, onde a luz que incidia numa superfície limpa metálica levava-a a emitir elétrons. 05/11/2015 5 Espectros de linha 05/11/2015 Quando a radiação é separada em seus diferentes comprimentos de onda, forma-se o espectro. A equação de Balmer foi estendida para um equação mais geral, que ficou conhecida como equação de Rydberg, que permitiu calcular os comprimentos de onda de todas linhas espectrais do hidrogênio. 6 Modelo de Bohr 05/11/2015 Os estados de energia do átomo de hidrogênio: Usando as equações de movimento e interação entre cargas elétricas, Bohr calculou os níveis de energia correspondentes a cada órbita permitida. Essas energias encaixavam-se na seguinte fórmula: 7 Comportamento ondultório da matéria Então De Broglie propôs que o comprimento de onda característico do elétron ou qualquer outra partícula depende de sua massa e de sua velocidade Onde h é a constante de Planck e mv é o momento do corpo 05/11/2015 8 Mecânica quântica e orbitais atômicos Em 1926, Schrödinger lançou as bases da mecânica ondulatória ao apresentar um modelo atômico no qual os elétrons eram vistos como partículas-onda. Esse modelo, válido até hoje, mostrou que é impossível determinar corretamente a trajetória de um elétron, já previsto anteriormente por Heisenberg através do princípio da incerteza: “é impossível determinarmos simultaneamente a posição e a quantidade de movimento de um elétron, com exatidão em um certo instante”. 05/11/2015 9 A mecânica quântica nos permite conhecer os estados de energia possíveis de um sistema através da analise dos números quânticos. Dessa forma, cada elétron é caracterizado por 4 números quânticos os quais mostrarão sua situação energética. Esses números são: 1) principal (n) 2) secundário(ℓ) 3) magnético(m) 4) spin(s) 05/11/2015 10 1) Principal (n): Designa o nível de energia/camada do elétron. Varia de 1 a 7 , de modo que conforme o aumento do número, aumenta o nível de energia do elétron e também o tamanho do orbital devido a distancia do núcleo. 05/11/2015 11 2) secundário(ℓ): Também conhecido como azimutal, varia de zero a (n-1) para cada valor de n Define o formato do orbital e se relaciona com os subníveis de energia (s, p, d, f) 05/11/2015 12 3) magnético(m): Relaciona-se com a quantidade de orbitais em cada subnível, assumindo o valor de -ℓ...0...+ℓ. Cada valor d m representa um orbital. 05/11/2015 13 4) spin(s) Possivelmente realcionado com o sentido de rotacao do eletron. Um eletron pode apresentar dois tipos de spin, deduzidos como sendo: 05/11/2015 14 Representação de orbitais Segundo o modelo atual, o elétron é partícula- onda, o que significa que possui as característica dupla, de partícula e onda. É impossível determinar a posição correta do elétron. Em função dessas duas características, o modelo propõe uma região onde se tem grande probabilidade de se encontrar o elétron, essa região é denominada ORBITAL. 05/11/2015 15 6.7 – Átomos Polieletrônicos Simplificadamente, a idéia de um átomo polieletrônico é que para certo valor d (n) , a energia de um orbital aumenta com o aumento do valor d (ℓ). 05/11/2015 16 Princípio da exclusão de Pauli 05/11/2015 Em 1925, Wolfgang Pauli afirmou que, em um átomo, dois elétrons não podem apresentar a mesma configuração de números quânticos. Essa regra ficou conhecida como princípio da exclusão de Pauli. Chegando a conclusão que cada orbital só aceita no Maximo dois elétrons. 17 Diagrama de Pauling 05/11/2015 Confeccionou um sistema que determina a ordem crescente de energia dos subniveis atômicos. 18 Regra de Hund 05/11/2015 Princípio da Máxima multiplicidade O preenchimento dos orbitais de mesmo subnivel deve ser feito de modo que tenhamos o maior numero de elétrons desemparelhados (isolados). 19 - Configurações eletrônicas na tabela periódica 05/11/2015 20
Baixar