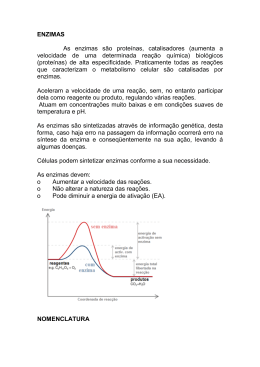
1 5 – Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam os eventos metabólicos - Possuem substratos específicos e precisam da sua conformação protéica natural para funcionar b) Nomenclatura das enzimas Nome recomendado: sufixo ase - Prefixo que designa o substrato: glicosidase, urease - Prefixo que designa a reação: lactato desidrogenase, catalase Nome sistemático: sufixo ase - Nome complexo que descreve a reação: D-gliceraldeído 3 fosfato: NAD Oxiredutase c) Propriedades das Enzimas - Possuem sítios ativos Formados por aminoácidos São superfícies tridimencionais complementares ao substrato E + S <======> ES <======> EP <======> E + P - Eficiência catalítica As reações catalisadas por enzimas são mais rápidas Capacidade de transformar 100 a 1000 moléculas de substrato por segundo - Especificidade São altamente específicas aos substratos e às reações químicas - Co-fatores e co-enzimas Algumas enzimas precisam se associar a um co-fator não protéico, chamado de grupo prostético Podem ser minerais (ferro, zinco) ou moléculas orgânicas (vitaminas) Holoenzima = enzima + coenzima ou íons metálicos Apoenzima = parte protéica da enzima - Regulação Podem ser ativadas ou inibidas de acordo com a necessidade da célula São modificadas por fosforilação, glicosilação, etc... 2 - Localização na célula Muitas estão dentro de organelas específicas d) Classificação das Enzimas - Divididas em seis classes de acordo com a função que exerce e) Mecanismo de ação Sua ação ocorre em condições ideais de pH, temperatura e em ambiente aquoso Velocidade de reação - O catalisador aumenta a velocidade de reação, sem alterar o equilíbrio da reação Energia de ativação - As moléculas possuem energias livres próprias e diferentes entre si - Por exemplo: S <===> P O substrato e o produto possuem suas energias livres próprias, sendo o estado fundamental Como a reação é reversível, existe um nível energético que favorece a reação nos dois sentidos, chamada de estado de transição, momento em que a reação ocorre 3 A diferença energética entre o estado fundamental e o estado de transição é chamada de Energia de Ativação Se a energia de ativação é alta a reação ocorre mais lentamente As enzimas (catalisadores) diminuem a energia de ativação, acelerando a reação, à custa da energia de ligação liberada das ligações entre a enzima e o substrato A mesma enzima catalisa a reação nos dois sentidos e ela não é gasta no processo O aumento da temperatura também diminui a energia de ativação e logo aumentam a velocidade da reação Conceito de Chave e Fechadura - É um conceito errado - Os substratos não se encaixam perfeitamente nas enzimas - A enzima deve ser complementar ao estado de transição da reação - No estado de transição há o aumento das ligações entre o substrato e a enzima, aumentando a energia livre, diminuindo a energia de ativação e aumentando a velocidade. 4 f) Cinética Enzimática - Estuda a velocidade da reação e como ela se modifica em resposta às alterações do meio Concentração do substrato - Aumenta a velocidade da reação até atingir a velocidade máxima (Vmax.) E + S <===> ES <===> E + P - O patamar é alcançado quando praticamente todas as enzimas estão no estado ES 5 Constante de Michaelis-Menten (Km) - O Km é característico de um substrato e uma enzima e representa a concentração necessária de substrato para saturar 50% das enzimas e atingir metade da Vm - O Km reflete o grau de afinidade entre a enzima e o substrato Baixo Km representa afinidade elevada Alto Km representa afinidade baixa 6 Temperatura - A temperatura aumenta a velocidade até atingir um pico de velocidade - Neste momento a energia de ativação necessária foi atingida porque existem muitas moléculas liberando energia - Se a temperatura subir demais causa desnaturação e inativação da enzima, e a velocidade decai pH - A concentração de H+ altera a velocidade por causar ionização do sítio ativo - A reação pode requerer grupos químicos específicos no sítio ionizado ou não ionizado Ex. Grupo amino protonado ( - NH3+) em pH alcalino está desprotonado - pH ótimo – cada enzima possui um pH ótimo, que dependerá do seu local de atuação Ex. pepsina – pH = 2 - Desnaturação protéica – ocorre com extremos de pH 7 g) Inibição enzimática - Inibidor é uma substância que diminui a velocidade de uma reação Inibição reversível Inibição irreversível Inibição competitiva – o inibidor se liga reversivelmente ao sítio que seria ocupado pelo substrato e compete por ele A velocidade diminui, mas pode ser aumentada se aumentar a quantidade de substrato O Km aumenta, pois mais substrato será necessário para chegar na Vmax. Inibição não competitiva – o inibidor e o substrato se ligam em diferentes sítios na enzima Se liga na enzima ou no complexo ES, impedindo que a reação ocorra A velocidade diminui e não adianta aumentar a quantidade de substrato O Km não se altera, pois o substrato se liga a enzima com a mesma afinidade h) Regulação enzimática - A regulação da velocidade das reações permite ao organismo regular suas diferentes funções Sítios de ligação alostéricos - Enzimas alostéricas são reguladas por efetores, que se ligam em sítios diferentes do sítio ativo do substrato - O efetor pode ser negativo ou positivo - Ele modifica sua afinidade ou modifica a capacidade catalítica da enzima Modificação covalente - Adição ou remoção de grupos fosfato, de serina, treonina ou tirosina - A enzima pode se tornar mais ou menos ativa Indução e repressão da síntese - Controle feito pelas células - São aquelas que atuam em fases do desenvolvimento ou em condições fisiológicas específicas - É mais lenta (horas ou dias) do que a condição alostérica (segundos ou minutos)
Baixar