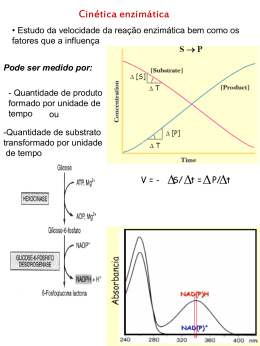
Enzimas (Parte II) Bioquímica para Enfermagem Prof. Dr. Didier Salmon MSc. Daniel Lima Cinética Enzimática • Estudo da velocidade da reação e dos fatores que a influenciam • Pode ser medido por: – Quantidade de produto formado por unidade de tempo – Quantidade de substrato consumido por unidade de tempo V = -ΔS/Δt = ΔP/Δt Cinética Enzimática 5[S] 4[S] 3[S] 2[S] [S] tempo Velocidade da reação [produto] Cinética Enzimática [S] V0 e Vmáx • V0 sobe linearmente a medida que se aumenta a concentração de substrato, e então começa a se nivelar e se aproximar de um ponto máximo onde a velocidade não aumenta, mesmo em concentrações maiores de substrato. Velocidade da reação é proporcional a S Substrato satura todas as moléculas de enzima V0 e Vmáx Substrato Único E+ S K1 K -1 ES K2 K -2 Hipótese: etapa limitante E+P • Após curto tempo - estabilidade dinâmica com relação a [E] e [ES] é alcançado Substrato Único • Estado estacionário - [ES] constante – Ou seja: formação do complexo = sua degradação • V0 é determinado pela quebra de ES formando o produto – V0 = k2[ES] • [ES] difícil de determinar. Alternativa! [Et]=[E] + [ES] • As velocidades de formação e quebra de ES são determinadas pelas etapas governadas pelas constantes k1 (formação) e k-1 + k2 (quebra em reagentes e produtos) – V de Formação de ES = K1 [E] [S] – V de degradação de ES = K –1[ES] + K2 [ES] Substrato Único • Uma vez que a degradação de ES é igual a sua formação, temos: – k1 ([Et]-[ES]) [S] = k–1[ES] + k2 [ES], ou seja: – k1[S][Et] - k1[S][ES] = (k–1+ k2) [ES] – Dessa forma: [ES] = • Se V0=k2[ES] – V0 = k2. [Et] [S] [S] + Km [Et][S] [S] + (k-1 + k2)/k1 Km [Et]=[E] + [ES] Equação de Michaelis-Menten • Na Vmax, [ES] = [Et], assim: – Vmax = k2[Et] – Substituindo na equação anterior V0 = k2. [Et] [S] [S] + Km temos, V0 = Vmax [S] [S] + Km Propriedade Importante • Quando V0 = Vmax, temos: 2 Vmax = Vmax [S] , 2 [S] + Km Km + [S] = 2 [S], Km = 2 [S] – [S] Km = [S] Km = [S] • Ou seja, o Km é igual a concentração do substrato quando a velocidade inicial é metade da velocidade máxima Km • Característico de cada enzima. • Reflete a afinidade da enzima pelo seu substrato. Equação de Lineweaver-Burk V e [Enzima] • A velocidade da reação é proporcional à concentração da enzima • Facilita a determinação da concentração de uma enzima • Dosagens (transaminases, LDH, amilase, fosfatase alcalina) v0 [E] Mais de um substrato... • Ex: ATP + d-glicose → ADP + d-glicose-6-fosfato Mais de um substrato... • Reações em que há 2 substratos envolvem a transferência de átomos ou grupos funcionais de um substrato para o outro: Sequencial (formação do complexo ternário) Pingue-pongue ou duplo deslocamento Inibidores • A atividade das enzimas pode ser diminuída ou parada por várias substâncias chamadas de inibidores. • Existem inibidores naturais, fazendo parte dos constituintes da célula, e outros estranhos ao organismo que podem provocar alterações do metabolismo celular. • Aqueles encontrados nas células são fundamentais para a fisiologia pois permitem às células um controle preciso da velocidade de algumas reações chave, permitindo uma resposta integrada à mudança das condições fisiológicas. • Inhibição específica de certas enzimas permita as aplicações farmacológicas – Ex: sulfonamidas: usadas para combater as infecções bacterianas Sulfonamidas • Inibidores competitivos da diidropteroato sintetase (dhps), enzima importante envolvida no metabolismo dos folatos (síntese de DNA e RNA) de muitos organismos menos o homem. • Os folatos nos serem humanos são fornecidos pela dieta. • Toxicidade seletiva para bactérias. • Utilizados para tratar: – Pneumonia a pneumocystis (Pneumocystis jirovici, P. carinii) IO em pacientes HIV + – Infecção do trato urinário – Shigelose (Desinteria) – Algumas infecções por protozoários (Plasmodium falciparum) Inibidores • Largo campo de aplicação para o combate de insetos • Ex: enzimas digestivas de insetos como as α-amilases catalisam a hidrólise de ligações glicosídicas α-1,4 do amido, glicogênio e outros carboidratos. Essas enzimas são muito importantes para os insetos, especialmente para aqueles que se desenvolvem em grãos ricos em amido. (No feijão foram identificados 4 desses inibidores) • Desenvolvimento de plantas mais resistentes ao ataque das pragas contribuindo para a redução do uso de inseticidas químicos. Inibidores • Importância: – Agentes farmacêuticos – Ferramentas no estudo de mecanismo de funcionamento das enzimas – Ferramenta nos estudos das vias metabólicas Irreversíveis Inib. Competitiva (freqüente) Reversíveis Inib. Acompetitiva (quando o inibidor liga-se ao complexo ES , mas não a enzima livre) Inibidores Inib. Mista Inib. Não-competitiva (caso particular de inib. Mista) Inibidor Irreversível • 1-Reagentes específicos para grupo (R) • 2- Análogos de substrato • 3- Inibidor suicida 1 2 Inibidores Reversíveis Semelhança estrutural entre S e I Não há semelhança estrutural entre S e I Não há semelhança estrutural entre S e I • Inibidor competitivo – Estrutura semelhante à do substrato – Liga-se ao Sítio Ativo da enzima – Aumento da [substrato] diminui a inibição – A Vmax NÃO se altera – Km da enzima AUMENTA na presença do inibidor • Inibidor não competitivo – Não tem estrutura semelhante à do substrato – Não se liga ao Sítio Ativo da enzima – Aumento da [substrato] não diminui a inibição – A Vmax diminui na presença do inibidor altera – Km da enzima não se altera Inibição Competitiva Su bst r at o (m M ) V0 (sem in ibid or ) m m ol .L -1 .m i n -1 5 7.5 1 0.0 1 0.7 1 2.5 1 3.6 1 3.5 0.2 0.4 0.8 1.0 2.0 4.0 6.0 -1 V0 (mol.L .min ) 15 Sem inibidor 10 -1 Com inibidor 5 0 0 1 2 3 4 Substrato (mM) 5 6 7 V0 (com in ibid or ) m m ol .L -1 .m i n -1 3 5 7.5 8.3 1 0.7 1 2.5 1 3.5 Inibição Competitiva Inibição Não-Competitiva Inibição Incompetitiva • O inibidor se liga somente no complexo ES, em sítio próprio Analgésicos – Inibidores de Prostaglandinas • Ligação covalente – Inibidor irreversível (suicida) - Aspirina • Interações sem ligação covalente – Inibidor competitivo e reversível – Ponstan Regulação de perfusão renal Agregação plaquetária Protetora de mucosa gástrica Inflamação Sítio Ativo da COX Inibidor competitivo e reversível da COX-1/2 Interação iônica Dipirona sódica Inibidor competitivo e reversível da COX-2 Meloxicam Inibidores de Proteases do HIV • Gag e Pol são clivados pela protease do HIV em 9 pontos específicos para produzir proteínas funcionais. – O precursor Gag vai originar proteínas estruturais – O precursor Pol vai originar enzimas como transcriptase reversa, integrase e proteases. Amprenavir Ciclo de replicação do HIV Enzimas Alostéricas Sistema multienzimático sequencial Enzimas Alostéricas • Analogia com proteínas alostéricas: Hemoglobina • Moduladores alostéricos (≠ de inibidores não-competitivos ou mistos!!) • Mudanças conformacionais entre forma ativa e inativa e parâmetros cinéticos diferentes (≠ do Michaelis-Menten) • Homotrópicas ou heterotrópicas Enzimas Alostéricas • Reguladas por moduladores alostéricos → envolvendo ou não o sítio ativo • Várias subunidades • Inibição por retroalimentação • Exemplo: Aspartato transcarbamilase • 12 cadeias polipeptídicas • Azul: catalítica • Vermelho/Amarela: regulatórias Aspartato Transcarbamilase Síntese de pirimidinas Modulador Alostérico • Pode ser tanto um inibidor quanto um ativador. Michaelis-Menten Enzimas Alostéricas Enzima Homotrópica Efeito moduladores Efeito moduladores Exemplos de Enzimas Regulatórias PFK-1 Modificação Covalente Reversível Exemplos de Enzimas Regulatórias Glicogênio Fosforilase Ativação Proteolítica Fatores que afetam a Velocidade Enzimática pH Temperatura Concentração de substratos Concentração de cofatores Presença de Inibidores e/ou ativadores Modificações químicas: fosforilações, adenilações, etc Concentração de enzima
Baixar