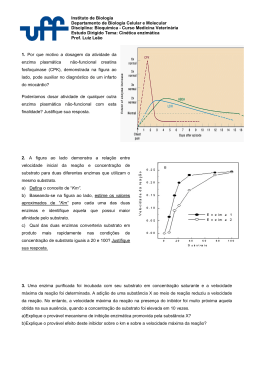
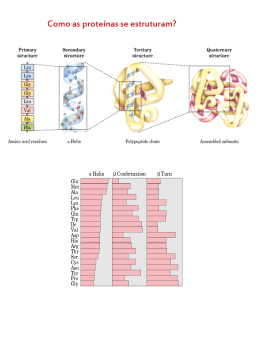
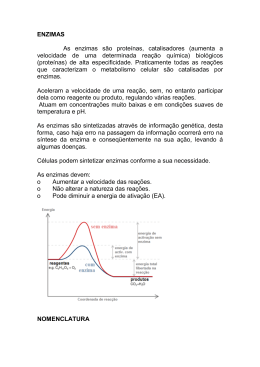
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade de uma enzima – pH, temperatura e substrato Parâmetro mais importante para comparar a atividade e o tipo de reação das enzimas é a concentração do substrato Atividade enzimática é afetada pelo pH O pH pode influenciar a atividade de uma enzima através de maneiras distintas. Primeiramente, o pH pode levar à desnaturação proteica. O pH também pode interferir na atividade de uma enzima alterando o padrão de cargas de um determinado sítio ativo ou catalítico, ou alterando a conformação geral da proteína. Atividade enzimática é afetada pela temperatura O aumento de temperatura aumenta a taxa de reação enzimática devido ao aumento de energia cinética das moléculas participantes da reação. A temperatura pode interferir nas interações que mantém as estruturas secundárias e terciárias (pontes de hidrogênio e interações hidrofóbicas), podendo levar à desnaturação protéica. A concentração do substrato afeta a velocidade das reações catalisadas por enzimas enzima Curva que relaciona [S] e V0 é uma hipérbole, concentrações mais baixas aumento linear da velocidade, concentrações mais altas velocidade atinge um valor máximo Concentrações baixas de substrato ocorre aumento linear entre Velocidade(V0) e o Substrato [S] [S] V0 aumenta cada vez menos até atingir um patamar (Vmax) Curva relacionando [S] e V0 pode ser expressa algebricamente Equação de Michaelis-Menten Constante de Michaelis TAREFA – Fazer para entregar a dedução da equação de Michaelis-Menten O que é Km ? É a concentração do substrato onde se obtém metade da velocidade máxima da reação TAREFA – Demonstrar algebricamente o que é Km usando a equação de Michaelis-Mentem e a definição de Km. Km e a Vmax varia de enzima para enzima caracterizandoas e pode variar também com o substrato Rubisco •Km CO2 - 9μM •Km O2 - 350 μM Hexoquinase Glicose Km - 0,05 μM Frutose Km -1,5 μM Km não é uma medida de afinidade da enzima pelo substrato mas sim a concentração do substrato onde se obtém a metade da velocidade máxima da reação Equação de Michaelis-Menten Transformações da equação de Michaelis-Menten Equação de Lineweaver-Burk ou duplo-recíproco Inversão dos dois lados da equação de Michaelis-Menten Separação dos componentes do lado direito. Equação de Lineweaver-Burk ou duplo-recíproco inverter Separar componentes e resolver y = Km a 1 x + b y Com essa transformação matemática passa-se a trabalhar com uma reta e não com uma hipérbole, mais fácil. Várias informações podem ser obtidas com esse gráfico x a = coeficiente angular y=0 b = coeficiente linear x=0 Através da análise da cinética da reação pode-se descobrir qual o mecanismo de ação da reação com relação ao substrato A atividade de todas as enzimas pode ser inibida por determinadas moléculas Inibidores enzimáticos São moléculas que interferem com a catálise diminuindo ou interrompendo a reação enzimática Como são classificados os inibidores de acordo com seu mecanismo de ação? Reversíveis Irreversíveis Inibição competitiva Inibição incompetitiva Inibição mista ou não competitiva Como eles atuam? Reversíveis - Inibição competitiva Inibidor compete com o substrato pelo sitio ativa da enzima Inibidor tem estrutura molecular semelhante à do substrato [S] deslocar inibidor do sítio ativo e manter Vmax V max é constante na presença do inibidor devido à grande quantidade de substrato Reversíveis - Inibição incompetitiva Inibidor se liga em um sítio diferente do centro ativo, impede a reação do complexo ES. Independente da concentração do substrato o Km e a Vmax estão alterados Reversíveis - Inibição mista ou não competitiva Inibidor se liga tanto ao complexo ES como à enzima, em um sítio diferente do centro ativo Independente da concentração do substrato o Km e a Vmax estão alterados Inibição irreversível Inibidor se liga de maneira estável ou covalente com um grupo funcional importante para a atividade enzimática Utilizados experimentalmente para definir os aminoácidos essenciais do centro ativo das enzimas Inativar determinadas enzimas em situações biológicas importantes Este é o mecanismos de ação dos inseticidas organofosforados, como o malathion e o parathion. Reagem com o resíduo S1 de serino-enzimas, formando um complexo irreversível. Uma das enzimas altamente sensível a esses compostos é a acetilcolinesterase, responsável pela metabolização do neurotransmissor acetilcolina em neurônios centrais e periféricos (envenenamento por organofosforados) Salicina, extraída da casca do Salgueiro Branco ou Chorão (Salix alba) - hoje sintetizada No metabolismo celular grupos de enzimas trabalham em conjunto onde o produto de uma é o substrato da outra Via metabólica Nessas vias existe sempre uma enzima que determina a velocidade com que o grupo vai trabalhar – enzimas reguladoras •Regulam a velocidade das reações metabólicas •São reguladas por determinados sinais •Tipos: Enzimas alostéricas Enzimas reguladas por modificações covalentes reversíveis Enzimas reguladas por proteólise Enzimas alostéricas •Possui sítios reguladores para a ligação do modulador especifico •Maiores e mais complexas que as não alostéricas (mais que uma cadeia polipeptídica) Sofrem modificações conformacionais em resposta à ligação do modulador (positivo ou negativo) Enzimas reguladas por modificações covalentes reversíveis •Diferentes grupos podem se ligar á molécula enzimática e regular sua atividade •Grupos ligados covalentemente e removidos pela ação de outras enzimas Enzimas reguladas por proteólise Enzimas proteolíticas – mecanismo de proteção/regulação Enzimas digestivas produzidas pâncreas e com ação no duodeno. Cadeias ligadas por ligações dissulfeto Bothrops (Jararacas) 90% acidentes no Estado de SP – janeiro a abril – sexo masculino Alteração nas enzimas envolvidas na cascata de coagulação do sengue - hemorragia
Baixar