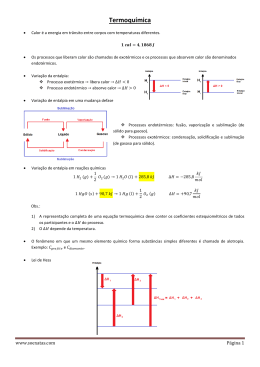
TERMOQUÍMICA Sérgio de Souza REAÇÃO EXOTÉRMICA A + B C + D + HR > HP HR CALOR LIBERADO ∆H HP CAMINHO DA REAÇÃO REAÇÃO EXOTÉRMICA REAÇÃO ENDOTÉRMICA A + B + C Hp > Hr CALOR ABSORVIDO HP ∆H HR CAMINHO DA REAÇÃO + D REAÇÃO ENDOTÉRMICA EQUAÇÃO TERMOQUÍMICA REPRESENTAÇÃO DO CALOR NA REAÇÃO Equação química ajustada O estado físico de todas as substâncias Variedade alotrópica Indicação da entalpia molar por mol do produto ou reagente Indicação das condições de pressão e temperatura ESTADO PADRÃO É impossível determinar experimentalmente entalpia ( H ) absoluta de uma substância. a O estado padrão de uma substância é o seu estado físico mais comum e a variedade alotrópica mais estável em condições ambientes. Se uma substância simples estiver no estado padrão, a ela será atribuída, por convenção, a entalpia zero ( H=0) CONCLUSÃO Convencionou-se entalpia zero para determinadas substâncias simples, em razão de não ser possível medir o valor real da entalpia de uma substância. Foram escolhidas condições-padrão para estabelecer medidas relativas. Terá entalpia zero qualquer substância simples que se apresente nos estados físico e alotrópico mais comum, a 25ºC e 1 atm de pressão. EXEMPLOS Elemento Químico Substância Simples no Estado Padrão Hidrogênio Oxigênio Carbono Enxofre H2(g) O2(g) C(grafite) S(rômbico) ALOTROPIA Mesmo elemento químico formando substâncias simples diferentes CARBONO GRAFITE CARBONO DIAMANTE ENXOFRE RÔMBICO ENXOFRE MONOCLÍNICO FÓSFORO BRANCO GÁS OXIGÊNIO FÓSFORO VERMELHO GÁS OZÔNIO ESTABILIDADE DAS FORMAS ALOTRÓPICAS Estáveis Instáveis O2 C(g) P4(v) O3 C(d) P4(b) S(r) S(m) OBSERVAÇÃO A variedade alotrópica mais reativa é mais energética ENTALPIA PADRÃO Temperatura de 25ºC Pressão de 1 atm Forma alotrópica mais estável Estado físico mais comum da substância ∆H° Entalpia de Formação Variação de entalpia envolvida na formação de um mol de substância a partir de substâncias simples no estado padrão C(grafite) + 2H2(g) → CH4(g) ∆H = -74,8 kJ/mol EQUAÇÕES DE ENTALPIA DE FORMAÇÃO C3H8(g) 3C(grafite) + 4H2(g) → C3H8(g) C6H6(l) 6C(grafite) + 3H2(g) → C6H6(g) C2H6O(l) 2C(grafite) + 3H2(g) + 1/2O2(g) → C2H6O(l) Exercício de Entalpia de Formação
Baixar