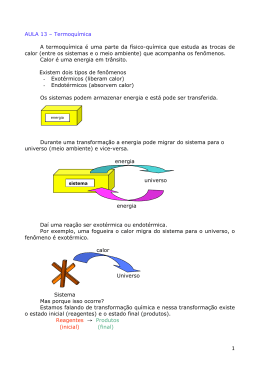
PROFESSORA – STE: MARIA GISLENE PERÍODO: MATUTINO DATA:10/07/09 PROFESSORA REGENTE: MARILENE DISCIPLINA: QUÍMICA SÉRIE/TURMA: 2º ALUNO (A): A madeira ao queimar LIBERA As transformações sofridas pela energia na forma de matéria são, quase CALOR sempre, acompanhadas por absorção ou liberação de energia O alimento para cozinhar ABSORVE energia na forma de CALOR Esta energia é estudada por um seguimento da química denominado de Absorvem calor do Liberam calor para o meio ambiente meio ambiente 01) Considere as seguintes transformações que ocorrem em uma vela acesa: I. Solidificação da parafina que escorre da vela. II. Queima da parafina. EXOTÉRMICA EXOTÉRMICA ENDOTÉRMICA III. Vaporização da parafina. Dessas transformações, APENAS: a) I é endotérmica. b) II é endotérmica. c) III é endotérmica. d) I e II são endotérmicas. e) II e III são endotérmicas. sublimação fusão vaporização LÍQUIDO SÓLIDO solidificação GASOSO condensação ressublimação 02) Ao se dissolver uma determinada quantidade de cloreto de amônio em água a 25°C, obteve-se uma solução cuja temperatura foi de 15°C. A transformação descrita caracteriza um processo do tipo: a) atérmico. b) adiabático. c) isotérmico. d) exotérmico. e) endotérmico. Toda espécie química possui uma energia, que quando medida à pressão constante, é chamada de ENTALPIA (H) Não é possível calcular a entalpia de um sistema, e sim a sua variação ( H =H final –H H ) inicial H =H final –H inicial ENTALPIA (H) HR HP REAGENTES PRODUTOS Caminho da reação H<0 H =H final –H inicial ENTALPIA (H) PRODUTOS HP H>0 HR REAGENTES Caminho da reação 01) Considere o gráfico a seguir: Kcal C + D 40 25 H = 15 H 40 Pkcal HR – 25 A + B Caminho da reação São feitas as afirmações: I. A entalpia dos produtos é de 40 kcal II. A reação absorve 15 kcal III. A reação direta é exotérmica IV. A variação de entalpia é de 15 kcal É correto afirmar que: a) Apenas I é verdadeira. b) Apenas I e II são verdadeiras. c) Apenas I, II e IV são verdadeiras. d) Apenas I, II e III são verdadeiras. e) Apenas III é verdadeira. VERDADEIRA VERDADEIRA FALSA VERDADEIRA O calor pode ser representado como parte integrante da reação ou na forma de variação de entalpia 2 NH3(g) + 92,2 KJ 2 NH3(g) N2(g) + 3 H2(g) N2(g) + 3 H2(g) N2(g) + 3 H2(g) N2(g) + 3 H2(g) H = + 92,2 KJ 2 NH3(g) + 92,2 KJ 2 NH3(g) H = – 92,2 KJ 01) A variação de energia térmica de uma reação, quando reagentes e produtos são comparados sob mesma pressão, recebe o nome de: a) entalpia. b) entropia. c) energia livre. d) energia de ativação. e) calor específico. 02) Reação exotérmica é aquela na qual: V 1 - há liberação de calor. V 2 - há diminuição de energia. Pág. 28 Ex. 03 V 3 – a entalpia dos reagentes é maior que a dos produtos. V 4 - a variação de entalpia é negativa. Estão corretos os seguintes complementos: a) somente 1. b) somente 2 e 4. c) somente 1 e 3. d) somente 1 e 4. e) 1, 2, 3 e 4. 03) Considere o seguinte gráfico: Pág. 28 Ex. 04 Entalpia (H) A (g) + B (g) 2 AB (g) H caminho da reação De acordo com o gráfico acima, indique a opção que completa, respectivamente, as lacunas da frase abaixo. NEGATIVA a reação é ....................... EXOTÉRMICA "A variação da entalpia é ...................; LIBERANDO calor” porque se processa ...................... a) positiva, exotérmica, liberando. b) positiva, endotérmica, absorvendo. c) negativa, endotérmica, absorvendo. d) negativa, exotérmica, liberando. e) negativa, exotérmica, absorvendo. Exercícios de Termoquímica http://www.profjoaoneto.com/fisicoq/termoquimica/te rmoquimica_ex1.htm
Baixar