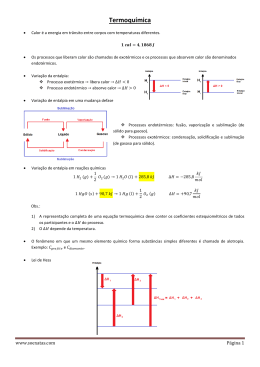
TERMOQUÍMICA – CAP 5 ENERGIA POTENCIAL ELETROSTÁTICA: K= 8,99 . 10⁹ Jm/C² Energia química: Energia potencial acumulada nos arranjos dos átomos das substâncias. Energia térmica: Energia cinética das moléculas da substâncias. e= 1,60 . 10⁻¹⁹ C SI: Joule (J) 1 J = 1Kgm²/s² Ec= ⅟2 (2 Kg)(1m/s)² 1Kgm²/s² = 1J •1cal = 4,184 J (exatos) 1 cal é a energia gasta para elevar a temperatura de 1g de água de 14,5 ºC para 15,5 ºC James Joule(1818-1889) • Sistema • Fronteira • Vizinhança ou meio ambiente ENERGIA Movimento(Contra uma força) TRABALHO Mudança de temperatura CALOR Energia transferida de um corpo mais quente para um corpo mais frio. Se definirmos o objeto como sistema – nós – (como parte do sistema) - estamos realizando trabalho naquele sistema, transferindo energia para ele. CALOR MOLÉCULAS COMBUSTÃO ENERGIA TRABALHO MOVIMENTO Um corpo de 5,4 kg é levantado por uma pessoa até uma altura de 1,6 m do chão. Em seguida essa pessoa joga o corpo de volta no chão. Sabendo que no momento da queda do corpo toda energia potencial adquirida pelo corpo é transformada em energia cinética e que a pessoa realizou um trabalho W para elevar o corpo . Qual a velocidade do corpo no momento do impacto com o chão? (Adotar g=9,8m/s²) RESOLUÇÃO W = Fd = mgh = (5,4)(9,8)(1,6) = 85 J No instante do impacto a energia é totalmente convertida em energia cinética. Ec=⅟2mv² =85 j = ⅟2(5,4)v² v² =(85)(2)/(5,4) v = 5,6 m/s² Conservação da energia Energia de um sistema: Energia interna ΔE(J)= q + W q > 0 sistema recebe calor... q < 0 sistema doa calor... W > 0 trabalho realizado sobre o sistema W < 0 sistema realiza trabalho Processos: •Endotérmicos: Sistema absorve calor •Exotérmicos: Sistema libera calor q1 + W1 = q 2 + W2 = q3 +W3 REAÇÕES EXOTÉRMICAS A + B = C + D + calor Hr > Hp, portanto ΔH>0 REAÇÕES ENDOTÉRMICAS A + B + calor = C + D Hp > Hr, portanto ΔH<0 mais estabilidade = menos energia = menor ΔH = reação mais espontânea 1. TEMPERATURA 2. PRESSÃO 3. QUANTIDADE DE REAGENTES E PRODUTOS 4. FASE DE AGREGAÇÃO energia da fase sólida < energia da fase líquida < energia da fase gasosa 5. VARIEDADE ALOTRÓPICA 6. PRESENÇA DE SOLVENTE Os diferentes calores de reação •Entalpia-padrão de combustão •ENTALPIA-PADRÃO DE NEUTRALIZAÇÃO •ENTALPIA PADRÃO DE DISSOLUÇÃO •ENTALPIA-PADRÃO DE FORMAÇÃO •MEDIÇÃO DO FLUXO DE CALOR •CAPACIDADE CALORÍFICA •CALOR ESPECÍFICO Q=mcΔT CALORÍMETRO = reação sob pressão constante Q= quantidade de calor M= massa c= calor específico ΔT= variação da temperatura qsolução = - qreação • Capacidade calorífica: é a quantidade de calor necessária para que um corpo aumente sua temperatura em 1 K (1ºC). • Capacidade calorífica molar: é a capacidade calorífica de 1 mol de substância (pura). qreação=m(solução)c(solução)ΔT BOMBA CALORIMETRICA Calorimetria sob volume constante 1g de C7H6O2 Produz 26,38 kj 1g de C7H6O2 combustão ΔTcal = 4,857 ºC Ccal= 26,38 kJ 4,857 ºC qr = -Ccal x ΔT Capacidade calorífica do calorímetro Variação da temperatura Calor de reação (liberado) ·Lei de Hess “A variação de entalpia envolvida numa reação química, sob determinadas condições experimentais, depende exclusivamente da entalpia inicial dos reagentes e da entalpia final dos produtos, seja a reação executada em uma única etapa ou em várias etapas sucessivas.” Lembre-se de que, ao multiplicar ou dividir os coeficientes de uma reação termoquímica por um número qualquer, deve-se multiplicar ou dividir o valor de D H desta reação pelo mesmo número. Devemos lembrar que, ao inverter uma reação termoquímica, deve-se inverter o sinal do D H, pois, se num determinado sentido a reação libera calor, para voltar, em sentido contrário, a reação terá que absorver a mesma quantidade de calor que havia liberado, e vice-versa. 2 C(grafita) + 1 O2(g) -> 2 CO(g) ΔH = ? Podemos medir no calorímetro, porém, o ΔH das seguintes reações: I.) 1 C(grafita) + 1 O2(g) -> 1 CO2(g) ΔH = - 94,1 Kcal II.) 2 CO(g) + 1 O2 (g) -> 2 CO2 (g) ΔH = - 135,4 Kcal Resultado: 2 C(grafita) + 1 O2 (g) -> 2 CO(g) ΔH = - 52,8 Kcal C6H12O6 (glicose) + 6O2(g) 6CO2(g) + 6H2O(l) + 2.803kj
Baixar