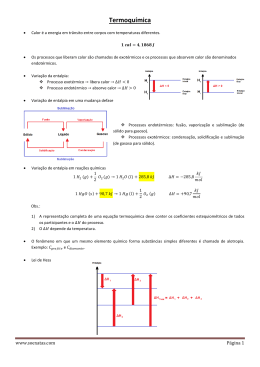
Cap. 5 - Termoquímica Professor: Élcio Rogério Barrak Alunos: Bruno Fadel Condino Ronan Tetsuo Fukumoto 16996 17026 Termodinâmica • Início: Revolução Industrial • Objetivo: Maximizar o desempenho de motores a vapor Energia m v2 • Energia Cinética: E 2 • Energia Potencial: E = mgh • Energia Eletrostática: E kQ1Q2 d • Unidade S.I.: J (joule) Usual: cal (caloria) Transferência de Energia • Trabalho: w = F x d • Calor Primeira Lei da Termodinâmica “A energia não pode ser criada e nem destruída” Energia interna: A soma de toda a energia do sistema ΔE = Efinal – Einicial E = q + ω Funções de Estado Propriedade do sistema determinada pela especificação de sua condição ou seu estado (em termos de temperatura, pressão, localização, etc.) Entalpia (H) É o fluxo de calor nas mudanças químicas que ocorrem à pressão constante quando nenhuma forma de trabalho é realizada a não ser trabalho PV H = E + PV Entalpia de Reação ΔH = H (produtos) – H (reagentes) • ΔH > 0 Endotérmico • ΔH < 0 Exotérmico • Propriedade extensiva 2 H2(g) + O2(g) 2 H2O(g) ΔH = - 483,6kJ 4 H2(g) + 2 O2(g) 4 H2O(g) ΔH = - 967,2kJ Entalpia de Reação • A variação de entalpia para uma reação é igual em valores absolutos, mas oposta em sinais para o ΔH da reação inversa. CO2(g) + 2 H2O(l) CH4(g) + 2 O2(g) ΔH = 890kJ Entalpia de Reação • A variação de entalpia para uma reação depende do estado dos reagentes e dos produtos 2 H2O(l) 2 H2O(g) ΔH = + 88kJ Calorimetria • Medição do fluxo de calor • Calorímetro • Capacidade Calorífica • Calor Específico q c m T Calorímetros Lei de Hess • Estabelece que se uma reação for executada em uma série de etapas, o H para a reação será igual à soma das variações de entalpia para as etapas indivduais. Entalpias de formação É a variação de entalpia para a formação de 1 mol de um composto, a partir de seus elementos em sua forma alotrópica mais estável Alimentos • Carboidratos e Gorduras • Temperatura, contração muscular e reparação de tecidos Alimentos Fontes de energia • Hidrocarbonetos Energias Renováveis Energias não-renováveis •Syngas Carro Híbrido Referências Bibliográficas • Química a ciência central, 9a edição – Brown, LeMay e Bursten • Imagens: http://www.pontoxp.com/wp-content/uploads/2007/09/volvo-recharge.jpg http://www.ulbra.br/mineralogia/imagens/carvao_mineral.gif http://2.bp.blogspot.com/_EqiXntjJ4hQ/SNCunEGvvOI/AAAAAAAAAnM/qDoNpUs2FN k/s400/PlataformaPetroleo02.jpg http://www.cepa.if.usp.br/energia/energia1999/Grupo4B/Eneralte/figuras/figeol2.JPG http://www.construible.es/images/news/061120_gea_seguidores-2.jpg http://bafanaciencia.blog.br/wp-content/itaipu.jpg
Baixar