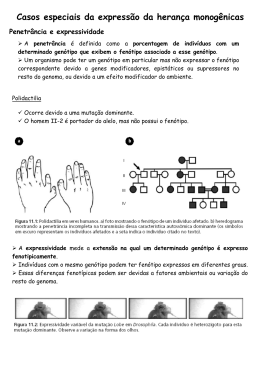
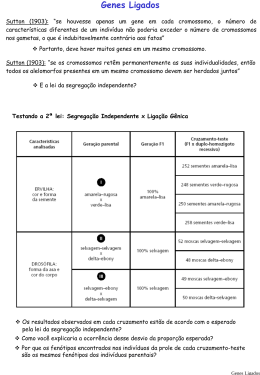
Cromossomos Sexuais - X e Y Determinação e Diferenciação Sexual Genética II Profa. Dra. Ana Elizabete Silva Cromossomo X Ross et al. (Nature, 2005) Estrutura funcional: • 5% genoma nuclear (160 Mb), • SUBMETACÊNTRICO • 99,3% da sequência eucromática do X •1098 genes codificantes 699 genes conhecidos • baixa densidade gênica: 7,1genes/Mb • genes funcionais em ambos os sexos. ESTRUTURA FUNCIONAL DO CROMOSSOMO X CROMOSSOMO X: dividido em regiões funcionais → refletindo fenômenos de inativação-ativação. a-SEGMENTO TERMINAL Xp: região pseudoautossômica (PAR) -permanece sempre ativa -duplica-se sincronicamente nos crs. X e Y b-REGIÃO Xcen-p11: -permanece sempre ativa -duplicação precoce c-REGIÃO Xcen-q13: -presente sempre no X normal (XIC) -localização do gene XIST → sempre ativo apenas no X inativo Evolução dos cromossomos sexuais Ohno (1967): cromossomos sexuais de mamíferos evoluiram de um par de autossomos (300 milhões anos) •Isolamento da região determinante do sexo no Y •barreira para recombinação entre X e Y: divergência acúmulo de mutações no Y e degeneração deleções XCR: região conservada do X (descendente do autossomo) •XAR: região adicional do X (adição de outro autossomo) Consequência da Falta de Recombinação X-Y • Aquisição de genes específicos a masculinidade → envolvidos apenas na espermatogênese • Perda gradual de genes homólogos ligados ao X • Redução do Y → remoção de sequências redundantes • Mecanismo de conversão gênica → compensar a falta de recombinação X-Y • Infertilidade masculina → deleção esporádica ocasional de genes essênciais envolvidos na espermatogênese Anomalias estruturais do cromossomo X Deleções Região Xcen-q13 Isocromossomos Isodicêntricos Isocromossomos Xp Região Crítica ausente. Telocêntricos Xp Centro de Inativação do X (Xic), sem a Região Crítica qual o cromossomo não pode formar o corpúsculo de Barr e permanece ativo. Inativação do X Fêmeas (46,XX) 2 cópias de cada gene ligado ao X Machos (46,XY) apenas 1 cópia desvantagem? Hipótese Lyon (1960) 1 cromossomo X em cada célula somática da mulher é inativado Compensação de Dose - estágio de blastocisto - contagem dos cromossomos X células 46,XY e 45,X nenhum X inativado. - células 46,XX e 47,XXY 1 X inativado. Corpúsculo de Barr ou Cromatina Sexual Cromossomo X inativo no núcleo interfásico. Cromatina Sexual - corpúsculo de Barr - machos hemizigotos e fêmeas funcional/e hemizigotas. - escolha é ALEATÓRIA (exceto células das membranas extraembrionárias) é FIXADA. Desvio da Inativação: Manifestação clínica variável em mulheres heterozigotas para doenças ligadas ao X desde absolutamente normal até totalmente afetada Fêmea adulta: mosaico de clones derivados de diferentes células embrionárias. Machos e fêmeas homozigotas → pelagem preta ou laranja Fêmeas heterozigotas → pelagem malhada Mecanismos de inativação do X - XIC (centro de inativação do X) em Xq13 locus controla a iniciação e a propagação (contagem e escolha) evento epigenético silenciamento transcricional de um dos cromossomos X em células somáticas - X sem o XIC não são inativados - XIST (Xist) X-Inactivation-Specific Transcript RNA de 17 kb codificado pelo X inativo atua sobre o cromossomo X inativado. - X anormal com dois XIC corpúsculo de Barr bipartido. - t(X;aut) contendo XIC espalhamento parcial da inativação do X. t(X,aut) contendo XIC: mostra espalhamento parcial de inativação do X no segmento autossômico STRACHAM, 2002 A INATIVAÇÃO DO X REQUER ALGUMAS ETAPAS: 1. Iniciação: locus XIST sobre cada cromossomo X é expressado, de modo que a transcrição é interrompida em um dos crs. X, mas é mantida no outro X inativado (cromatina sexual). Regulação de XIST no X ativo regulado em cis por um gene antisense Tsix bloqueia o acúmulo e espalhamento de XIST no Xa Hipermetilação do DNA do Xi nas ilhas CpG (silenciamento) Metilação Genes housekeeping (constitutivos): regiões 5´ promotoras dinucleotídeos C-G Ilhas CpG. Metilação extensa (enzima: DNA-metiltransferase) inativa a transcrição. 2. Espalhamento bidirecional passagem de alguns sinais a longa distância de uma maneira cis, sem afetar o outro cromossomo. 3. Manutenção da inativação -modificações na conformação da cromatina. -hipoacetilação e metilação de histonas do nucleossomo do Xi: heterocromatina (cromatina compactada transcricionalmente inativa) replicação tardia a) antes da inativação: XIST é expresso em uma forma instável, fatores bloqueadores impedem a sua regulação (gene antisense Tsix) b) RNA XIST se estabiliza, há regulação transcricional ou ocorre liberação dos fatores b bloqueadores. c) espalhamento RNA XIST sobre o X antes da sua inativação. c d) modificações da cromatina: hipoacetilação e metilação das histonas, metilação dos promotores dos genes ligados ao X X inativo. d e) silenciamento transcricional dos genes devido ao espalhamento do RNA XIST e Obs.: no futuro Xa persistência de Tsix prevenindo a formação da cobertura de XIST sobre o Xa MECANISMOS DE ESTABELECIMENTO E MANUTENÇÃO DO ESTADO INATIVO A- Xist associa-se c/ X em cis → recruta complexos proteínas para silenciamento inicial (hipoacetilação de histonas) → reversível B- Xist recruta outros complexos de proteínas (metilação de histonas) → manutenção do estado inativo → reversível C- Recrutamento de fatores p/ manutenção das modificações das histonas e induzir outras mudanças epigenéticas (metilação região promotora do DNA) → ESTADO INATIVO IRREVERSÍVEL REATIVAÇÃO DO CROMOSSOMO X - Cromossomo X inativo é reativado nos ovócitos pouco antes da meiose. Genes que escapam da inativação: principalmente em Xp (PAR) MIC2 STS ZFX STS - enzima esteróide sulfatase (ictiose). MIC 2 A1S9T ZFX RPS4X A1S9T RPS4X Primeiro foram submetidos ao processo de inativação e posteriormente sofreram reativação VARIABILIDADE NA EXPRESSÃO DE GENES DO CROMOSSOMO X • Mulheres expressam diferentes genes do Xi: heterogeneidade do nível de expressão entre as mulheres • Explicação para algumas diferenças comportamental e biológica entre mulheres e entre homens e mulheres • Carrel & Willard (2005): estudo de 95% de genes do X em fibroblastos de 40 mulheres: 75% genes: submetidos a inativação 15% genes (94) do Xi escapam da inativação (todas mulheres): diferindo nas regiões do X 10% genes: padrão variável de inativação entre as mulheres e expressados diferentemente em alguns Xi Distribuição não casual de genes que escapam da inativação ao longo do cromossomo X: principalmente Xp distal → aneuploidias de Xp mais severa que Xq Doenças ligadas ao X: reconhecidas pelo padrão de herança Associado com grande número de doenças: 10% das doenças mendelianas www.nature.com/news/2005 Cromossomo Y • acrocêntrico (70 Mb) •Gene ancestral Sox3 heterocromatina constitutiva (maior parte) • DNA não codificador, alta e moderada/e repetitivo → conversão gênica → recombinação com o próprio Y • pobre em genes (~251 genes) • maioria dos genes controlam a função sexual. • desaparecimento em 5-10 milhões de anos??? ESTRUTURA DO CROMOSSOMO Y 1- Região pseudo-autossômica maior (PAR1) mantém-se ativa no X inativo. - extremidade dos braços curtos do X e do Y - homologia de 2,7 Mb; - contém cerca de 12 genes não submetidos a inativação -frequência alta de recombinação na meiose masculina -sítio de crossing-over obrigatório Deleções dos fatores de azoospermia(Yq11): AZFa, AZFb e AZFc: infertilidade 2- Região pseudo-autossômica menor (PAR2): - 330 kb na extremidade dos braços longos do X e do Y (recombinação não obrigatória) - Alguns genes submetidos a inativação •Região eucromática do X: 6 x maior que do Y •Outras regiões de homologia Xp21.3 e Yq proximal região Yp-Xq região Yq-Xq Regiões homólogas de X e Y. Cromossomo Y determinação sexual em humanos - Eventos que evidenciam que o Y é responsável pela determinação do sexo masculino: a- indivíduos 45,X mulheres b- indivíduos 47,XXY homens Y garante o fenótipo masculino, independente/e do número de crs. X. c- indivíduos 46,X,iso(Yq) ou del(Yp) mulheres com fenótipo de S. Turner. Yp fatores determinantes do sexo masculino 3- Região Yp - TDF (próximo à PAR1) - ZFY proteína zinc-finger - SRY região do Y determinante do sexo outros genes do Y - Yp - fator STS (esteróide sulfatase) - fator Xg -Yq - gene para o tamanho da coroa dentária, gene da estatura - AZF previne a azoospermia ANTIGOS CANDIDATOS A TDF - FATOR DETERMINANTE DO TESTÍCULO Pesquisa sobre TDF no Y humano a- gene ZFY proteína zinc-fingers atua como fator de transcrição (TF). homens XX, porém negativos para ZFY excluiu-o como candidato. ZFY: homologia em Xp com ZFX escapa da inativação nas fêmeas. b- gene SRY novo candidato a TDF diferentes análises genéticas: - gene determinante do sexo - presente e conservado em diferentes organismos SRY - proteína sry: apenas em testículos fator de transcrição regula expressão de outros genes SRY Mapa do cromossomo Y Factor Determining Testis - TDF Estudos em camundongos transgênicos transferência do SRY clonado para um oócito fertilizado XX macho XX 33.17 33.13 33.17 XY-m 33.09 XX-F 33.13 XX- m SRY controle ZFY Animais transgênicos para o gene SRY: 33.17 macho XY e 33.13 macho XX Estudos em Homens 46,XX – Sexo Reverso mutações em SRY - cariótipo 46,XY - fenótipo feminino avaliação cromossômica em homens 46,XX X com o gene SRY crossing defeituoso. cromossomo Crossing durante a meiose • Região pseudoautossômica • Região crossing raro Avaliação cromossômica em homens 46,XX SRY: DETERMINAÇÃO DO SEXO MASCULINO SEXO REVERSO HOMENS XX: possuem antígeno H-Y positivo; Fenotipicamente homens; apresentam o gene SRY; são estéreis; aspecto fenotípico da S. Klinefelter, mas com estatura mais baixa; maioria dos casos parte de Yp foi permutado em Xp MULHERES XY: ausência de SRY no cromossomo Y; mecanismo genético: recombinação desigual durante a espermatogênese, entre os cromossomos X e Y;. FREQUÊNCIA= 1:20.000 DETERMINAÇÃO E DIFERENCIAÇÃO SEXUAL • Determinação Sexual: • relacionada com o desenvolvimento das gônadas (testículo ou ovário) • processo que inicia-se com a gametogênese dos progenitores até a diferenciação gonadal específica de cada sexo • Diferenciação Sexual: • Resulta no desenvolvimento das genitálias até o desenvolvimento das características sexuais secundárias É MENINO OU MENINA? 1 em 3000 crianças nasce com intersexo CLASSIFICAÇÃO DOS NÍVEIS SEXUAIS • Sexo genético: 46,XX ou 46,XY • Sexo gonadal: testículos e ovários • Sexo genital interno: -ovário: trompas de Falópio, útero e metade ou 2/3 superiores da vagina -testículos: epidídimo, vasos deferentes, vesículas seminais e ducto ejaculatório • Sexo genital externo: -ovário: permanecem sem indução (fêmeas) -testículos: próstata, pênis e uretra peniana, escroto e testículos • Sexo psicológico e social: identidade e desempenho pessoal • Caracteres sexuais secundários e alterações pubertárias: -mulheres: pêlos axilares e púbicos, seios, menstruação, etc -homens: pêlos axilares e púbicos, barba, alteração da voz, etc DETERMINAÇÃO E DIFERENCIAÇÃO SEXUAL •Embrião (6a. - 7a. Semana): gônadas bissexuais •Genes reguladores:a partir da 7a. s -SRY (Yp) -WT1 (11p13) Tumor de Wilms -SOX9 (17q) -DSS (Xp21) diferenciação ovariana -DAX-1 (X) hipoplasia adrenal congênita Diferenciação sexual: completa ~1214 semanas GENES ENVOLVIDOS NA DETERMINAÇÃO SEXUAL SRY: não é o único responsável pela determinação sexual Fetos XY SRY+ → desenvolvido como fêmea -SOX9 (17q24): expressado cedo no desenvolvimento fetal → (duas cópias) essencial p/ desenvolvimento dos testículos e outros órgãos reprodutores masculinos. Fêmeas camundongos transgênicas (cópia adicional Sox9 →sexo reverso fêmea → macho) -SOX3 (Xq26-q27): pode reprimir ou interferir com o promotor de testículo SOX9 -DMRT1 (9p24.3): duas cópias → desenvolvimento dos testículos → deleção leva → sexo reverso (homem → fêmea XY) -DAX1 (Xp21.3): gene anti-testículo (efeito feminilizante)→ cópia adicional (duplicação Xp) → sexo reverso (homem → fêmea XY) -WT1 (11p13) e SF1 (9q34): diferenciação da crista urogenital •Células de Leydig(8a. s.: testosterona) Ductos de Wolff (condutos deferentes, epidídimo, vesícula seminal e próstata) •Células de Sertoli (7-9a.sem:HAM) regressão dos Ductos de Muller trompas, útero, porção superior da vagina CLASSIFICAÇÃO DAS ANORMALIDADES DA DIFERENCIAÇÃO SEXUAL 1-Disgenesia gonadal (erros no sexo gonadal) • S. Turner e S. Klinefelter • Disgenesia gonadal pura (S. Swyer) • Disgenesia gonadal mista • Hermafroditismo verdadeiro • Sexo reverso ou homem XX HERMAFRODITISMO • Presença de tecido ovariano e testicular, genitália ambígua • maioria dos casos: ovotestis (uni ou bilateral) • cariótipo típico: 46,XX (SRY-) • pequena porcentagem: quimeras (células XX e XY de diferentes zigotos) • 2/3 casos: genitália externa masculina • rara presença de espermatozóides • Presença de útero e menstruação HERMAFRODITISMO • Características: • frequentemente presença de útero • condutos genitais conforme gônadas presentes • genitália externa ambígua ou masculinizada, hipospadia, criptorquidia • hérnia inguinal (ovotestis ou testículo) • ginecomastia na puberdade • menstruação em alguns casos • caracteres sexuais secundários femininos incompletos CLASSIFICAÇÃO DAS ANORMALIDADES DA DIFERENCIAÇÃO SEXUAL 2- Pseudo-hermafroditismo feminino • Hiperplasia congênita da adrenal (AR) -deficiência da 21-hidroxilase -deficiência da 21-hidroxilase com perda de sal 3- Pseudo-hermafroditismo masculino • Deficiência de produção de testosterona • Defeito do metabolismo dos andrógenos Ex. S. de insensibilidade completa aos andrógenos (S. feminização testicular) PSEUDO-HERMAFRODITISMO FEMININO • • • • Incidência: 1:5000 nascimentos Gônadas: ovários cariótipo feminino: 46,XX genitália interna feminina: ovários, útero e trompas de Falópio • genitália externa masculinizada em grau variável (ou ambígua) virilização da genitália na vida fetal • Ex. Hiperplasia congênita da adrenal (AR) -biossíntese do cortisol: superprodução de esteróides com atividade androgênica (deficiência da 21--hidroxilase) PSEUDO-HERMAFRODITISMO MASCULINO • • • • • • • • Incidência: 1:65.000 sexo masculino Gônadas: testículos (testosterona normal) cariótipo masculino: 46,XY fenotipicamente mulheres (mamas, amenorréia primária, ausência dos derivados de Müller) anomalias das gônadas e condutos genitais genitália externa alterada: feminilizada ou ambígua (vagina em fundo cego) Ex. S. da insensibilidade androgênica completa (S. de feminização testicular) herança recessiva ligada ao X: ausência ou defeito da função de receptores andrôgenicos nos órgãos alvo
Baixar