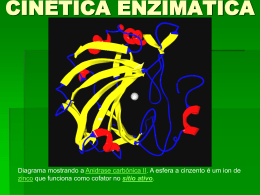
Cinética Enzimática corresponde a análise quantitativa do efeito de cada um dos fatores que influenciam na expressão da atividade enzimática , avaliando [E], [S], [P], inibidores e ativadores, T , pH e imobilização (heterogênea) V proporcional a [E] na zona linear relação P versus tempo Cinética Enzimática é estudada para: • Determinar as constantes de afinidade do S e dos inibidores (Km e Ki); • Conhecer as condições ótimas da catálise (T, pH, [S] etc); • Ajudar a elucidar os mecanismos de reação (estudo ordem reação e tipo cinética); • Determinar a função de uma determinada enzima em uma rota metabólica (para um dado S). 1 Centro ativo complementar em tamanho, forma e natureza química à molécula do substrato, ou seja, uma cavidade geometricamente rígida. Emil Fischer (1894): alto grau de especificidade das enzimas originou Chave- Fechadura , que considera que a enzima possui sitio ativo complementar ao substrato. 2 Substrato induz mudanças conformacionais na enzima - resultam em um alinhamento preciso dos grupos catalíticos e suas ligações com o substrato Substratos análogos podem se ligar a enzima não induzem apropriadamente o alinhamento dos grupos catalíticos. 3 Conceitos para diminuição da energia de ativação orbital steering - alinhamento ótimo dos orbitais do substrato e dos grupos catalíticos stereopopulation control - restrição da liberdade rotacional do substrato (“congelamento”) rack - ligações formadas entre o substrato e a enzima são tão fortes que levam a uma alteração na molécula de substrato 4 Mecanismo rack (distorção do substrato) A molécula de substrato sofre alteração para se acomodar na molécula enzimática estática 5 Seqüência de ligação do substrato em duas etapas O substrato pode sofrer estas alterações por mudanças conformacionais na enzima 6 Envolve a obtenção de uma expressão matemática : • Em fase homogênea (enzimas em solução) • Em fase heterogênea (enzimas imobilizadas) Os aspectos gerais envolvidos: - O substrato Sforma com E , o complexo intermediário ES. - A velocidade reação esta representada pela tangente da curva P ou Sversus tempo e é constante para concentrações dadas de S e E, pois diminuí em função do tempo como consequência da diminuição de S. - Para dada [S] , a curva v=f[E] mostra trajetória hiperbólica. 7 Velocidade de reaç ão: “diminuiç ão na concentraç ão de um dos reagentes ou formaç ão de produto na unidade de tempo” Concentraç ões são geralmente dadas em mol.L-1 e o tempo em minutos velocidade = - d[a]/dt Se a concentraç ão inicial do reagente for a e se a concentraç ão de produto for x, a x, então a equaç ão acima també m pode ser escrita como: velocidade = - d[a]/dt diminuição da concentração dos reagentes velocidade = d[x]/dt aumento da concentração dos produtos. 8 Michaelis-Menten equilíbrio rápido 1913 Leonor Michaelis - Enzimologista Maud Menten - Pediatra Hipóteses de Henri -(1903): E + S ES 1. velocidade inicial de uma reação enzimática é proporcional a concentração da enzima 2. dependência da velocidade de reação com a concentração de substrato é característica de um fenômeno de saturação (reação química reversível) K1 E+S K-1 Etapa rápida ES Kp E+P Etapa lenta 9 E S K1 K 1 ES K2 K 2 EP K3 E P K 3 Modelo da Reaç ão Enzimática v = K2 [ES] d[ES] = 0 (teoria estado estacionário – ES constante em tempo curto) dt d[ES] = K1 [E] [S] - K-1 [ES] - K2 [ES] dt Como: [ES]= [E] [S] Km Km = K-1 + K1 K2 [E] = [ES] - [E]t Etapa limitante da reação é o desdobramento de ES em E+P , (K2<<K1) – após atingir rapidamente o equilíbrio o [ES] começa a ditar a velocidade 10 Curvas cinéticas para os componentes da reação enzimática – Briggs-Haldane estado estacionário 1-Admite a formação de dois complexos de transição ES e EP 2- [ES] permanece constante ([ES] produzido é consumido) 3- Enzima em quantidades catalíticas [E]t << [S]t e [S] [S]t E S K1 K ES 1 v = K2 [E]t [S]t Km + [S]t K2 K K3 EP 2 K E P 3 Equação de velocidade pela Teoria do Estado Estacionário 11 Modelo da Reaç ão Enzimátic a (Mic hae liano) dP/dt= v = K2 [ES] v = K2 [ES] [Et] [Et] divido por [Et] como [ES] = [E] [S] Km v = = K2 [E] [S] [Et] __Km______ [E] [S] + [E] Km e [Et] = [ES] + [E] divido por [E] v = = K2 [S] [Et] __Km__ multiplico por Km [S] + 1 Km V= K2 [Et] [S] Km + [S] V= Vmax [S Km + [S] 12 v = K2 [ E] t [ S] t Km + [ S] t Equação de velocidade Onde: Km - constante de Michaelis-Menten Como: Km= K2 + K-1 K1 Vm = K2 [ E] t v = Vm [ S] t Km + [ S] t Equação de Michaelis-Menten Cinética estudada em termos da velocidade inicial onde K-2 desprezado já que no início [ P] = 0 13 cinética de ordem zero hipérbole v vo Vmax [S] K M [ S] cinética de primeira ordem 14 Enzimas – ordem da reação v= Vmax [S] Km + [S] v = V max [ S] Km 1 v Quando a formação de P for proporcional à [S] a velocidade da reação é de 1a ORDEM 1- [S] v = V max 2 V max 2 3 Km Km>>[S] Quando a velocidade da reação independe da [S] a reação é de ORDEM ZERO 2- [S] [S]>>Km v = Vmax [ S] 15 Km depende: - aspectos específicos do mecanismo de reação; -n° de passos da reação; -velocidades relativas dos passos individuais. ENZIMA SUBSTRATO Km (mM) Catalase H2O2 25 Hexoquinase ATP 0,4 D - Glicose 0,05 D - Frutose 1,5 Quimotripsina Gliciltirosinilglicina N - benzoiltirosinamida 108 2,5 Se em um experimento usarmos [S] = Ks o máximo que poderemos alcançar para v é um valor de v= Vmáx/2, sendo este independente da concentração da enzima. 16 Determinação Experimental dos Parâmetros Cinéticos Representação hiperbólica de assintotas: S = -KM v = VMAX 17 1/v Método dos inversos de LineweaverBurke KM / VMAX 1/VMAX -1/KM Método 1/[S] Eixo y Eixo x Lineweaver-Burke 1/v 1/S 1/VMAX -1/KM KS/VMAX Hanes S/v S KM/VMAX -KM 1/VMAX v v/S VMAX VMAX/KM -KM 1/t ln(Si/S) (Si-S)/t VMAX/KM VMAX -1/KM Eadie-Hofstee Integrado Intercessão Intercessão eixo y eixo x Tangente 18 métodos integrados são importantes para determinar mecanismos de inibição ENZIMAS – MÉTODOS GRÁFICOS Pe rm ite m obte r os parâm e tros c iné ticos (Km e Vmax) Gráfico dos Recíprocos de Line we ave r-Burk 1 Km 1 v Vm a x [ S] Vm a x 1 v Km V max Inclinação = 1 V max -1 Km 1 [ S] 19 Gráfico da equação integrada de Michaelis-Menten [ S] o 2 ,3 log t [ S] Vmax Km 1 ( [ S] o [ S] ) Km t V max Km 2 ,3 log[ S] o t [ S] Inclinação = - 1 / Km V max ( [ S] o - [ S] ) t 20 Gráfico de Hane s -Woolf [S] v K m V max 1 V max [S] [ S] v Inclinação = 1 V max Km V max - Km [ S] 21 21 Gráfico de Eadie-Hofstee v v K m [ S] V m ax V max v Inclinação = -K m V max Km v [ S] 22 Inibição Enzimática Qualquer substância que reduz a velocidade de uma reação enzimática. Reguladores – ativadores – aceleram v I nibidores – reduzem reversivelmente v I nativadores – reduzem irreversivelmente v INIBIDORES REVERSÍVEIS COM PETI TI VOS IRREVERSÍVEIS N ÃO COM PETI TI VOS I N COM PETI TI VOS 23 Modelos de Inibição Competitiva 1. Modelo clássico, S e I competem pelo mesmo sítio de ligação 2. I e S são mutuamente excludentes por causa de impedimento estéreo 3. I e S possuem um sítio comum de ligação 4. Os sítios de ligação para I e S são distintos, mas se sobrepõem 5. A ligação de I em um sítio inibidor distinto causa uma mudança conformacional na enzima que não permite a ligação do substrato (viceversa) 24 kS E + S + I kP ES E + P ki EI v Vmax [S ] [I] kS 1 ki [S ] Afeta a afinidade da enzima pelo seu substrato (KS), sem afetar a reatividade do complexo ativo enzimasubstrato (Vmax) minimizada em elevadas [S] 25 Plot de v versus [S] na presença e na ausência de uma concentração fixa do inibidor competitivo 26 Modelos de Inibição Não-Competitiva 1. S e I não são mutuamente excludentes, mas ESI é cataliticamente inativo (não competitiva) 27 2. I não pode se ligar ao complexo ES já formado, mas também forma complexos terciários enzima-inibidor-substrato cataliticamente inativos 28 3. I e S são mutuamente excludentes por causa de impedimento estéreo 29 kS E + S + I kP ES + I ki E + P ki kS EI + S v Vmax [I] 1 ki ESI [S ] k S [S ] Afeta a reatividade da enzima pelo seu substrato (Vmax), sem afetar a afinidade do complexo ativo enzimasubstrato (KS) 30 Plot de v versus [S] na presença e na ausência de uma concentração fixa do inibidor não-competitivo 31 Modelos de Inibição Acompetitiva Ocorre a altas [s] e ocorre bloqueio de ES. Na enzima pode haver 2 sítios de ligação, um para S e outra para I, sendo que este último só se torna ativo quando o complexo ES esta formado. O complexo ESI formado não gera produtos. 32 kS E + S kP ES + I E + P ki ESI v Vmax [ S] kS 1 [I] [ S] ki Inibição Mista: afeta tanto a afinidade de E por S (kS) como a reatividade de ES (Vmax ) 33 Plot de v versus [S] na presença e na ausência de uma concentração fixa do inibidor acompetitivo 34 Modelos Geral de Inibição Mista v VAP [S] [S] K AP Inibição Competitiva: KAP > K ; VAP = V Inibição Não-competitiva: KAP = K ; VAP < V Inibição Mista: KAP < K ; VAP < V Um ativador é uma substância que aumenta a reatividade de ES (VAP > V) V ou a afinidade de E por S (KAP < K) K 35 This document was created with Win2PDF available at http://www.win2pdf.com. The unregistered version of Win2PDF is for evaluation or non-commercial use only. This page will not be added after purchasing Win2PDF.
Baixar




![+ [E] [S] - Sistemas EEL - Universidade de São Paulo](http://s1.livrozilla.com/store/data/000150897_1-f33431079ef06af434a6636d8f76dc77-260x520.png)

![K m +[S]](http://s1.livrozilla.com/store/data/000111072_1-6f369f2e79d26c21993e0f0f04312053-260x520.png)