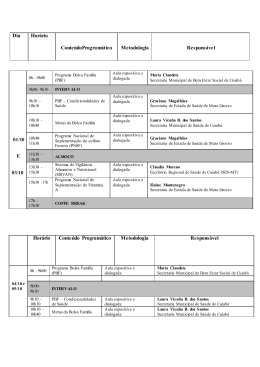
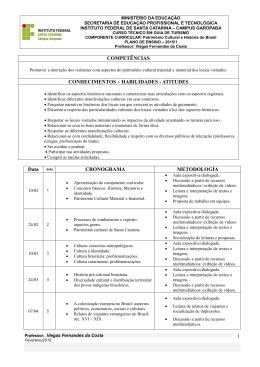
UNIVERSIDADE PRESBITERIANA MACKENZIE Unidade Universitária: CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE Curso: FARMÁCIA Disciplina: QUÍMICA INORGÂNICA Código da Disciplina: 060.1187.1 Etapa: 1º ETAPA Semestre Letivo: 2º / 2012 DRT: 1131860 Professor(es): JOSÉ ALVES ROCHA FILHO Carga horária: 2 H/A TEÓRICA Ementa: A Disciplina Química Inorgânica, inserida na 1ª Etapa do Curso de Bacharelado em Farmácia, pretende fornecer subsídios para que o aluno possa se desenvolver de forma adequada ao longo do curso. O conteúdo abordará aspectos básicos da Química Inorgânica, tais como, Estrutura Atômica, Ligação Química e Propriedades dos elementos e seus complexos, que se pretende contribua para a formação generalista dos bacharéis em Farmácia. Objetivos: Fatos e Conceitos Procedimentos e Habilidades Proporcionar aos alunos uma Capacitar visão global dos princípios correlacionar o a aluno Atitudes, Normas e Valores a Interessar-se configuração fundamentos gerais da química inorgânica, eletrônica de um átomo com as química pelos teóricos da inorgânica assim como da química de suas propriedades periódicas e possibilitando à aplicação dos coordenação. o tipo de ligação química que mesmos nas demais disciplinas ele apresenta. Fazer com que o pertinentes a área, assim como aluno tenha uma visão geral da na resolução de problemas química biológica dos envolvendo estudo de casos. elementos químicos. Conteúdo Programático: 1. Estrutura Atômica e Configuração Eletrônica dos Elementos; 2. Propriedades Periódicas: raio atômico e iônico, energia de ionização, afinidade eletrônica, caráter metálico e eletronegatividade; 3. Ligação Química: tipos (iônica, covalente e metálica), modelo da VSEPR, TLV e TOM; 4. Forças Intermoleculares; 5. Química biológica dos elementos químicos; 6. Estrutura e ligação em complexos. Metodologia: Aulas expositivas e dialogadas com uso de multimídia como recurso. Resolução de exercícios e estudo e discussão de casos. UNIVERSIDADE PRESBITERIANA MACKENZIE Critério de Avaliação: A média final (MF) que define a promoção do aluno será obtida a partir da média ponderada do valor da avaliação intermediária (AI) e da nota da prova de avaliação final escrita (PAFE) que avaliará todo o conteúdo programático ministrado na disciplina, conforme a expressão: MF= (5AI) + (5PAFE)/10. A avaliação intermediária será composta por duas avaliações parciais e pelas atividades desenvolvidas ao longo do semestre. Assim, temos: P1 = Prova parcial (Peso 2,0) P2 = Prova parcial (Peso 2,0) pesquisas, estudo de textos - Peso 1,0) A = Atividades (Exercícios, A média final será calculada mediante a aplicação da seguinte expressão matemática: MF = 2 x P1 + 2 x P2 + 1A + 5 PAFE 10 MF>= 6,0 e 75% de freqüência: aprovado. Bibliografia Básica: ATKINS P.W., JONES L. Princípios de Química, Questionando a vida moderna e o meio ambiente. 3. ed., Porto Alegre: Bookman, 2006. KOTZ J.C.; TREICHEL P.M.; WEAVER G.C. Química Geral & Reações Químicas. 6.ed., São Paulo: LTC, 2 v., 2010. LEE, J. D.; TOMA, H. E.; ARAKI, K.; ROCHA, R. C. Química inorgânica não tão concisa. São Paulo: Edgard Blücher, 5ª edição, 2006. Bibliografia Complementar: SHRIVER, D. F.; ATKINS, P. W. Química Inorgânica. 4. ed., São Paulo: Bookman, 2006. BRADY, J. E.; SENESE, F. Química: a matéria e suas transformações. Rio de Janeiro: LTC, 2 v., 2009. CHANG, R. Química Geral: conceitos essenciais. 4. ed., São Paulo: Mc Graw-Hill, 2006. SPENCER, J. Química : estrutura e dinâmica. Rio de Janeiro : LTC - Livros Técnicos e Científicos, 2007. BROWN, T. L.; LEMAY JR, H. E.; BURSTEN, B. E. Química, A Ciência Central. 9. ed., São Paulo: Pearson Prentice Hall, 2005. UNIVERSIDADE PRESBITERIANA MACKENZIE CRONOGRAMA DA DISCIPLINA SEMANA 1ª 2ª 3ª 4ª 5ª 6ª 7ª CONTEÚDO / ESTRATÉGIA TEORIA Apresentação dos objetivos, programa, bibliografia e critérios de avaliação da disciplina. / Aula expositiva dialogada com uso de quadro e/ou “datashow”. Estrutura atômica: Histórico. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Estrutura atômica: Modelo atômico de orbitais; configuração eletrônica dos elementos. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Estudo da tabela periódica. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Estudo das propriedades periódicas. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Estudo das propriedades periódicas. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Prova (P1) 17/09 Química 8ª 9ª 10ª 11ª 12ª biológica dos elementos. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Ligação Química: iônica, covalente e metálica. Modelo da VSEPR. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Ligação Química: TLV . Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Ligação Química: TLO . Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Prova (P2) 22/10 Forças 13ª 14ª intermoleculares. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. Forças intermoleculares. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. PRÁTICA UNIVERSIDADE PRESBITERIANA MACKENZIE 15ª 16ª Estrutura e Ligação em Complexos. Aula expositiva dialogada com uso de quadro e/ou “datashow”. Exercícios de aplicação. 17ª PAFE (26/11) Vista da PAFE 18ª Vista da PAFE
Baixar