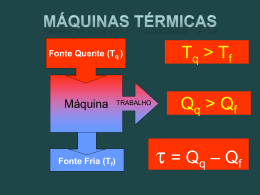
CICLOS TERMODINÂMICOS 1 REVISANDO! Máquina térmica Em geral, qualquer máquina térmica faz com que alguma substância de trabalho realize processo(s) cíclico(s) durante os quais (1) calor é transferido de uma fonte a uma temperatura elevada (2) trabalho é feito pela máquina (3) calor é lançado pela máquina para uma fonte a uma temperatura mais baixa A máquina absorve calor Qq do reservatório quente, rejeita calor Qf para o reservatório frio e realiza trabalho Wmáq Wmáq QH QC 2 Pelo Primeiro Lei da termodinâmica Eint Q W 0 Qlíq QH Qc W Wmáq “É impossível construir uma máquina térmica que, operando num ciclo, não produza nenhum efeito além da absorção de calor de um reservatório e da realização de uma quantidade igual de trabalho” É impossível construir uma máquina trabalhe com rendimento de 100% que Rendimento da máquina térmica e Wmáq QH QH Qc QH 1 Qc QH 3 Bombas de Calor e Refrigeradores E se quisermos transferir calor do reservatório frio para o reservatório quente? Como esta não é a direção natural do fluxo, temos que realizar trabalho para fazer com que isso ocorra utilizando dispositivos como as bombas de calor e refrigeradores Bomba de calor A bomba absorve o calor QC de um reservatório frio e rejeita o calor QH para um reservatório quente. O trabalho realizado na bomba de calor é W Coeficiente de desempenho da bomba de calor CDD calor transferido para o reservatório quente QC trabalhorealizadosobre a bomba W 4 Refrigerador Coeficiente de desempenho do refrigerador CDD (refrigerador)= K = QC W QC QH QC segunda Lei da Termodinâmica: “O calor não flúi espontaneamente de um corpo frio para um corpo quente” Bomba de calor impossível É impossível existir uma bomba de calor ou frigorífico (refrigerador) que absorve calor de um reservatório frio e transfere uma quantidade de calor equivalente para um reservatório quente sem a realização de trabalho viola essa formulação do Segundo Princípio da Termodinâmica 5 Processos Reversíveis e Irreversíveis Um processo reversível é aquele no qual o sistema pode retornar as suas condições iniciais pelo mesmo caminho e no qual cada ponto ao longo da trajetória é um estado de equilíbrio Um processo que não satisfaça essas exigências é irreversível A maioria dos processos naturais é irreversível 6 Se um processo real ocorrer muito lentamente, de tal forma que o sistema esteja sempre muito próximo do equilíbrio, esse processo pode ser considerado como reversível Exemplo Comprimir um gás muito lentamente ao deixar cair sobre o pistão sem atrito alguns grãos de areia Compressão isotérmica e reversível Areia Cada grão de areia adicionado representa uma pequena mudança para um novo estado de equilíbrio Reservatório de calor O processo pode ser revertido pela lenta remoção dos grãos de areia do pistão 7 Algumas Condições para um Processo ser Reversível •Não ha trabalho de força de atrito, de forças viscosas, ou de outras forças dissipativas que produzem calor; • A transferência de calor só ocorre isotermicamente; •O processo deve ser quase-estático, de modo que o sistema está sempre num estado de equilíbrio ( ou infinitamente próximo de um estado de equilíbrio). Qualquer processo que viola pelo menos uma das condições mencionadas acima é irreversível. 8 Máquina de Carnot Em 1824, um engenheiro francês chamado Sadi Carnot descreveu uma máquina teórica - Máquina de Carnot . Carnot mostrou que a máquina reversível é a mais eficiênte que pode operar entre dois reservatórios dados. A B Ciclo de Carnot (1) No processo A B, uma expansão isotérmica, em que o sistema recebe uma quantidade de calor QH da fonte quente. (2) No processo B C, Uma expansão adiabática (Q = O). D C (3) No processo C D, Uma compressão isotérmica, em que o sitema cede uma quantidade de calor QC á fonte fria. (4) No processo D compressão adiabática até estado inicial. http://www.cs.sbcc.net/~physics/flash/heatengines/Carnot%20cycle.html A, uma atingir o 9 Diagrama PV para o ciclo de Carnot Processo A→B, ΔE=0. Expansão Isotérmica VB Q H WH nRTH ln (1) VA Processo C→D ΔE=0. Compressão Isotérmica Dividindo essa duas equações obtemos VC QC WC nRTH ln (2) VD QH TH ln(VB VA ) (3) QC TCln(VC VD ) 10 Para os dois processos adiabáticos BC e DA THVBγ1 TCVCγ1 e TH VAγ1 TCVDγ1 Dividindo as duas equações VB VC (4) VA VD Substituindo 4 em 3 temos: QH TH QC TC 11 “Nenhuma máquina térmica, operando entre dois reservatórios térmicos, pode ser mais eficiente do que uma máquina reversível que opere entre Os mesmos dois reservatórios.” e Wmáq QH QH QC QH 1 QC QH Rendimento térmico da Máquina de Carnot eC 1 k k car TC TH QC QH QC TC TH TC 12 CICLO DE STIRLING O Ciclo Stirling – Reverendo Escocês Robert Stirling, que em 1818 construiu seu primeiro protótipo. Em 1922, foram consideradas obsoletas devido ao advento do Ciclo Otto e do Ciclo Diesel e pela dificuldade em encontrar materiais que diminuíssem as perdas térmicas. Ciclo é altamente recomendado pelo fato de se aproximar muito do Ciclo de Carnot (Ciclo ideal e de eficiência máxima) Fase 1 a→bFluido de trabalho com alta pressão absorve calor da fonte quente e expande-se isotermicamente (máquina realiza trabalho); Fase 2- b→c Fluido desloca-se com volume constante até a fonte fria da máquina, cedendo calor ao regenerador (peça de porcelana porosa que “armazena” parte do calor do fluido) até que sua temperatura se iguale a da fonte fria; Fase 3 c→d Fluido é comprimido isotermicamente e como a pressão do gás está baixa, o trabalho necessário para comprimi-lo até o volume inicial é menor do que o trabalho da fase 1-2 (máquina recebe calor); Fase 4 d→a Fluido é deslocado isovolumetricamente até a parte quente da máquina. Nesta fase o gás absorve o calor que foi cedido ao regenerador e assim sua temperatura se iguala novamente a da fonte quente. À medida que a temperatura do fluido cresce, sua pressão também aumenta e assim o fluido retorna ao estado inicial. 14 15 16 17 FIM 18 Os processos reais seguem um sentido preferencial É o Segundo Princípio da Termodinâmica que determina as direcções em que ocorrem os fenómenos naturais Formulação alternativa do segundo princípio da termodinâmica Enunciado de Termodinâmica: Clausius da segunda Lei da “O calor não flúi espontaneamente de um corpo frio para um corpo quente” Bomba de calor impossível É impossível existir uma bomba de calor ou frigorífico (refrigerador) que absorve calor de um reservatório frio e transfere uma quantidade de calor equivalente para um reservatório quente sem a realização de trabalho viola essa formulação do Segundo Princípio da Termodinâmica 19 4.5 Entropia A variável de estado relacionada com o Segundo Princípio da Termodinâmica, é a entropia S Os sistemas isolados tendem à desordem e a entropia é uma medida dessa desordem A ideia de entropia surgiu no seguimento de uma função criada pelo físico alemão Rudolf Clausius (1822-1888). Expressou a entropia em escala macroscópica pela primeira vez em 1865 A partir da equação que descreve a máquina de Carnot Qf Qq Obteve a relação Qf Tf Qq Tf Tq a razão Q/T tem um significado especial Tq Se dQr for o calor transferido quando o sistema segue uma trajectória reversível entre dois estados, a variação da entropia, independentemente da trajectória real seguida, é igual a f dQr dS T integro dS S i dQr T 20 Em 1887 Boltzmann definiu a entropia dum ponto de vista microscópico Baixa entropia S k B ln W Alta entropia W é o número de microestados possíveis para o sistema Exemplo de Microestados - posições que uma molécula pode ocupar no volume Entropia e o Segundo Princípio da Termodinâmica Outra maneira de enunciar o segundo princípio da termodinâmica “A entropia do Universo aumenta em todos os processos naturais” 21
Baixar