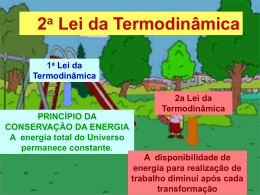
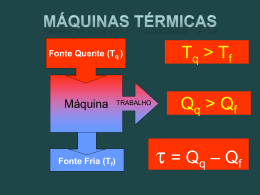
Furukawa - IFUSP Yamamura - FUNDUNESP TERMODINÂNICA OVERVIEW 1ª e 2a Leis Termodinâmica é a ciência que trata • do calor e do trabalho • das características dos sistemas e • das propriedades dos fluidos termodinâmicos Alguns ilustres pesquisadores que construiram a termodinâmica James Joule 1818 - 1889 Sadi Carnot 1796 - 1832 Emile Claupeyron 1799 - 1864 Wiliam Thomson Lord Kelvin 1824 - 1907 Rudolf Clausius 1822 - 1888 Contribuição de James Joule. 1839 Experimentos: trabalho mecânico, eletricidade e calor. James P. Joule (1818-1889) Nasceu em Salford - Inglaterra 1840 Efeito Joule : Pot = RI2 1843 Equivalente mecânico do calor ( 1 cal = 4,18 J) 1852 Efeito Joule-Thomson : decrescimo Lei da Conservação de Energia da temperatura de um gás em função da expansão sem realização de trabalho externo. As contribuições de Joule e outros levaram ao surgimento de uma nova disciplina: a Termodinâmica 1a Lei da Termodinâmica Para entender melhor a 1a Lei de Termodinâmica é preciso compreender as características dos sistemas termodinâmicos e os caminhos “percorridos” pelo calor... Sistema Termodinâmico Certa massa delimitada por uma fronteira. Sistema fechado Vizinhança do sistema. O que fica fora da fronteira Sistema que não troca massa com a vizinhança, mas permite passagem de calor e trabalho por sua fronteira. Sistema isolado Sistema que não troca energia nem massa com a sua vizinhança. Transformação Variáveis de estado Variáveis de estado P1 V1 T1 U1 P2 V2 T2 U2 Estado 1 Transformação Estado 2 Processos “Caminho” descrito pelo sistema na transformação . P1 V1 T1 U1 Processos P2 V2 T2 U2 Durante a transformação Isotérmico temperatura invariável Isobárico Pressão invariável Isovolumétrico volume constante Adiabático É nula a troca de calor com a vizinhança. Transformações 1a Lei da Termodinâmica Sistema Fechado W > 0 → energia que sai do sistema W < 0 → energia que entra no sistema Q > 0 → calor que entra no sistema Q < 0 → calor que sai do sistema ΔU = U2 – U1 1a Lei Variação Energia Interna Q = W + ΔU Variação da Energia Interna ∆U = Q - W Gás Expansão nula W=0 Δ U = Q = (mc)gás ΔT ΔT = 0 → ΔU = 0 ΔT > 0 → ΔU > 0 ΔT < 0 → ΔU < 0 Como (mc)gás = ctc ΔU depende apenas de ΔT. Como U é uma variável de estado, ΔU não depende do processo. A energia interna de um gás é função apenas da temperatura absoluta T. O calor Q que passa pelas fronteiras do sistema depende do processo. O trabalho que atravessa a fronteira depende do processo? ∆U = Q - W W = F.d .W F = Pr.S W = Pr.S.d ∆V = V2 -V1 W = Pr.ΔV depende de como a pressão e volume mudam no processo. Diagramas P x V Gases ideais Estado 1 P1 Como as variáveis de estado se relacionam? 1 T1 V1 Equação de estado no de moles P1V1 = nRT1 Constante dos gases R = 8,31 J/mol.K = 2 cal/mol.K Processo isovolumétrico Transformação a volume constante Q = n CV (T2-T1) Calor específico molar a volume constante 1ª Lei da Termodinâmica Transformação de 1 → 2 U = Q - W W=0 U = Q = n CV (T2-T1) ∆V = 0 Volume invariável Isovolumétrica Processo isobárico Transformação a pressão constante calor específico molar a pressão constante Q = + n CP (TB - TA) W = Po [VB-VA] ∆U = n Cv (TB-TA) Calor específico a volume constante 1ª Lei da Termodinâmica U = Q - W Processo Isotérmico Transformação à temperatura constante Êmbolo movimentado lentamente ∆U = 0 → ∆T=0 0 = Q–W Q = W = n R T [ln(V2/V1)] Processo adiabático Transformação sem troca de calor Movimento rápido do êmbolo. Q=0 Q=0 O processo ocorre tão rapidamente que o sistema não troca calor com o exterior. Primeira Lei da Termodinâmica ∆U = Q - W Q = 0 → ∆U= - W W = - ∆U = - nCv∆T Compressão adiabática W Área sob o grafico Trabalho transforma-se em calor Processos cíclicos 1.- ∆Uciclo = ∆U = 0 pois Tfinal = Tinicial 2.- Qciclo = Q 3.- Wciclo = W = área 12341 1a Lei da Termodinâmica ∆Uciclo = Qciclo - Wciclo Qciclo = Wciclo Wciclo > 0 → Qciclo 0 O sentido do ciclo no diagrama PV : horário. O sistema recebe Q e entrega W Máquinas Térmicas “Trabalham” em ciclos. A máquina de Denis Papin 1647 - 1712 Trabalho Para onde a máquina rejeita calor QCold Fonte quente Fonte fria De onde a máquina retira calor QHot. Ciclo Transformações máquinas térmicas - Diagrama PV Ciclo de Otto Ciclo Diesel Eficiência térmica: 1ªLei Em cada ciclo ∆U = 0 W = Q1-Q2 Eficiência = W/Q1= (Q1-Q2)/Q1 ε = [1 – Q2/Q1] Ciclo Refrigerador Bomba de calor Refrigerador 12: compressão adiabática em um compressor 23: processo de rejeição de calor a pressão constante 34: estrangulamento em uma válvula de expansão (com a respectiva queda de pressão) 41: absorção de calor a pressão constante, no evaporador COP - Coeficiente de Performance Primeira Lei da Termodinâmica Em cada ciclo ∆U = 0 → W + Q2 = Q1 W = Q1 - Q2 Coeficiente de Performance – COP COP refrigerador = Q2/W = Q2/(Q1 - Q2 ) = T2/(T1 – T2) COP bomba calor = Q1/W = Q1/(Q1 - Q2 ) = T1/(T1-T2) Uma bomba de calor necessita de 1.000 W da rede para funcionar e aquece 1 litro de água de 0,5oC /s. Qual o COP desta bomba? 2a Lei da Termodinâmica Entropia 1a Lei da Termodinâmica A energia total do Universo, com ou sem transformações, permanece constante. 2a Lei da Termodinâmica A disponibilidade de energia para realização de trabalho diminui após cada transformação Refrigerador ou Bomba de Calor COPRefrigerador = Q2/W COP Bomba Calor = Q1/W Segunda Lei Formulação de Clausius É impossível existir transferência espontânea de calor de uma fonte fria para outra quente. É impossível construir um dispositivo que, operando em ciclo termodinâmico, não produza outros efeitos além da passagem de calor de um corpo frio para outro quente. Máquinas Térmicas W = W 2 – W1 ε = W/Q1 = [1 - T2/T1] < 1 2a LeiTermodinâmica Formulação de Kelvin-Planck É impossível construir uma máquina térmica com eficiência 100%. Ou seja uma máquina que retira uma quantidade de calor Q de uma fonte quente e a transforme totalmente em trabalho. Segunda Lei Termodinâmica Formulação de Clausius Formulação Kelvin-Planck É impossível existir transferência espontânea de calor de uma fonte fria para outra quente. É impossível construir uma máquina térmica com eficiência 100%. Ambas são afirmações negativas. Não podem ser demonstradas. Baseiam-se em evidências experimentais. A 2a Lei enuncia a impossibilidade de construção de moto perpétuo de 2a espécie. Moto Perpétuo 1a Espécie: criaria trabalho do nada. Viola a 1a Lei. 2a Espécie: viola a 2a Lei 3a Espécie: inexistencia de atrito produziria movimento eterno sem realização de trabalho Qual o limite da eficiência de uma máquina térmica ? ε = [1 – Q2/Q1] Q1 → 0 ε→1 É possível construir esta máquina? ε → 100% Máquinas Térmicas 100% de rendimento ? Impossível! Qual o máximo rendimento de uma Máquina Térmica? A construção de uma máquina ideal Definição de um processo ideal. Processo reversível. Aquele que tendo ocorrido, pode ser invertido de sentido e retornar ao estado original, sem deixar vestígios no sistema e no meio circundante. Processo reversível: desvio do equilíbrio é infinitesimal e ocorre numa velocidade infinitesimal. Causas que tornam um processo irreversível. Atrito Expansão não resistida. Mistura de 2 substâncias diferentes. Outros fatores: Efeito Joule, Combustão, Histerese, etc. Troca de calor com diferença finita de temperatura. O processo de troca de calor pode ser reversível se for feita mediante diferença infinitesimal de temperatura, mas que exige tempo infinito ou área infinita. Conclusão: todos os processos reais de troca de calor são irreversíveis. A máquina ideal de Carnot Ciclo reversível A eficiência da Máquina de Carnot No ciclo: ∆U=0 → W = Q1 - Q2 ε = W/Q1 = [Q1-Q2]/Q1 = 1 - Q2/Q1 Q2/Q1 = T2/T1 BC e DA = adiabáticas ε = (1 - Q2/Q1) = (1 - T2/T1) ε = 1 - T2/T1 Princípio de Carnot "Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T1 e T2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os mesmos reservatórios" Entropia Rudolf Clausius Nasceu em Koslin (Polônia) e morreu em Bonn (Alemanha) Físico Teórico - Termodinâmica Apresentou em 1865 a sua versão para as 1a e 2a Leis da Termodinâmica. 1.- A energia do Universo é constante. 2.- A entropia do Universo tende a uma valor máximo. A quantificação da 2a Lei A desigualdade de Clausius (δQ/T)rev = 0 Σ(δQ/T) ≤ 0 Σ(δQ/T)irrev < 0 A desigualdade de Clausius Σ(δQ/T) no Ciclo de Carnot 1 - Σ(δQ/T)AB = Q1/T1 (isotérmico, T1 = cte) 2 - Σ(δQ/T)BC = 0 (adiabático, Q = 0) 3 - Σ(δQ/T)CD = -Q2/T2 (isotérmico, T2 = cte) 4 - Σ(δQ/T)DA = (adiabático, Q = 0) 0 No ciclo de Carnot os processos são reversíveis Σ(δQ/T)rev = 0 Σ(δQ/T)ABCDA = Q1/T1 - Q2/T2 = 0 → Q2/Q1 = T2/T1 Entropia, uma variável de estado No ciclo A1B2A Σ(δQ/T)A1B2A =Σ(δQ/T)A1B + Σ(δQ/T)B2A = 0 (I) No ciclo A1B3A Σ(δQ/T)A1B3A =Σ(δQ/T)A1B + Σ(δQ/T)B3A = 0 (II) Subtraindo-se (II) de (I) tem-se Σ(δQ/T)B2A = Σ(δQ/T)B3A Em outras "trajetórias"4, 5,... reversíveis entre A e B, o resultado seria Σ(δQ/T)B2A = Σ(δQ/T)B3A = Σ(δQ/T)B4A = Σ(δQ/T)B5A = ... Existe uma “variável de estado”, além do V, P, T e U, que caracteriza cada estado térmico de um sistema termodinâmico: é a Entropia (símbolo: S) ∆S = Σ(δQ/T)rev SB –SA = Σ(δQ/T)rev Variação de entropia - processo irreversível Ciclo “1” + “2” → reversível Σ(δQ/T) (1+2)ABArev = Σ(δQ/T)1ABrev + Σ(δQ/T)2BArev = 0 Σ(δQ/T)1ABrev = - Σ(δQ/T)2BArev (I) Ciclo “1” + “3” → irreversível Σ(δQ/T) (1+3)ABAirrev = Σ(δQ/T)1ABrev + Σ(δQ/T) 3BAirrev < 0 (II) Σ(δQ/T) = 0 (reversível) Σ(δQ/T) 0 (irreversível) ∆S=(Q/T)rev Como Σ(δQ/T) (1+2)ABArev = Σ(δQ/T) (1+3)ABAirrev = 0, substituindo-se (I) em (II) Σ(δQ/T) Σ(δQ/T)3BAirrev - Σ(δQ/T)2BArev < 0 (Σ(δQ/T)3irrev - [SA – SB] < 0 (1+3)ABAirrev = (Σ(δQ/T) 3irrev < [SA – SB] ∆S > Σ(δQ/T) Generalizando : ∆S ≥ Σ(δQ/T) ∆S = Σ(δQ/T) (processo reversível) ∆S > Σ(δQ/T) (Processo irreversível) Princípio do aumento de entropia ∆S viz = - dQ/To ∆Ssist + ∆Sviz ≥ dQ/T - dQ/To ∆S sist ≥ dQ/T ∆Ssist + ∆Sviz ≥ dQ(1/T - 1/To) ∆Ssist + ∆Sviz ≥ 0 Processos reversíveis: ∆Ssist + ∆Sviz = 0 Processos irreversíveis: ∆Ssist + ∆Sviz > 0 (1/T - 1/To) > 0 "Em qualquer processo natural a entropia do Universo nunca diminui" Outra forma de se expressar a 2a Lei Entropia e a desordem Quando um corpo recebe calor a sua entropia aumenta. ∆S = QT 0 Aumenta a EC e/ou a agitação molecular Aumenta a “desordem” A entropia é a medida da desordem ΔS = Q/T < 0 → a “desordem” diminui. Ordem e Energia - Sistemas Biológicos Entropia 2a Lei Evolução natural Ordem → Desordem Como os sistemas biológicos se desenvolvem e mantém alto grau de ordem? É uma violação da 2a Lei? Ordem pode ser obtida as custas de energia Nos animais Celulas – Mitocondria armazenam moléculas de açucar para formar moléculas altamente ordenadas e estruturadass. A fotosíntese converte energia solar em energia potencial nas moléculas de glucose com de alta ordem de organização. Boa Prova
Baixar