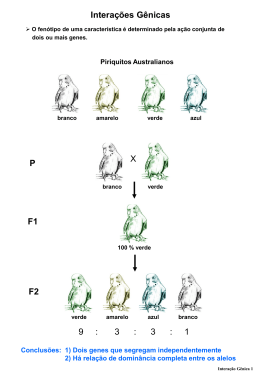
Genoma funcional: identificar genes diferencialmente expressos Alguns fatos que afetam a eficiência dos métodos em identificar esses genes 15 mil a 30 mil diferentes RNAs População de RNA em uma célula >100 000 moléculas de RNA Classe RNA abundantes: 1% dos genes = 50% da pop. de RNAs Classe de RNA raros: metade dos genes = 1% pop. de RNAs Genoma funcional: outras metodologias para identificar genes diferencialmente expressos Limitações microarrays: Genes pouco expressos não são detectados Difícil separação da contribuição de diferentes isoformas de um mesmo gene Outros métodos Subtração de bibliotecas PCR supressivo mRNA fingerprint cDNA-AFLP CAP Trapper Genoma funcional: outras metodologias para identificar genes diferencialmente expressos Subtração de bibliotecas de cDNA sistema utilizando biotina, streptavidina e partículas magnéticas Tester: biblioteca de cDNA aonde estão os genes que quero fisgar meu gene (gene induzido peloetileno:: tratamento com etileno) Driver: biblioteca de cDNA aonde não estão os genes que quero fisgar meu gene (genes não induzidos pelo etileno:: tratamento sem etileno) Genoma funcional: outras metodologias para identificar genes diferencialmente expressos PCR supressivo PCR supressivo PCR supressivo Sequência não forma est. pan em moléculas maiores, só em menores SUPRESSION PCR Differential RNA display Gene 1 GCUAAAGCGA Primer decâmero randômico Reação de PCR com baixa temperatura de anelamento, Gene 2 AAAAAAAA TTTTTT Primer OligodT AAAAAAAA com nucleotídeos marcados radioativamente GCUAAAGCGA Primer decâmero randômico TTTTTT Primer OligodT Gene 3 GCUAAAGCGA 2 dias Primer decâmero randômico GCUAAAGCGA TTTTTT GCUAAAGCGA TTTTTT TTTTTT GCUAAAGCGA Gel de poliacrilamida e uréia (sequenciamento) Condição 1 Condição 2 Gene mais expresso na condição 1 Gene mais expresso na condição 2 Gene somente expresso na condição 2 AAAAAAAA TTTTTT Primer OligodT Criticismos Pouca capacidade para detectar RNA raramente expressos Banda do gel: mistura de cDNAs: 50-75% bandas = falsos positivos Artefatos: primers curtos e baixa temp. anelamento: amplificação inespecífica Limitada quantitividade: competição pelos primers por transcritos de diferentes abundâncias Primers curtos: semi-pareamento em outras regiões do mesmo gene:dif. Clones positivos podem ser o mesmo gene Fragmentos pequenos (150-400 bp) contendo principalmente região 3’ UTR: difícil identific. Modificações do método original Primers mais longos com programa com ciclo alterado Combinação com subtração Arbitrary primed PCR (RAP-PCR): dois primes curtos: probl. Falsos positivos Integração do protocolo para PCR de longa distância no Differential display (até 2Kb- LDD-PCR) EcoR I+CC and Mse I+AAA). Ecotipos de A.thaliana: linhas 1 and 2.Columbia; linhas 3 and 4. Landsberg. Genótipo: Columbia, Usando primer EcoR I+AC e: Mse I primer+AA (lanes 1 and 2); Mse I primer+AAA (lanes 3 and 4). Introdução de um novo nucleotídeo Levou a amplificação de um outro subgrupo de cDNAs Uso em larga escala do cDNA-AFLP Sinchronized tobacco cells ( 12 point into S and M→G1 transition were sampled. Exhaustive cDNA-AFLP: 360 AFLP primer combinationsÇ 18,000 AFLP tags About 10% exhibited a modulated cell cycle profileÇ 1150 AFLP tags Tobacco BY2 cells were synchronised in the G1→S transition phase using Majority of these AFLP tags either match genes of unknown function or represent novel sequences.
Baixar