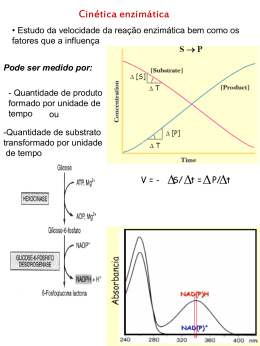
Bioquímica – Módulo II ENZIMAS ENFERMAGEM 2012/1 – PROFª AMANDA VICENTINO Como os seres vivos utilizam a energia provida do ambiente? Manutenção das Funções Glicose Glicose + O2 CO2 + H2O Energia Precisa ser catalisada para ocorrer de forma rápida Manutenção das Funções = REAÇÕES QUÍMICAS REAÇÕES QUÍMICAS precisam ser altamente específicas de modo a gerar produtos definidos devem ocorrer a velocidades adequadas à fisiologia da célula ENZIMAS CATALIZADORES DAS REAÇÕES QUÍMICAS Enzimas são catalisadores que aumentam a velocidade da reação de 5 à 17 ordens de grandeza. Anidrase Carbônica HCO3- + H+ CO2 + H2O V = 106/s V= 1,3 x 10-1/s Estrutura das enzimas: Quase todas as enzimas são proteínas, como tal sua função depende da sua estrutura. A estrutura da enzima dependerá da seqüência primária; secundária; terciária e quartenária. Partes importantes: Apoenzima: parte proteica de uma enzima Sítio ativos: região que forma a maquinaria para a reação química de catálise, é constituída por grupo de aminoácidos específicos. Muitas enzimas necessitam de cofatores para sua atividade ... Porção protéica APOENZIMA Cofator HOLOENZIMA Os cofatores podem ser divididos em dois grupos: • Metais • Moléculas orgânicas (coenzimas) Íons metálicos Moléculas orgânicas Coenzimas Quando o cofator está ligado fortemente a parte proteica da enzima ele é chamado de grupo prostético. Anidrase Carbônica Classificação das enzimas: As enzimas são classificadas de acordo com o tipo de reação que catalisam. Oxido-redutases – enzimas que catalisam reações de óxido-redução, transferência de elétrons. lactato desidrogenase lactato piruvato Transferases – catalisam a transferência de um grupamento de uma molécula a outra. alanina aminotransferase alanina α-cetoglutarato L-glutamato piruvato Hidrolases – catalisam a reação de hidrólise de uma única ou várias ligações covalentes por introdução de uma molécula de água. H2O peptidase Liases – catalisam reações adicionando ou removendo grupamentos. piruvato carboxilase piruvato acetaldeído Isomerases – catalisam reações transferindo grupos dentro da mesma molécula formando isômeros. Fosfoglicose isomerase Ligases – catalisam reações que ligam 2 moléculas acetil CoA carboxilase + Acetil-CoA Como as enzimas funcionam? A+B C+D A e B precisam colidir em uma orientação favorável O complexo A+B precisam atingir um certo nível de energia necessário para que a reação ocorra: ENERGIA DE ATIVAÇÂO Estado intermediário de maior energia livre Enegia de ativação As enzimas aceleram as reações pela facilitação da formação do estado de transição As enzimas se ligam ao substrato de forma com que estes se disponham na orientação correta Estabilização do estado de transição As enzimas aceleram as reações pela facilitação da formação do estado de transição Reduz a energia de ativação necessária para atingir o estado de transição Como a energia de ativação é menor, um maior número de moléculas têm a energia necessária para atingir o estado de transição. As enzimas alteram a velocidade da reação e não o equilíbrio. A primeira etapa da catálise enzimática é a formação do complexo enzima-substrato O substrato se liga ao centro ativo da enzima. O centro ativo é uma fenda tridimensional que possui aminoácidos que participam diretamente na geração e quebra de ligações. Os substratos se ligam à enzima por vários tipos de interações fracas: Complexo Enzima-Substrato Modelo chave e fechadura – o sítio catalítico é rígido e complementar à forma e ao tamanho do substrato. Modelo encaixe induzido – o sítio catalítico não está totalmente pré-formado, a enzima se ajustaria ao substrato. Formação do complexo ES Mecanismos principais de aceleração de uma reação Catálise Ácido-Base – que ocorre com a participação de aminoácidos com cadeias laterais ionizáveis, capazes de doar ou liberar prótons durante a catálise para estabilizar os intermediários (H+, OH-). Catálise Covalente – Neste tipo de catálise é formado uma ligação covalente transitória entre a enzima e o substrato. Quimiotripsina Catálise por íons metálicos – metais firmemente ligados ao sítio catalítico interage entre a enzima e o substrato estabilizando o estado de transição. Aplicações das enzimas Saúde – são usadas para detectar algum tipo de doença, ou dano tecidual, ou como marcador de exames. Infarto do miocárdio Saúde: Algumas doenças são causadas pela falta de enzimas (ex. fenilcetonúria; intolerância a lactose). FENILCETONÚRIA acumula Fenilcetonas TÓXICAS Atraso no desenvolvimento Microcefaléia Convulsões Saúde: Algumas doenças são causadas pela falta de enzimas (ex. fenilcetonúria; intolerância a lactose). INTOLERÂNCIA A LACTOSE Não é degradada Fermentadas por Bactérias intestinais Gases Diarréia Cinética enzimática Estudo das velocidades das reações enzimáticas bem como os fatores que as influenciam: Diretamente proporcional a concentração do reagente: A → B … v = [A]2 A velocidade da reação pode ser medida por: Quantidade de produto formado por unidade de tempo Quantidade de substrato consumido por unidade de tempo V = - S/t = P/t Cinética enzimática V0 varia com a concentração de substrato V0 sobe linearmente a medida que se aumenta a concentração de substrato, e então começa a se nivelar e se aproximar e um ponto máximo onde a velocidade não aumenta mesmo em concentrações maiores de substrato. Velocidade a reação é proporcional a S Substrato satura a enzima Efeito da concentração do substrato na velocidade inicial: A relação entre concentração de substrato e velocidade inicial da reação pode ser expressa algebricamente pela equação de Michalis e Menten. Velocidade inicial Constante de Michaelis Concentração substrato E + S K1 ES K2 V0 – Velocidade Inicial E+P K -1 [ES] – Estado Estacionário constante Então: Formação de [ES] = Degradação de [ES] V0 = K2 [ES] [E] = [Et]-[ES] → A concentração de enzima livre [E] é a diferença entre a conc. total de enzima [Et] e a enzima ligada ao substrato [ES] V de Formação de ES = K1 [E] [S] V de degradação de ES = K –1[ES] + K2 [ES] … (k-1 + k2) [ES] Já que Formação de [ES] = Degradação de [ES] K1 ([Et]-[ES]) [S] = (k-1 + k2) [ES] K1[S][Et] - K1[S][ES] = (K –1+ K2) [ES] [ES] = [Et] [S] [S] + (K –1+ K2) / k1) Km Se, [ES] = [Et] [S] e V0 = K2 [ES] [S] + km Então: V0 = k2 [Et] [S] [S] + km Portanto: Vmax = k2 [Et] Sendo assim: V0 = Vmax [S] Km + [S] A velocidade máxima (Vmax) é obtida quando toda enzima (Et) se encontra sob a forma de ES. Uma observação importante ... Quando V0 = Vm 2 Km = 2 [S] – [S] Vm Vm x[ S ] 2 Km [ S ] Km +[S] = 2 [S] Km= [S] Propriedades importantes de Km: É numericamente igual a [S] na qual a velocidade da reação é metade da Vmax. Característico de cada enzima. Reflete a afinidade da enzima pelo seu substrato. Km = [S] Gráfico Linewevear-Burk 1 v 1 Vmax 1 [S] -1 Km Y = ax +b Linearizando a equação de Michaelis e Menten Consequências importantes de Km Km Afinidade da enzima pelo substrato Km Afinidade da enzima pelo substrato v 1/V Vmáx V/2 Km Km [S] -1/Km -1/Km 1/s Fatores que influenciam na atividade enzimática pH: a ionização de aa pode provocar modificações na conformação da enzima. Pepsina pH ótimo 1,5 Tripsina pH ótimo 7,7 pH do meio alcalino: pH do meio ácido: - concentração reduzida de íons H+ no - excesso de íons H+ no meio; meio; - os aa recebem H+, ficando - os aa liberam H+, ficando eletricamente eletricamente positivo. negativo. Fatores que influenciam na atividade enzimática Temperatura: – A velocidade de reação aumenta com o aumento de temperatura, como se observa na maioria das reações químicas; – Após atingir uma temperatura crítica,a estabilidade da proteína decresce devido a desnaturação térmica. Temperatura ótima da reação Fatores que influenciam na atividade enzimática Concentração da Enzima: – A velocidade máxima da reação é uma função da quantidade de enzima disponível (se há substrato em excesso ). Reações enzimáticas com mais de um substrato Sequencial (formação do complexo ternário) Reações enzimáticas com mais de um substrato Pingue-pongue ou duplo deslocamento Inibição enzimática Inibidores de enzimas são moléculas que interferem com a catálise diminuindo ou interrompendo as reações enzimáticas. Quanto ao tipo de inibição: inibição inespecífica: diminuição da atividade de todas as enzimas por temperatura, pH ou agentes desnaturantes (ex. uréia). inibição específica: agente inibidor diminui a atividade de uma enzima específica ou de um grupo restrito de enzimas. A inibição pode ser irreversível ou reversível. IRREVERSÍVEIS INIBIDORES Inib. Competitiva (freqüente) Inib. Não-competitiva REVERSÍVEIS Inib. Acompetitiva (quando o inibidor liga-se ao complexo ES , mas não a enzima livre) Inibidor irreversível: liga-se a enzima levando a sua inativação definitiva Exemplo: Inibição de Cisteino-peptidases por iodoacetamida Inibidor Competitivo: Inibidor compete com o substrato pelo mesmo sítio de ligação à enzima Km aumenta, mas Vmáx não é alterada. É necessário de [S] maior para deslocar o inibidor. Inibidor Não-Competitivo: O inibidor se liga numa região deferente do sítio de ligação do substrato. Vmáx diminui, mas o Km não é alterado. [S] maior não diminui a inibição. Inibidor acompetitivo: O inibidor se liga somente no complexo ES em sítio próprio. Inibidor não possui semelhança estrutural com o substrato. Km e Vmáx da enzima diminuem. Analgésicos Sítio Ativo da Ciclooxigenase INIBIDOR IRREVERSÍVEL = Ligação covalente Ácido Acetil Salicílico INIBIDOR REVERSÍVEL E COMPETITIVO = Interações sem ligação covalenteÁcido mefenâmico Inibidores Competitivos de proteases do vírus HIV Gag e Pol são clivados pela protease do vírus HIV em 9 pontos específicos para produzir proteínas funcionais. O precursor Gag vai originar proteínas estruturais e o precursor Pol vai originar enzimas como transcriptase reversa, integrase e proteases. Amprenavir Regulação da atividade enzimática Um organismo regula a atividade de algumas enzimas para coordenar seus processos metabólicos Alostérica: Funcionam através da ligação não-covalente e reversível de um metabólito regulador (modulador) Covalente: Regulação da atividade enzimática por modificação covalente reversível Proteolítica: O precursor inativo (zimogênio) é clivado para formar a enzima ativa Regulação alostérica Enzimas Alostéricas São maiores e mais complexas, possuem duas ou mais cadeias polipeptídicas. Não obedecem a cinética de Michaelis-Menten. Tipos de enzimas alostéricas: homotrópica (modulador é idêntico ao substrato); heterotrópica (modulador é diferente do substrato) Um modulador alostérico pode ser tanto um inibidor quanto um ativador. Fosfofrutokinase 1 (PFK-1) Feedback negativo Coordena o fluxo de enzimas por uma via metabólica. A B C D E O produto E funcionou como modulador negativo Regulação por modificação covalente Ex: Fosforilação, acetilação, ubiquitinação, etc Fosforilação – Regula inúmeros processos metabólicos ativando enzimas chaves das vias metabólicas. Glicogênio fosforilase Ativação proteolítica
Baixar