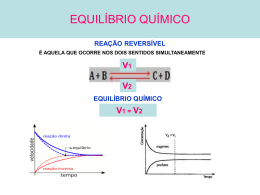
Química Professor Esponja CO2 HCN O=C=O H-C≡N Geometria linear APOLAR Geometria linear POLAR A dose letal de HCN oscila entre 50 a 60 mg/Kg peso (1 ppm = 1 mg/kg) DL=50 a 60 ppm H2SO4 + 2KCN → K2SO4 + 2HCN Hitler também utilizava este gás nas câmaras de gases venenosos. Química| Professor Esponja Termoquímica É a parte da química que estuda a variação de energia H que acompanham as reações químicas. (entalpia = troca de calor) Reações Endotérmicas AB + calor A + B Absorve calor Hp > Hr H > 0 ou + Calor fornecido para a reação Química| Professor Esponja Reações Exotérmicas A + B AB + calor Libera calor Hr > Hp H < 0 ou Calor formado na vizinhança Termoquímica C8H18 + 25/2 O2 8 CO2 + 9 H2O + calor H = - 5440 kJ/mol CH4 + 2 O2 CO2 + H2O + calor H = - Calor 888 kJ/mol de H = - 286,6 kJ/mol combustão H2(g) + 1/2 O2(g) H2O(ℓ) + calor H = - 242,9 kJ/mol H2(g) + 1/2 O2(g) H2O(g) + calor Poder calorífico: 1 mol H2 = 2 g ________ 286,6 kJ 1 kg ________ x Combustível + eficiente: Poder calorífico CO2 x = 143,3 x 103 kJ Química| Professor Esponja pH e pOH (25°C ; H2O ; KW = 10-14) Solução aquosa A [H+] = 10-2 M Solução aquosa B [H+] = 10-9 M [OH-] = 10-12 M pH = 2 pOH = 12 [H+] acidez pH[OH-] = 10-5 M pH = 9 pOH = 5 Na diluição: [H+] acidez pH ÁCIDA [H+] > [OH-] BÁSICA Kw = [H+] . [OH-] 10-14 = 10-7 . 10-7 Química| Professor Esponja [H+] < [OH-] Equilíbrio Químico Considere o sistema em equilíbrio: v1 1 N2(g) + 3 H2(g) KC = [NH3]2 [N2] . [H2]3 v2 2 NH3(g) KP = ∆H = - 92,2 kJ (p NH3)2 (p N2) . (p H2)3 ↑ [ ] = Desloca p/ lado oposto ↓ [ ] = Desloca p/ mesmo lado ↑ pressão = Desloca p/ lado de ↓volume ↓ pressão = Desloca p/ lado de ↑ volume ↑ T = Desloca p/ sentido endotérmico ↓ T = Desloca p/ sentido exotérmico Química| Professor Esponja Pilhas (Célula Galvânica) Pólo – Ânodo Oxidação Corrosão ↑[ ] ↓ERED Química| Professor Esponja Pólo + Cátodo Redução Acúmulo ↓[ ] ↑ERED ddp = red - red red =+0,34V red = -0,76V Química| Professor Esponja
Baixar