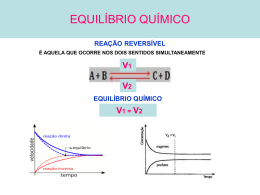
EQUIlÍBRIO IÔNICO pH e pOH Constante de Ionização de Ácidos e Bases + CH3COOH → ← CH3COO + H - [CH3COO ] [H+] Ka = ———————— [CH3COOH] Ácido acético + NH3 + H2O → ← NH4 + OH [NH4+] [OH-] Kb = —————— [NH3] amônia • • • [H2O] não entra na expressão de constantes de equilíbrio em solução aquosa. Cada etapa da ionização tem sua constante, representada por K1, K2, K3, ..., sendo K1 > > K2 > > K3 ... No caso dos poliácidos, a [H+] pode ser considerada como proveniente só da primeira etapa da ionização (K1). 41 Lei da diluição de Ostwald Considerando um eletrólito HA com molaridade M e grau de ionização α : HA(aq) H+(aq) + A-(aq) Início M - - Reage e forma α.M M α.M M α.M M M - α.M M α.M M α.M M Equilíbrio Substituíndo os valores do equilíbrio na expressão da constante de ionização : Ka = [H+] . [A-] [HA] α.M . α.M = = M . (1-α) Para eletrólitos fracos 1- α ~ = α2.M Ki = α2.M (1-α) 1- α Ki = α 2 . M 1 O grau de ionização de um eletrólito aumenta com a diluição ou com a diminuição da concentração em mol/L de eletrólito. Diluindo um ácido fraco, aumenta o α → mas diminui a [H+]. Diluindo uma base fraca ,aumenta o α → mas diminui a [OH -]. Produto iônico da água A água pura sofre auto-ionização : H3O+ + OH- H2 O + H2 O ou H2 O 42 H+ + OH- Substituíndo os valores do equilíbrio na expressão da constante de ionização : Ka = [H+] . [OH-] [H2O] Como a molaridade da água permanece praticamente constante (M = 55,55 mol/L) Ka . [H2O] = [H+] . [OH-] Kw Kw = [H+] . [OH-] [H+] = 10-7 mol/L Kw = 10-14 (25ºC) [H+] = [OH-] como então: [OH-] = 10-7 mol/L Caráter das Soluções Aquosas [H+] > 10-7 mol/L e [OH-] < 10-7 mol/L Solução básica: [H+] < 10-7 mol/L e [OH-] > 10-7 mol/L Solução neutra: [H+] = 10-7 mol/L e [OH-] = 10-7 mol/L Solução ácida: pH e pOH O dinamarquês Sörensen em 1909 definiu pH como sendo o logaritmo (decimal) do inverso da concentração hidrogeniônica ou ainda, como o cologarítmo da concentração hidrogeniônica: pH = -ℓog[H+] variação do pH em função das concentrações de H+ e OH-, a 25 °C: • Meio neutro: pH = 7 • Meio ácido: pH < 7 • Meio básico: pH > 7 43 Por analogia, define-se pOH como sendo o logaritmo (decimal) do inverso da concentração hidroxiliônica: pH = -ℓog[H+] variação do pOH em função das concentrações de OH- e H+: • Meio neutro: pOH = 7 • Meio ácido: pOH > 7 • Meio básico: pOH < 7 Relação entre pH e pOH pH + pOH = 14 (25°C) • • • Os conceitos de pH e pOH indicam que em qualquer solução coexistem H+ e OH-. Por mais ácida que seja a solução, sempre existirão, embora em pequeno número, íons OH-. Nas soluções básicas também estarão presentes os íons H+. As concentrações desses íons jamais se anulam Efeito do íon comum Quando adicionado a um ácido (HA), um sal com o mesmo ânion (A-) ocorrerá um deslocamento de equilíbrio para o sentido dos reagentes com : • • diminuição do grau de ionização de HA ou enfraquecimento de HA; diminuição da [H+], portanto aumento do pH da solução. O íon comum não altera a constante de ionização do ácido. Quando adicionado a uma base (BOH), um sal com o mesmo cátion (B+) ocorrerá um deslocamento de equilíbrio para o sentido dos reagentes com : • • diminuição do grau de ionização de BOH ou enfraquecimento de BOH; diminuição da [OH], portanto diminuição do pH da solução. O íon comum não altera a constante de ionização da base. 44
Baixar