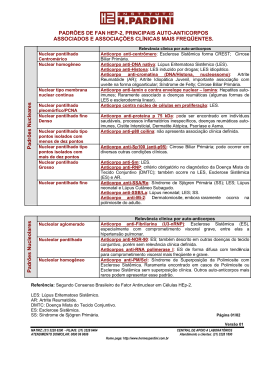
Purificação e caracterização do anticorpo anti-DRG11 Alunas: •Cristina Pinto •Diana Trigo Sistema Nociceptivo percepção do estímulo Somatosensory Cortex Injury Lateral Thalamus condução do estímulo Peripheral Nerve Dorsal Root Ganglion processamento da resposta Dorsal Horn DRG11: papel na nocicepção • Identificação do local de expressão da proteína DRG11 por hibridação com RNAm • Observação do fenótipo de ratinhos knockout [Chen et al, 2001] Gentilmente cedido pela Prof. Sandra Rebelo Importância da proteína DRG11 no desenvolvimento do sistema nociceptivo DRG11, factor de transcrição com 30 kDa da família das proteínas homeodomain 103 1 Homeodomain DNA binding Proteína Recombinante (46kDa) GST Glutationa S-transferase Anti-drg11 263 OAR Interacção Proteína-proteína Anti-drg11 OAR Interacção Proteína-proteína •Obtenção dos anticorpos anti DRG11 Proteína de fusão GST-DRG11 (Cterminal) Soro Purificação e caracterização do anticorpo: Purificação dos anticorpos por Cromatografia de Afinidade Doseamento de IgG antiDRG11 Soro Imunoblotting Imunofluorescência Cromatografia de Afinidade Lavagens da resina de sefarose + GST-DRG11 Incubação da resina com soro “overnight” Separação do sobrenadante Montagem da Coluna Cromatografia de Afinidade Eluição por adição de solução de Glicina a pH 2,3 Recolha de 10 amostras com bomba peristáltica Neutralização com Tris a pH 8,5 Doseamento Proteico: Método de Bradford • Princípio: o reagente de Bradford (corante de azul de Coomassie em àcido fosfórico) liga-se covalentemente às proteínas , numa reacção acompanhada de alteração da cor do reagente em meio ácido. [Bradford MM (1976)] Doseamento Proteico: • Determinação da recta padrão: – Prepararam-se 5 amostras com diferentes concentrações de “bovine serum albumin”(BSA) e reagente de Bradford – Mediram-se as respectivas absorvâncias num espectrofotómetro a 595nm Gráfico 1 – Traçou-se a curva de calibração Quantidade BSA (ug) Recta Padrão y = 33,895x - 14,067 25 20 15 10 5 0 R2 = 0,9846 0 0,2 0,4 0,6 Absorvância 0,8 1 1,2 Doseamento Proteico: imunopurificação anti-drg11 – cada amostra do anticorpo purificado – água – reagente de Bradford • Medir as absorvâncias • Determinar as concentrações das amostras a partir da equação da recta padrão 1000 Quantidade (ug) • Preparar 10 eppendorfs com: 800 600 400 200 0 0 2 4 6 8 10 12 fracções Gráfico 2 Western Blotting: Montagem da cassete (sistema vertical) Colocou-se 5µg de proteína de fusão em cada um dos poços Electroforese Montagem da cassete de blotting Transferência das proteínas para a membrana de nitrocelulose Revelação com Ponceau S Cortou-se a membrana às tiras (1 tira para cada fracção) kDa 97 56 45 36 Imunoblotting Bloqueio em solução de leite em pó Incubação com o anticorpo primário (anti-DRG11 de cada fracção ) Incubação com o anticorpo secundário conjugado com Fosfátase Alcalina (AP) Revelação com NBT + BCIP (substratos da AP) Imunoblotting 1 imunopurificação anti-drg11 2 3 4 5 6 7 8 9 10 Quantidade (ug) 1000 800 600 400 200 0 0 2 4 6 8 10 12 fracções Conclusão: Gráfico 2 •Verificou-se a ligação do anticorpo à proteína de fusão através do aparecimento de um precipitado de cor azul, produto da actividade da AP. •Nas fracções que possuíam uma maior quantidade de anticorpo verificou-se um sinal mais intenso. • Conclusão: O anticorpo encontrava-se funcional, apesar de ter sido sujeito a condições agressivas aquando da sua purificação. • O anticorpo revelou-se funcional para proteínas desnaturadas, contudo havia necessidade de testar a sua actividade em relação a proteínas nativas in loco. Imunofluorescência Imunofluorescência • Usaram-se cortes transversais da região do fígado de embriões de ratinhos com 18dias normais e “knockout”. • Procedimento: – bloqueio com soro de cabra; – incubação com anti-DRG11 (1/200) da fracção 3; – incubação com anticorpo secundário (anti-rabbit) conjugado com fluorocromo vermelho (Alexa 594); – observação dos locais de expressão da proteína usando microscopia confocal; Imunofluorescência • A proteína apresentou como locais de expressão o corno dorsal da medula espinhal e gânglios raquidianos, estruturas envolvidas no processamento de estímulos nóxicos. +/+ -/- • Concluiu-se que os anticorpos estavam funcionais para futuros trabalhos de investigação. NOTA: Os anticorpos já foram utilizados em experiências realizadas pelo orientador. Bibliografia: • Alberts B. et al., Molecular Biology of the Cell, 4th edition, Garland Science • Bradford MM (1976).Anal Biochem. 72: 248-54. • Chen et al (2001).Neuron.31:59-53 • http://www.ruf.rice.edu/~bioslabs/methods/protein.h tml • http://www.mpibpc.gwdg.dc/abtcilungcn/140/confocal /main.html • http://www.roche.appliedscience.com • www.bioscience.com • www4.amerishambioscience.com Agradecimentos: • Prof Doutor Carlos Reguenga • Serviço de Histologia e Embriologia de Abel Salazar • Drª. Sandra Rebelo
Baixar