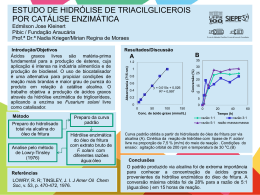
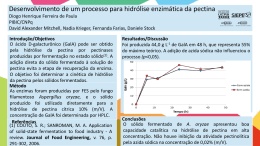
Escola de Engenharia de Lorena EEL-USP Hidrólise Prof. MSc. Marcos Villela Barcza Processos Unitários Orgânicos – PU191 Prof. MSc. Marcos Villela Barcza Hidrólise 1- Introdução: Hidrólise é um termo aplicado a reações orgânicas e inorgânicas em que água efetua uma dupla troca com outro composto: XY + H2O KCN + H2O C2H5Cl + H2O HY + XOH HCN + KOH HCl + C2H5OH Na química orgânica, hidrólise inclui, entre outras reações, saponificação de ácidos graxos e outros ésteres, inversão de açúcares, quebra de proteínas (hidrólises enzimáticas). Por conveniência, têm sido consideradas como hidrólise a reação onde um álcali é utilizado no lugar da água, obtendo um sal alcalino de um ácido no final: O H3C C O + NaOH O CH2 CH3 H3C C - O Na + + H3C CH2 OH O uso de álcalis em solução aquosa leva a outro tipo de reação hidrolítica, chamada fusão alcalina, onde a proporção de álcali é aumentada e a de água reduzida: SO3-Na+ + NaOH O-Na+ + Na2SO3 + H2O Também são consideradas reações de hidrólise aquelas onde são colocados ácidos minerais em água, em pequena ou grande quantidade. Esta adição, semelhante ao álcali, invariavelmente ajuda a iniciar ou acelerar o processo de hidrólise. Outros agentes que aceleram a hidrólise, além de ácidos e álcalis, são utilizadas, mas, à exceção de enzimas, não são importantes. 2- Tipos de hidrólise: São conhecidos cinco tipos de hidrólise: - Hidrólise pura – água é utilizada sozinha; - Hidrólise ácida: uso de ácido mineral em solução aquosa diluída ou concentrada; - Hidrólise básica: uso de álcali em solução aquosa diluída ou concentrada; - Fusão alcalina a alta temperatura: uso de álcali sem ou com pouca quantidade de água; - Hidrólise enzimática. Processos de hidrólise são realizados em fase líquida ou vapor. A maioria dos processos industriais utiliza o primeiro tipo, entretanto, existe um crescente interesse por reações em fase vapor. 3- Agentes de hidrólise: A palavra hidrólise significa decomposição pela água, mas são raros os casos em que a água, por si mesma, sem outra ajuda, pode realizar uma hidrólise completa. Neste caso é necessário operar a temperaturas e pressões elevadas. Para que a reação seja rápida e completa é sempre indispensável um agente acelerador, qualquer que seja o mecanismo da reação. Os mais importantes são álcalis, ácidos e enzimas. - Água: anidridos de ácidos, lactonas e outros anidridos como óxido de etileno são facilmente hidrolisados por água. Sais de diazônio quando aquecidos com água hidrolizam-se completamente: + N N ]Cl OH + H2O(Vapor) + N2 + HCl Ácido benzeno-sulfônico com vapor d’água gera fenol e ácido sulfúrico: SO3H OH + H2O(Vapor) + H2SO4 Cloro-benzeno e vapor d’água passando através de sílica porosa a 575oC também produz fenol: Cl OH + H2O(Vapor) Sílica Porosa + HCl o 575 C - Hidrólise ácida: é realizada com diversas classes de compostos orgânicos: ésteres, açúcares, amidas, etc. Ácidos clorídrico e sulfúrico são os mais utilizados mas, outros ácidos têm sido explorados. Ácidos fórmico e tricloroacético têm menor atividade, mas produzem reações mais limpas. Ácidos oxálico e benzeno-sulfônico são mais ativos que sulfúrico. - Hidrólise alcalina: podemos distinguir três classes de hidrólise alcalina. O uso de baixas concentrações de álcali na hidrólise, usado em reações de ésteres e materiais similares. Uma segunda, uso de álcali suficiente sob pressão e em alta concentração: Cl OH + NaOHaq. H3C Cl + Ca(OH)2 + NaCl + H2O H2O(Vapor) H3C OH + CaCl2 + H2O E por último, fusão de materiais orgânicos com soda cáustica ou potassa. - Hidrólise enzimática: poucas operações em grande escala utilizam enzimas para efetuar hidrólise. Exemplo típico da utilização de enzima está na indústria cervejeira, a fermentação do malte é uma hidrólise por ação da amilase. Hidrólise enzimática está relacionada com a bioquímica. 4- Características das instalações industriais: Processos de hidrólise são realizados, na maioria dos casos, em batelada. Equipamentos como tanques, reatores, hidrolisadores e tubulações são de aço inoxidável para evitar corrosão provocada pela produção de oxigênio livre quando temperatura e concentração do ácido mineral elevadas. Algumas instalações utilizam-se de equipamentos com revestimento de vidro borosilicato (Pirex). Instalação para obtenção de sabão Hidrólise Contínua Descrição do processo O procedimento consiste em hidrolisar a gordura, separar a glicerina e depois neutralizar os ácidos graxos com solução de soda cáustica (NaOH) ou separá-los utilizando processo de destilação fracionada a vácuo. Instalação para procedimento “Colgate” Hidrólise contínua em contracorrente Instalação para obtenção de Fenol Processo Contínuo 01 02 03 04 05 06 07 08 09 10 11 Filtro; Evaporador; Neutralizador; Depósito; Sulfonador; Depósito de benzeno; Depósito de óleum; Deposito de soda cáustica; Refluxo; Depósito de benzeno sulfonato Água; 12 13 14 15 16 17 18 19 20 21 22 Reator de fusão alcalina; Coletor de prod. fundido; Reator; Caldeira; Torre; Filtro prensa; Separador; Depósito fenol bruto; Condensador; Caldeira para fenol; Depósito fenol puro. Reações: (1) C6H6 + H2SO4 C6H5SO3H + H2O (2) 2C6H5SO3H + Na2SO3 (3) C6H5SO3Na + 2NaOH (4) 2C6H5ONa + H2SO3 2C6H5SO3Na + H2SO3 C6H5ONa + Na2SO3 + H2O 2C6H5OH + Na2SO3 Descrição do processo Ácido benzeno sulfônico – preparado de forma contínua em uma série de reatores que atuam em paralelo; O ácido preparado é enviado para o neutralizador (vitrificado) que é alimentado com solução de sulfito de sódio e vapor enviados da caldeira de concentração (15); é mantido fracamente ácida a solução no neutralizador; O anidrido sulfuroso se desprende e enviado para torre e depois conduzido para acidificar o fenóxido de sódio no reator (14); A pasta com benzeno sulfonato de sódio e sulfito de sódio é enviado para um filtro (vitrificado) no qual é insuflado vapor para eliminar SO2 residual; após, a pasta é centrifugada para a separação do sulfito de sódio e solução de benzeno sulfonato de sódio; A solução de benzeno sulfonato de sódio alimenta o evaporador (2) para concentração da solução e depois enviado ao depósito (10); A fusão alcalina ocorre no reator (12). Solução a 70% de soda é pré-aquecida, enviada para o reator e mantida sob agitação a 300 oC. É bombeado a solução de benzeno sulfonato de sódio por debaixo da superfície da soda fundida; Durante seis horas é mantida na temperatura de 305o 310 C e depois a 330 oC durante aproximadamente uma hora; Sulfito de sódio é insolúvel na solução concentrada de soda que contém fenóxido de sódio; Esta solução é transferida para o coletor (13) e lavada com água. Depois enviado para o reator (14) onde recebe água de lavagem usada anteriormente (16) com SO2 para neutralização do fenóxido de sódio a fenol bruto; O fenol bruto passa por um filtro prensa e depois para um separador de líquido; O fenol é purificado por destilação a vácuo para retirada da parte aquosa que é reservada para um novo ciclo de fabricação.
Baixar