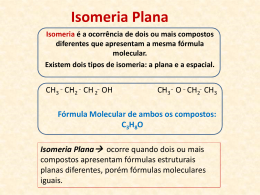
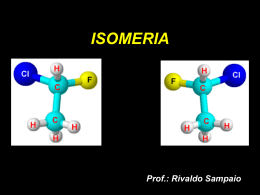
Colégio Cruz das Almas ISOMERIA Prof.:Camilo Castro O que é isomeria? Na substituição de um átomo de hidrogênio do etano por um átomo de cloro,pode-se obter somente uma substância,pois,qualquer que seja o hidrogênio substituído,a estrutura obtida será a mesma: Ao substituir dois átomos de hidrogênio por dois átomos de cloro,obtêm-se duas substâncias diferentes,pois podem ocorrer duas possibilidades: A)os dois cloros podem estar ligados ao mesmo carbono: B) os dois cloros estarem ligados a carbonos diferentes: Perceba,os dois compostos diferentes,possuem os mesmos átomos,na mesma quantidade,mas apresentam estruturas diferentes;esse é um exemplo de ISOMERIA. Histórico O surgimento do modelo atômico de Dalton,em 1808,os químicos começaram a tentar determinar a composição atômica das substâncias. Em 1823,Justus Von Liebig(alemão)-fulminatos(substâncias explosivas)chamados de isocianatos-formado por carbono,oxigênio,nitrogênio e pratafórmula molecular AgCNO. Mesma época-Friedrich Wöhler(alemão)-estudava os cianatos-formados por prata,oxigênio,nitrogênio e prata-fórmula AgCNO. Ambos enviaram seus trabalho,sem conhecer o estudo do outro,para um jornal científico,dirigido por Gay-Lussac,que ao ler os dois trabalhos,percebeu que os dois compostos possuíam a mesma fórmula molecular,mas propriedades diferentes,relatou o fato a Berzelius,que criou a palavra ISÕMEROS(DO GREGO ISO=IGUAL+MEROS=PARTES OU UNIDADES). Pela primeira vez foi evidenciado que,para caracterizar uma substância,além de se saber a quantidade e os tipos de átomo presentes,também se deve conhecer a maneira como os átomos estão arranjados.Assim, a fórmula molecular é insuficiente para caracterizar um composto,é muito importante conhecer as fórmulas estruturais. Mesmo fato foi verificado por Wöhler,na síntese da uréia.Ele verificou que o cianato de amônio e a uréia eram diferentes,mas com a mesma fórmula molecular:CON2H4. A isomeria é um fenômeno muito comum na Química Orgânica e é explicada pela propriedade do carbono de fazer múltiplas ligações. Assim,se define atualmente: ISOMERIA:fenômeno caracterizado pela ocorrência de duas ou mais substâncias diferentes,que apresentam a mesma fórmula molecular mas diferentes fórmulas estruturais. A isomeria se divide em duas partes: 1)Isomeria plana 2)Isomeria espacial ou estereoisomeria 1)Isomeria plana: Ocorre quando a diferença entre os isômeros pode ser explicada por fórmulas estruturais planas. A isomeria plana é subdividida em cinco classes: a)isomeria de função; b)isomeria de cadeia(núcleo); c)isomeria de posição; d)isomeria de compensação(metameria); e)isomeria dinâmica(tautomeria). a)Isomeria de função:os isômeros pertencem a funções químicas diferentes. Os casos mais comuns ocorrem entre: -álcoois e éteres; -álcoois aromáticos,éteres aromáticos e fenóis; -aldeídos e cetonas; -ácidos carboxílicos e ésteres. Exemplos: b)Isomeria de cadeia(núcleo):onde os isômeros pertencem a mesma função e tem cadeias ou núcleos diferentes. Exemplos: c)Isomeria de posição:os isômeros pertencem á mesma função e tem o mesmo tipo de cadeia,mas apresentam diferença na posição de um grupo funcional,de uma ramificação ou insaturação. Exemplos: d)Isomeria de compensação ou metameria:os isômeros pertencem a mesma função e apresentam o mesmo tipo de cadeia,mas apresentam diferença na posição de um heteroátomo(meta=mudança+meros=partes).A metameria pode ser considerada um caso particular de isomeria de posição. Exemplos: e)Isomeria dinâmica ou tautomeria:é um caso particular de isomeria de função,no qual os isômeros coexistem em equilíbrio dinâmico em solução.Os casos mais comuns de tautomeria ocorrem entre:aldeído e enol;cetona e enol. Exemplos: Equilíbrio aldo-enólico (tautômeros) Equilíbrio ceto-enólico (tautômeros) Obs.: A solução que contém os dois tautômeros é denominada alelotrópica. 2)Isomeria espacial ou estereoisomeria É um tipo de isomeria que pode ocorrer em compostos orgânicos,nos quais seus isômeros apresentam a mesma fórmula molecular,mas as ligações entre os átomos estão dispostas(orientadas) de maneira diferente no espaço. Existem dois tipos de isomeria espacial: A)Isomeria geométrica ou cis-trans; B)Isomeria óptica; A)Isomeria geométrica ou cis-trans: Esse tipo de isomeria é mais sutil e mais difícil de ser visualizado do que a isomeria plana,por exigir um conhecimento das estruturas espaciais das moléculas. Tome-se como exemplo,o mais simples dos alquenos,o etileno(eteno),que apresenta fórmula molecular C2H4,nesse composto,todos os átomos estão contidos no mesmo plano no espaço,e o ângulo formado entre suas ligações é de aproximadamente 120°. Perceba que,se houvesse apenas a ligação sigma entre os carbonos,um deles poderia efetuar,de modo relativamente livre,um movimento de rotação em relação ao outro.A ligação pi impede esse movimento de rotação em torno do eixo que contém a dupla ligação entre os carbonos;para que isso pudesse ocorrer,seria necessário que a ligação pi fosse rompida;para isso,porém,é preciso uma quantidade de energia bem maior que a que pode ser oferecida pela temperatura ambiente. Quando dois hidrogênios ,um de cada carbono do etileno,são substituídos por dois átomos de cloro,formam-se duas estruturas diferentes com a mesma fórmula molecular : C2H2Cl2 Devido a existência da ligação pi,essas duas estruturas não são interconversíveis espontaneamente. A nomenclatura desses dois isômeros pode ser dada pelos prefixos cis-trans ou Z-E: O composto que apresentar,do mesmo lado do plano imaginário,os ligantes dos carbonos da dupla com os maiores números atômicos(Z),será denominado cis ou Z.O outro composto será denominado trans ou E. OCORRÊNCIA DE ISOMERIA GEOMÉTRICA:para que esse tipo de isomeria possa ocorrer,é necessária uma série de condições que estão relacionadas aos tipos de compostos: -Compostos alifáticos; -Compostos cíclicos; COMPOSTOS ALIFÁTICOS: -os compostos alifáticos devem apresentar pelo menos uma dupla ligação entre carbonos,e cada um dos carbonos da dupla deve apresentar grupos ligantes diferentes. A estrutura que apresentar os dois ligantes de maiores números atômicos Z( Cl no carbono a, e CH3 no carbono b),no mesmo lado do plano,será denominada isômero cis ou Z. COMPOSTOS CÍCLICOS: Nos compostos cíclicos não existe a possibilidade de um movimento d rotação dos átomos que compõe o ciclo.Os compostos cíclicos devem apresentar grupos ligantes diferentes em pelo menos dois carbonos do ciclo.
Download