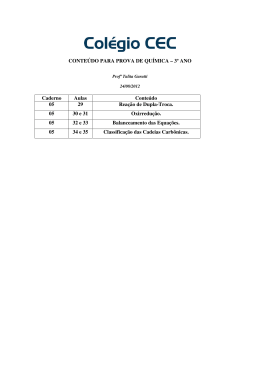
IMPUREZA EM REAGENTES QG - 19 EXERCÍCIO O grau de pureza da hematita é de aproximadamente 86% para obter Fe2O3. Se obtivermos 1 tonelada de hematita, quanto se produzirá de Fe? EXERCÍCIO RENDIMENTO Expectativa, ou seja, espera-se que produza tanto, mas a realidade é outra. Exercício: O alto-forno de uma siderúrgica foi alimentado com 16 ton de hematita, já descontadas as impurezas. Qual o rendimento da reação se a massa de ferro obtida foi de 8,96 ton. OXIRREDUÇÃO QF - 21 Tabela QG – 06, pag. 16 Sn Pb Mn Pt 2+ 4+ Fe Co Ni Cr 2+ 3+ Zn Cd Ag Cu 1+ Hg Au Bi 2+ Al 1+ 2+ 1+ 3+ 3+ I A – Hoje Li Na Kama Robson Crusoé Francês II A - Bete Magrela Casou Senhor Ba Rão III A - Bernarda Alba Ganhou Interessante Telefonema IV A - Casamento Simples Geralmente Sen Problemas V A - Ninguém Pode Assassinar Sebastião Bismuto VI A - O S Se Te Porquinhos VII A - Ficou Claro Brama Imita Antártica VIII A - Hélio e Neônio Arrumaram Krianças Xeretas e Ranhentas Número de oxidação (nox) Composto iônico O nox será positivo se perder elétrons e negativo se ganhar. O nox será a própria carga do íon formado. (POLAR) Composto covalente O nox será positivo para o elemento menos eletronegativo e negativo para o elemento mais eletronegativo. (POLAR) Número de oxidação (nox) Composto covalente Entre ligações de átomos de mesmo elemento não há transferência de elétrons. (APOLAR) F > O > N = Cl > Br > I = S = C > P = H EX.: Classifique as moléculas abaixo como polar e apolar. Al2O3, H2O, CO2, HCCl3, NaCl, H3PO4, HClO, H2 P P AP P P P P AP Determinação do número de oxidação A. O nox de um elemento em uma substância simples é zero. H2, O2, Cl2, Fe, Al, S8 B. O nox do hidrogênio é +1 exceto quando em hidretos metálicos. HCl, H2O, NaOH, NaH, KH, CaH2 Determinação do número de oxidação C. O nox do oxigênio é -2 exceto quando for ligado ao flúor (+1 ou +2), quando for peróxido (-1) e quando for superperóxido (-1/2). H2SO4, Ca(OH)2, H2O2, CaO2, K2O4 D. Agente redutor: doa elétrons reduzindo a outra espécie química. E. Agente oxidante: recebe elétrons oxidando a outra espécie química. Reação de Oxirredução Balanceamento por oxirredução Passo 1: Determinar o nox de todos os elementos e identificar os elementos que variaram como quem oxidou e quem reduziu. Balanceamento por oxirredução Passo 2: Escolha uma substância que oxidou e que reduziu, dando preferência para o de maior atomicidade. Calcule o total de elétrons cedidos e recebidos. Passo 3: Após encontrado o valor do ∆ de cada, troca-se os valores. Balanceamento por oxirredução Passo 4: Finaliza-se o balanceamento pelo método das tentativas, deixando hidrogênio e oxigênio por último. sempre o Balanceamento por oxirredução Peróxido de hidrogênio (H2O2) 1. Agente redutor Os coeficientes de balanceamento de H2O2 e H2O serão sempre iguais. Balanceamento por oxirredução Peróxido de hidrogênio (H2O2) 2. Agente oxidante Balanceamento por oxirredução Auto-oxirredução ou desproporcionamento
Baixar