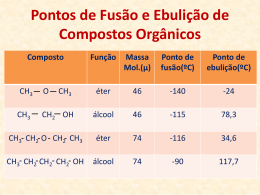
UNIVERSIDADE FEDERAL DE OURO PRETO PRÉ-VESTIBULAR RUMO À UNIVERSIDADE CAMPUS JOÃO MONLEVADE QUÍMICA ORGÂNICA ORIENTADORA: PROF.ª DRA. KARLA VIEIRA PROF.ª LUCAS SIQUEIRA PROPRIEDADES FÍSICAS E QUÍMICAS DOS COMPOSTOS ORGÂNICOS • São elas: • Ponto de Fusão e Ebulição; • Solubilidade; • Acidez e Basicidade. • Para estudá-las, veremos também: • Ligações Intermoleculares; PONTO DE FUSÃO E EBULIÇÃO (I) • Essa propriedade depende das forças intermoleculares e do tamanho das moléculas; • A mudança de estado físico ocorre com o fornecimento de energia, que é proporcional à intensidade das forças intermoleculares; • De forma geral: • Quanto maior a intensidade das ligações intermoleculares, maior a energia necessária para quebra-las, e, portanto, maior energia necessária para a mudança de estado e, consequentemente, a temperatura de fusão e ebulição. PONTO DE FUSÃO E EBULIÇÃO (II) • Esquematicamente: LIGAÇÕES INTERMOLECULARES (I) • Dipolo instantâneo-dipolo induzido: • São interações características das substâncias formadas por moléculas apolares, embora ocorram em todos os tipos de moléculas; ou seja, só há interações dipolo induzidodipolo induzido nas moléculas apolares; • Tanto no estado sólido quanto no líquido, devido à proximidade das moléculas, ocorrem deformação nas nuvens eletrônicas, originando polos. LIGAÇÕES INTERMOLECULARES (II) • Dipolo instantâneo -dipolo induzido (CONTINUAÇÃO): • São esses polos induzidos que mantém moléculas unidas; • As moléculas apolares geralmente são simétricas, ou seja, a nuvem eletrônica distribui-se de maneira uniforme em toda sua extensão; • Ocorre mais comumente nos hidrocarbonetos. LIGAÇÕES INTERMOLECULARES (III) • Dipolo permanente-dipolo permanente: • São características das substâncias formadas por moléculas polares, e ocorrem entre os polos permanentes presentes na molécula. • São exemplos a ligação intermolecular do HCl, do HBr, entre outros; • As moléculas da maioria das funções orgânicas interagem por meio desse tipo de força. Alguns exemplos são: • Aldeídos, Cetonas, Haletos Orgânicos; LIGAÇÕES INTERMOLECULARES (IV) • Ligação de Hidrogênio: • A ligação é parecida com o tipo dipolo-dipolo, sendo considerada mais extrema, devido a polarização mais acentuada; • Ocorre em ligações do tipo H-FON, onde F, O e N são altamente eletronegativos; • Ocorre com a água, dando origem à tensão superficial; • Ocorre em algumas funções orgânicas, como álcoois, ácidos carboxílicos e aminas primárias. LIGAÇÕES INTERMOLECULARES (V) • Em ordem interação: decrescente de intensidade da • Ligações de Hidrogênio > Dipolo-dipolo > dipolo induzido QUESTÕES PONTO DE FUSÃO E EBULIÇÃO (III) • Tamanho das moléculas: • Quanto maior o tamanho delas, maior a superfície, propiciando maior interação com moléculas vizinhas, o que eleva a temperatura de ebulição. PONTO DE FUSÃO E EBULIÇÃO (IV) • Para moléculas com tamanho iguais: • Quanto maior a intensidade das forças intermoleculares, maior será sua temperatura de fusão e ebulição. • Experimentalmente: • OBS: Compostos com o mesmo esqueleto carbônico, mas pertencente a funções diferentes, são chamados séries heterólogas. PONTO DE FUSÃO E EBULIÇÃO (V) • Para moléculas com o mesmo tipo de interação: • Quanto maior o tamanho da temperatura de fusão e ebulição. • Experimentalmente: molécula, maior a • OBS: Compostos pertencentes a mesma função e que diferem entre si pela quantidade de grupos CH2, são denominadas séries homólogas. E as propriedades químicas? OBSERVAÇÃO • Existem ainda séries isólogas, que apresentam mesmo número de carbonos, diferindo apenas na sua insaturação (quantidade de H2). Exemplos: • Ainda sobre P.F. e P.E., as cadeias mais ramificadas apresentam menores PF e PE. QUESTÕES QUESTÕES RECAPITULANDO: SÉRIES ORGÂNICAS • Homólogas: • Compostos pertencentes a mesmas funções, diferindo apenas pela quantidade de CH2; • Heterólogas: • Compostos com o mesmo número de carbonos, diferindo pela função; • Isólogas: • Compostos que apresentam mesma função, diferindo apenas por pares de H2 (Ligação simples, dupla ou tripla). SOLUBILIDADE (I) • A solubilidade também depende das forças intermoleculares. Assim, substâncias que apresentam o mesmo tipo de força intermolecular tendem a dissolver entre si. • Obedece à lei: Semelhante dissolve semelhante; Polar dissolve polar, apolar dissolve apolar. • Isso explica o fato de água não dissolver em óleo, e vice-versa. • Vejamos a seguir uma tabela de solubilidade para alguns álcoois: SOLUBILIDADE (II) SOLUBILIDADE (III) • Notando a tabela, observamos que à medida que a cadeia carbônica aumenta, sua solubilidade em água diminui. Isso acontece por que os álcoois apresentam, em sua estrutura, uma parte polar e outra apolar. • Nos álcoois que apresentam quatro ou mais carbonos, começa a ocorrer uma predominância da parte apolar, o que diminui sua solubilidade em água e, por consequência, aumenta sua solubilidade em compostos apolares. P.F., P.E. E SOLUBILIDADE • De forma geral, podemos afirmar: • Quanto mais polar a substância, maior o ponto de fusão e ebulição e maior a solubilidade em água; • Quanto maior a cadeia carbônica, maiores os pontos de fusão e ebulição e menor a solubilidade em água; • Quanto mais ramificada a cadeia, menor o P.E. e o P.F., e maior a solubilidade; • A presença de insaturações diminui o P.E. e o P.F., e aumenta a solubilidade; QUESTÕES MICELAS ACIDEZ E BASICIDADE • Ácidos orgânicos: 1. Ácidos carboxílicos; 2. Fenóis; 3. Se houvesse, seria o álcool. • Bases orgânicas: 1. Aminas; 2. Amidas ACIDEZ E BASICIDADE (II) • Quanto maior o Ka, maior o caráter ácido: ACIDEZ E BASICIDADE (III) • Quanto maior o Kb, maior o caráter básico: QUESTÕES DÚVIDAS? PROF.ª LUCAS SIQUEIRA OBRIGADO PELA ATENÇÃO! PROF.ª LUCAS SIQUEIRA
Download