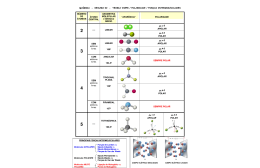
GEOMETRIA MOLECULAR E INTERAÇÕES QUÍMICAS MOLECULARES Professor Cristiano É GEOMETRIA MOLECULAR o estudo de como os átomos estão distribuídos espacialmente em uma molécula. Dependendo dos átomos que a compõem. As principais classificações são: linear, angular, trigonal plana, piramidal e tetraédrica. Para se determinar a geometria de uma molécula, é preciso conhecer a teoria da repulsão dos pares eletrônicos da camada de valência. VSEPR (REPULSÃO DOS PARES DE ELÉTRONS DA CAMADA DE VALÊNCIA) Baseia-se na idéia de que pares eletrônicos da camada de valência de um átomo central, estejam fazendo Ligação química ou não, se comportam como nuvens eletrônicas que se repelem, ficando com a maior distância angular possível uns dos outros. Uma nuvem eletrônica pode ser representada por uma ligação simples, dupla, tripla ou mesmo por um par de elétrons que não estão a fazer ligação química. GEOMETRIA MOLECULAR LINEAR HCl L80º HBr CO2 LINEAR 180º ANGULAR H 2O 104,5º TRIGONAL PLANA D BF3 120º PIRÂMIDE TRIGONAL E NH3 107,3º TETRAÉDRICA F (CH4) 109,5º LINUS PAULING Prêmio Nobel de Química em 1954 e da Paz em 1962. Famoso por suas pesquisas sobre estruturas moleculares e pela luta contra as armas nucleares. CONCEITO DE ELETRONEGATIVIDADE Eletronegatividade é a tendência que o átomo de um determinado elemento apresenta para atrair elétrons, num contexto em que se acha ligado a outro átomo. Fui Ontem No Clube Brasil I Só Comi Pão Húngaro Metais VALORES DE ELETRONEGATIVIDADE POLARIDADE DAS LIGAÇÕES LIGAÇÃO POLARES E APOLARES Ligação covalente polar δ+ δ- H ─ Cl carga positiva. *Como o Cloro é mais eletronegativo, atrai para si o pólo com Ligação covalente apolar H ∆ = 4,0 – 2,1 = 1,9 ─H ∆ = 2,1 -2,1 = 0 * Possuem a mesma eletronegatividade. LIGAÇÃO IÔNICA X LIGAÇÃO COVALENTE Ligação iônica : Doação e recebimento de elétrons. (metais com não metais),( 1,2e3 com 5,6 e7) Valores de ∆ acima de 2 indica ligação com caráter iônico. KCl ∆ = 3,0 – 0,8 = 2,2 NaCl ∆ = 3,0 – 0,9 = 2,1 (IÔNICA) (IÔNICA) LIGAÇÃO IÔNICA X LIGAÇÃO COVALENTE Ligação Covalente: Compartilhamento de pares de elétrons. (Não metais) Valores de ∆ abaixo de 1,5 indica ligação com caráter predominantemente covalente. Cl2 ∆ = 3,0 – 3,0 = zero (COVALENTE APOLAR) BrCl ∆ = 3,0 – 2,8 = 0,2 (COVALENTE POLAR) ICl ∆ = 3,0 – 2,5 = 0,5 (COVALENTE POLAR) HCl ∆ = 3,0 – 2,1 = 0,9 (COVALENTE POLAR) POLARIDADE DAS MOLÉCULAS POLARIDADE DE MOLÉCULAS A polaridade de uma molécula é verificada pelo valor do momento de dipolo →µ A polaridade de moléculas com mais de dois átomos é expressa por: →µR (momento dipolo resultante). H2 H─H HF H ─F CO2 O═C ═ O HCN H ─ C≡N geometria linear →µ = zero geometria linear →µ ≠ 0 geometria linear →µ = 0 geometria linear →µ ≠ 0 Apolar Polar Apolar Polar POLARIDADE DAS MOLÉCULAS Amônia(NH3) Polar H2O Polar CH4 Apolar HCCl3 Polar COMPOSTOS ORGÂNICOS Polares: Metanol, etanol, propanona. Apolares: Derivados direto do petróleo: gasolina, benzina, benzeno, óleo diesel, óleo lubrificante, parafina, vaselina, óleos de origem animal ou vegetal. POLARIDADE DE MOLÉCULAS ORGÂNICAS A polaridade das moléculas orgânicas são feitas analisado o momento dipolar resultante. →µR (momento dipolo resultante). Grupos polares: ─OH ─NH2 ─COOH MOLÉCULAS ORGÂNICAS Etanol Polar Gasolina C8H18 Apolar Propan-2-amina Polar Tetracoreto de carbono Apolar POLARIDADE E SOLUBILIDADE POLARIDADE E SOLUBILIDADE Semelhante dissolve semelhante. Soluto polar tende a dissolver bem em solvente polar. Soluto apolar tende a dissolver bem em solvente apolar. EXEMPLO Dentre as substâncias qual dissolve melhor em água? Qual tem diferença de eletronegatividade? Gás oxigênio(O2 ) Gás Ozônio (O3) Gás Nitrogênio (N2) Dióxido de Carbono(CO2) Àcido Clorídrico(HCl) POLARIDADE E SOLUBILIDADE A solubilidade diminui com o aumento da cadeia. Os álcoois até 3ou 4 carbonos são bastante solúveis devido a presença da hidroxila. Essa solubilidade do álcool diminui a medida que o número de carbono aumenta. SOLUBILIDADE E TAMANHO DA CADEIA H3COH H3CH2OH H3CCH2CH2OH H3CCH2CH2CH2OH H3CCH2CH2CH2CH2OH H3CCH2CH2CH2CH2CH2OH GRUPO HIDRÓFOBO E HIDRÓFILO Nonanoato de sódio VITAMINAS LIPOSSOLÚVEIS Vitamina D Vitamina E Vitamina A VITAMINAS HIDROSSOLÚVEIS Vitamina C ff FORÇA DE INTERAÇÃO OU LIGAÇÃO INTERMOLECULAR FORÇA DE INTERAÇÃO OU LIGAÇÃO INTERMOLECULAR O que mantêm as moléculas unidas nos três estados (sólido, líquido e gasoso) são as chamadas ligações ou forças ou interações moleculares. São três tipos de forças: Ligação de Hidrogênio Dipolo permanente ou dipolo-dipolo (DD) Dipolo instantâneo (DI), força de van der Waals ou força de dispersão de London ESTADOS DE AGREGAÇÃO DE UMA SUBSTÂNCIA LIGAÇÃO DE HIDROGÊNIO São interações que ocorrem entre moléculas que apresentem H ligados diretamente a F O ou N. (EX: NH3 – H2O -HF) LIGAÇÃO DE HIDROGÊNIO Ligação covalente e de hidrogênio Ligação de hidrogênio rompendo DIPOLO DIPOLO Força de atração entre dipolos, positivos e negativos. Ex: HCl -HI - PCl3 DIPOLO INDUZIDO OU VAN DER WAALS Ocorrem em todas as substâncias polares ou apolares F2, Cl2, Br2, I2, hidrocarbonetos FORÇAS INTERMOLECULARES E PONTO DE EBULIÇÃO FORÇAS INTERMOLECULARES E PONTO DE EBULIÇÃO Quando uma substância á aquecida e passa do estado líquido ou sólido para o estado gasoso ocorre o rompimento de ligação intermolecular. FORÇA DE LIGAÇÃO E PONTO DE EBULIÇÃO Ligação de Hidrogênio: HF- H2O - NH3 Ligação Dipolo Dipolo: HCl – HBr – HI Ligação de Dipolo-instantâneo ou DI: F2, Cl2, Br2, I2 PONTO DE EBULIÇÃO E TAMANHO DA CADEIA H3CCH2CH2CH2CH2CH2OH H3CCH2CH2CH2CH2OH H3CCH2CH2CH2OH H3CCH2CH2OH H3CH2OH H3COH PONTO DE EBULIÇÃO Numa cadeia de massa igual a menos ramificada é mais estável porque aumenta a extensão para a atuação das forças intermoleculares. Peruzzo, BIBLIOGRAFIA Francisco Miragaia. Química na abordagem do cotidiano: volume 2, ensino médio. São Paulo: Moderna, 2003. Google. Disponível em <http://images.google.com.br/images> acesso em 27/06/2009. Disponível em<http://educacao.uol.com.br/quimica/>a cesso em 27/06/2009.
Download