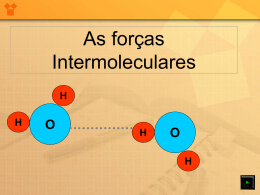
Por que água e óleo não se misturam? Por que água e óleo não se misturam? Água → Molécula POLAR Óleo (hidrocarboneto) → Molécula APOLAR REGRA DE SOLUBILIDADE Substância Polar dissolve Substância Polar. Substância Apolar dissolve Substâncias Apolar. Água e álcool se misturam? Tanto a molécula de água quanto a molécula de álcool são POLARES Nós somos Igual a água e óleo Que jamais se juntará Só durante algum momento Em que se pode misturar Água e óleo- Vanessa da Mata Ação dos Sabões, Detergentes e Sabonetes MOLÉCULA DE UM SURFACTANTE: ESTEREATO DE SÓDIO Ação dos Sabões, Detergentes e Sabonetes FORMAÇÃO DAS MICELAS BONS ESTUDOS! As forças Intermoleculares H H O H O H As forças Intermoleculares H H H O O H O H As ligações intermoleculares são mais fracas do que as ligações intramoleculares (ligações entre átomos que constituem as moléculas). H As forças Intermoleculares CLASSIFICAÇÃO • DIPOLO-DIPOLO: Ocorre entre moléculas polares. • PONTE DE HIDROGÊNIO: Ocorre em moléculas polares que contenham Hidrogênio ligado ao Flúor ou Oxigênio ou Nitrogênio. • LONDON (DIPOLO INSTANTÂNEO/ INDUZIDO): Ocorre entre moléculas Apolares. Ligações dipolo-dipolo H + H S - + + + + H H S H S + H Ocorre em moléculas polares. O polo negativo atrai o polo positivo de outra molécula, e vice- versa Ligações de Hidrogênio H + H O - + + + + H H O Clica Enter H O As ligações de H estabelecem-se entre átomos muito eletronegativos (F, O e N) e o átomo de H. + H Ligações de Hidrogênio H + H O - + + + + H H O Clica Enter H O + H As ligações de H são das ligações intermoleculares mais fortes. Ligações de hidrogênio H H H O S H Clica Enter Ligação dipolo-dipolo H H O Ligação por ponte de H Dipolo-Dipolo induzido H + H O Clica Enter + Cl Cl Ocorre nas moléculas Apolares. Uma força maior pode deslocar o par eletrônico para um dos átomos da molécula criando um DIPOLO INDUZIDO. Formação do Dipolo Induzido + - Dipolo 1 + Molécula apolar Dipolo 1 - Clica Enter + Dipolo induzido As “moléculas” ficam ligadas por forças dipolo permanente -dipolo induzido. - Ligações de London A + Dipolo instantâneo A B + Molécula apolar Clica Enter B - - Dipolo induzido Esse tipo de força também é conhecida como força DIPOLO INDUZIDO- DIPOLO INDUZIDO Em 1960, o alemão Uwe Hiller sugeriu que um tipo de força atrativa, entre as moléculas da parede e as moléculas da pata da lagartixa, fosse a responsável. Mais tarde... "Full, Adhesive force of a single gecko foot-hair" (Autumn, K. et al., Nature 405, 681-685 (2000)), Revista Nature São forças intermoleculares as responsáveis pela adesão da pata da lagartixa à parede. Mais precisamente entre a superfície e as moléculas dos "setae", pelos microscópicos que cobrem as patas das lagartixas. Tensão superficial da água Todas as proteínas que compõe o nosso organismo são constituídas por sequências de amino-ácidos, ligados covalentemente. Estes compostos possuem grupos -OH e -NH capazes de formar uma forte rede de ligações intermoleculares. O DNA de todos os humanos: sua forma de dupla-hélice - é mantida graças às ligações hidrogênio entre os grupos dos -OH e -NH das bases nitrogenadas heterocíclicas que o compõe: GCAT. As moléculas de água interagem muito mais fortemente com suas vizinhas do que com as moléculas do ar, na interface. As moléculas que estão no interior da gota, por exemplo, interagem com outras moléculas em todas as direções; as moléculas da superfície, por outro lado, interagem somente com moléculas que estão nas suas laterais ou logo abaixo. Este desbalanço de forças intermoleculares faz com que estas moléculas, da superfície, sejam atraídas para o interior do líquido, criando a uma tensão superficial As ligações hidrogênio, no estado sólido, conferem à água uma organização reticular quase cristalina, com um maior espaço entre as moléculas, ou seja, uma menor densidade. Por esse motivo, o gelo flutua na água
Download