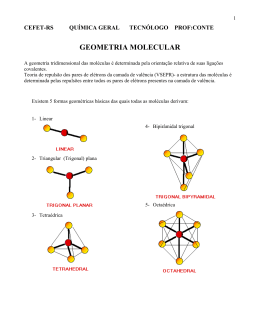
Ligação Química nos Complexos - Prof. J. D. Ayala -1- ASPECTOS GERAIS Tal como todos os demais compostos, os complexos dos metais de transição devem sua estabilidade à diminuição de energia que ocorre quando elétrons se movem no campo de mais do que um núcleo. Por isto, as teorias da ligação em complexos de metais de transição não diferem, fundamentalmente, das teorias empregadas na discussão de outras ligações química. Entretanto, a ligação química nos compostos de coordenação dos metais de transição envolve algumas características novas às quais não foi dada ênfase, quando da discussões de outros sistemas: 1) os orbitais d do átomo central estão envolvidos na ligação aos ligantes; 2) é importante levar em conta explicitamente o comportamento dos elétrons não ligantes; 3) é interessante examinar não somente os estados eletrônicos mais baixos, mas também seus estados eletrônicos excitados, pois é a existência destes estados que é responsável pela absorção de luz e coloração dos íons. 4) As propriedades magnéticas dos complexos dos metais de transição são muito importante e deveriam ser explicadas satisfatoriamente pelas teorias de ligação. Existem três (quatro) maneiras importantes de se chegar ao problema da ligação em complexos de metais de transição: 1) Teoria da Ligação de Valência (TLV) – Segundo Pauling, a formação de um complexo pode ser vista como uma reação ácido (metal central) – base (ligantes) de Lewis, formando-se uma ligação covalente coordenada entre as espécies; 2) Teoria do Campo Cristalino (TCC) – Hans Bethe estabelece que a atração entre a espécie central e os ligantes é puramente eletrostática, seja na interação íon-íon ou íon-dipolo. 3) Teoria do Campo Ligante – Van Vleck fez uma ampliação da abordagem eletrostática (TCC), que leva em consideração certas interações entre os orbitais do metal e os ligantes. Há três tipos de interações possíveis: interação de orbitais do tipo σ; interações do tipo π ou dπ-pπ, estas devidas à superposição π de orbitais cheios do metal com orbitais p vazios do ligante (“backbonding”); 4) Teoria dos Orbitais Moleculares (TOM) – As ligações são consideradas como sendo essencialmente covalentes. Os ligantes fornecem elétrons que vão ocupar os orbitais σ e π ligantes, antiligantes e as vezes não-ligantes do complexo. Ligação Química nos Complexos - Prof. J. D. Ayala -2- TEORIA DE LIGAÇÃO DE VALÊNCIA (TLV) A Teoria de Ligação de Valência (TLV), é baseada na suposição que: a) os níveis eletrônicos de energia de um átomo (orbitais atômicos) são usados quando o átomo forma uma ligação com outros átomos; b) um par de elétrons ligados ocupa um orbital em cada um dos átomos simultaneamente; Para explicar a geometria conhecida dos compostos de coordenação, Pauling propôs que os orbitais atômicos da espécie central sofram hibridização, de tal forma que os novos orbitais atômicos híbridos (OAH’s) tenham a simetria do complexo. Os elétrons doados pelos ligantes ocupam esses OAH’s formados. Ligação Química nos Complexos - Prof. J. D. Ayala 1o) [Ag(CN)2]- ⇒ Linear e Diamagnético 4d Ag+ ⇒ [Kr]4d10 ⇒ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 4d ⇒ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ [Ag(CN)2]- 2o) [NiCl4]2- ⇒ Tetraédrico e Paramagnético 3d Ni2+ ⇒ [Ar]3d8 ⇒ ↑↓ ↑↓ ↑↓ ↑ ↑ 3d ⇒ ↑↓ ↑↓ ↑↓ ↑ [NiCl4]2- ↑ 5s ___ sp ↑↓ ↑↓ 4s ___ 3d ⇒ ↑↓ ↑↓ ↑↓ ↑↓ [Ni(CN)4] 5p ___ ___ ___ 5p ___ ___ 4p ___ ___ ___ sp3 ↑↓ ↑↓ ↑↓ ↑↓ 3o) [Ni(CN)4]2- ⇒ Quadrado Planar e Diamagnético 3d 4s 2+ 8 Ni ⇒ [Ar]3d ⇒ ↑↓ ↑↓ ↑↓ ↑ ↑ ___ Ni2+ no estado excitado: Ni2+ ⇒ [Ar]3d8 ⇒ ↑↓ ↑↓ ↑↓ ↑↓ ___ 2- -3- 4p ___ ___ ___ ___ ___ ___ dsp2 ↑↓ ↑↓ ↑↓ ↑↓ 4p ___ 4o) [Co(NH3)6]3+ ⇒ Octaédrico e Diamagnético (Complexo orbital interno – spin baixo) 3d 4s 4p Co3+ ⇒ [Ar]3d6 ⇒ ↑↓ ↑ ↑ ↑ ↑ ___ ___ ___ ___ Co3+ no estado excitado: Co3+ ⇒ [Ar]3d6 ⇒ ↑↓ ↑↓ ↑↓ ___ ___ ___ ___ [Co(NH3)6]3+ 3d ⇒ ↑↓ ↑↓ ↑↓ d2sp3 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 5o) [CoF6]3- ⇒ Octaédrico e Paramagnético (Complexo orbital externo – spin alto) 3d 4s 4p 4d Co3+ ⇒ [Ar]3d6 ⇒ ↑↓ ↑ ↑ ↑ ↑ ___ ___ ___ ___ ___ ___ ___ ___ ___ Co3+ no estado excitado: Co3+ ⇒ [Ar]3d6 ⇒ ↑↓ ↑ ↑ ↑ ↑ ___ ___ ___ ___ ___ ___ ___ ___ ___ [CoF6]3+ ⇒ ↑↓ ↑ ↑ 3d ↑ ↑ sp3d2 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 6o) [Co(NO2)6]4- ⇒ Octaédrico e Paramagnético em 1 e3d 4s 4p 2+ 7 Co ⇒ [Ar]3d ⇒ ↑↓ ↑↓ ↑ ↑ ↑ ___ ___ ___ ___ Co3+ no estado excitado: Co2+ ⇒ [Ar]3d7 ⇒ ↑↓ ↑↓ ↑↓ ___ ___ ___ ___ [Co(NO2)6] 4- 3d ⇒ ↑↓ ↑↓ ↑↓ d2sp3 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ 4d ___ ___ ___ 4d ___ ___ ___ ___ ___ ↑ ___ ___ ___ ___ 4d ___ ___ ___ ___ Ligação Química nos Complexos - Prof. J. D. Ayala -4- TEORIA DO CAMPO CRISTALINO (TCC) Essa teoria postula que a única interação existente entre o íon central e os ligantes é de natureza eletrostática. Os ligantes são considerados cargas ou dipolos pontuais. No modelo da TCC, a interação eletrostática metal-ligante remove parcialmente a degeneração dos cinco orbitais d, que existem no íon metálico isolado. SISTEMA OCTAÉDRICO Ligação Química nos Complexos - Prof. J. D. Ayala -5- A diferença de energia entre os orbitais eg e t2g, qualquer que seja seu valor em termos de kJ mol-1, é definida como 10 Dq ou ∆o e denomina-se desdobramento do campo cristalino. O valor numérico da energia que corresponde a 10 Dq é uma medida da força do campo eletrostático. Este valor pode ser determinado a partir de dados espectrais. ENERGIA DE ESTABILIZAÇÃO DO CAMPO CRISTALINO (EECC) Considerando o caso mais simples de um complexo com configuração d1, [Ti(H2O)6]3+, a energia necessária para promover o elétron do estado fundamental para o estado excitado, t 21 g eg0 → t 20g e1g , é por definição 10 Dq, seu valor pode ser obtido através do espectro de absorção na região do UV-VIS do composto. O espectro de absorção desta amostra revela que a transição ocorre em um máximo de 20300 cm-1, o qual corresponde a 243 kJ mol-1, portanto: 2 EECC = (1) . (- ) ∆ O 5 2 EECC = (1) . (- ) 243 kJ mol -1 5 EECC = - 97,2 kJ mol -1 Ligação Química nos Complexos - Prof. J. D. Ayala -6- Para um complexo, cuja a configuração do íon central seja d2: EECC = 2.(–0,4).∆O = -0,8 ∆O; para uma configuração d3: EECC = 3.(–0,4).∆O = -1,2 ∆O Nestes casos a regra de Hund é obedecida. Para uma configuração d4 ou d5, há, em princípio, duas alternativas: 1) a regra de Hund continua sendo obedecida e o quarto (ou quinto) elétron ocupará um orbital eg; 2) a regra de Hund deixa de prevalecer e o quarto e quinto elétrons serão emparelhados nos orbitais t2g. Estas duas alternativas estão associadas ao valor de ∆O e de P (energia necessária para forçar o emparelhamento dos elétrons em um mesmo orbital). Se ∆O < P teremos uma situação de campo fraco (spin-alto) e os elétrons ocuparão os orbitais eg. Portanto, para as configurações d4 e d5 teremos: t 23g e1g EECC = (3 x +0,4 ∆O) - ( 1 x +0,6 ∆O) = 0,6 ∆O; t 23g eg2 EECC = (3 x +0,4 ∆O) - ( 2 x +0,6 ∆O) = 0,0 ∆O; Se ∆O > P teremos uma situação de campo forte (spin-baixo) e os elétrons ocuparão os orbitais t2g. Portanto, para as configurações d4 e d5 teremos: t 24g eg0 EECC = (4 x +0,4 ∆O) – 1 P = 1,6 ∆O – P; t 25g eg0 EECC = (5 x +0,4 ∆O) – 2 P = 2,0 ∆O – 2 P; Ligação Química nos Complexos - Prof. J. D. Ayala -7- Efeito do Campo Cristalino para um Campo Octaédrico Fraco e Forte Campo Fraco Campo Forte dn Configuração No. Elétrons Desemparelhados EECC Configuração No. Elétrons Desemparelhados EECC d1 1 t 2g 1 0,4 ∆O 1 t 2g 1 0,4 ∆O d2 2 t 2g 2 0,8 ∆O 2 t 2g 2 0,8 ∆O d3 3 t 2g 3 1,2 ∆O 3 t 2g 3 1,2 ∆O d4 3 e1 t 2g g 4 0,6 ∆O 4 t 2g 2 1,6 ∆O d5 3 e2 t 2g g 5 0,0 ∆O 5 t 2g 1 2,0 ∆O d6 4 e2 t 2g g 4 0,4 ∆O 6 t 2g 0 2,4 ∆O d7 5 e2 t 2g g 3 0,8 ∆O 6 e1 t 2g g 1 1,8 ∆O d8 6 e2 t 2g g 2 1,2 ∆O 6 e2 t 2g g 2 1,2 ∆O d9 6 e3 t 2g g 1 0,6 ∆O 6 e3 t 2g g 1 0,6 ∆O d10 6 e4 t 2g g 0 0,0 ∆O 6 e4 t 2g g 0 0,0 ∆O Energia de Emparelhamento para Alguns Íons Metálicos Íon P [ kJ mol-1 (cm-1) ] d4 . d5 . d6 . d7 . Cr2+ 244,3 (20425) Mn3+ 301,6 (25215) Cr+ 211,6 (17687) Mn2+ 285,0 (23825) Fe3+ 357,4 (29875) Mn+ 174,2 (14563) Fe2+ 229,1 (19150) 3+ Co 282,6 (23625) Fe+ 211,5 (17680) Co2+ 250,0 (20800) Ligação Química nos Complexos - Prof. J. D. Ayala SISTEMA TETRAÉDRICO -8- Ligação Química nos Complexos - Prof. J. D. Ayala -9- SISTEMA TETRAGONAL (EFEITO JAHN-TELLER) Quando a distância metal-ligante, segundo o eixo z, é diferente das distâncias segundo os outros dois eixos, diz-se que o complexo sofreu uma distorção tetragonal da geometria octaédrica. d1 Sim d2 Sim d3 Não d 4 Sim (Spin Alto) Sim (Spin Baixo) d5 Não (Spin Alto) Sim (Spin Baixo) d6 Sim (Spin Alto) Não (Spin Baixo) d7 Sim (Spin Alto) Sim (Spin Baixo) d8 Não 9 Sim d Ligação Química nos Complexos - Prof. J. D. Ayala - 10 - COMPLEXO QUADRADO PLANAR NÍVEIS DE ENERGIA DOS ORBITAIS d EM DIFERENTES SIMETRIAS (valores em Dq) N.C. Estrutura dz 2 . dx2 -y2 dxy dxz dyz . . 1 Linear (ligante no eixo z) 5,14 -3,14 -3,14 0,57 0,57 2 Linear (ligantes no eixo z) 10,28 -6,28 -6,28 1,14 1,14 3 Trigonal (ligantes no plano xy) -3,21 5,46 5,46 -3,86 -3,86 Tetraédrica -2,67 -2,67 1,78 1,78 1,78 Quadrado Planar(ligantes no plano xy) -4,28 12,28 2,28 -5,14 -5,14 Bipirâmide Trigonal (base no plano xy) 7,07 -0,82 -0,82 -2,72 -2,72 Piramidal (base no plano xy) 0,86 9,14 -0,86 -4,57 -4,57 Octaédrica 6,00 6,00 -4,00 -4,00 -4,00 Prisma Trigonal 0,96 -5,84 -5,84 5,36 5,36 Bipirâmide Pentagonal 4,93 2,82 2,82 -5,28 -5,28 Cúbica -5,34 -5,34 3,56 3,56 3,56 Antiprisma Quadrado -5,34 -0,89 -0,89 3,56 3,56 9 Prisma Trigonal Triencapuzado -2,25 -0,38 -0,38 3,56 3,56 12 Icosaédrica 0,00 0,00 0,00 0,00 0,00 4 5 6 7 8 Ligação Química nos Complexos - Prof. J. D. Ayala - 11 - FATORES QUE AFETAM A MAGNITUDE DO 10 Dq Estado de Oxidação do Íon Metálico A magnitude de ∆ aumenta com o aumento da carga iônica do metal, pois este, apresentando uma carga positiva maior, atrairá os ligantes aniônicos ou polares mais fortemente, aumentando assim a interação eletrostática entre eles e os elétrons nos orbitais d. Natureza do Íon Metálico A magnitude de ∆ aumenta significativamente quando se passa de um período para outro, em uma mesma família, ou seja, 3d < 4d < 5d. Um importante resultado desta tendência é que os compostos de coordenação dos metais dos segundo e terceiro períodos da Tabela Periódica apresentam a grande facilidade de formarem complexos de spin-baixo em relação aqueles da primeira série de transição. Número e Geometria dos Ligantes A magnitude de ∆ depende do número de ligantes e se seu arranjo em torno da espécie central. Em princípio, quanto maior o número de ligantes, mais forte será o campo. Como foi visto, um complexo com geometria tetraédrica apresenta um valor de ∆t de aproximadamente 50% do valor de ∆O (de um complexo octaédrico). Natureza dos Ligantes Diferentes ligantes influenciam diferentemente no grau de desdobramento dos orbitais d. Experimentalmente, foi possível ordenar um grande número de ligantes de acordo com os valores de ∆. A série obtida recebeu o nome de Série Espectroquímica: I− < Br- < S2- < SCN- < Cl- < N3- , F- < uréia, OH- < ox, O2- < H2O < NCS- < < py, NH3 < en < bpy, phen < NO2 < CH3- , C6H5- < CN- < CO Ligação Química nos Complexos - Prof. J. D. Ayala Ligações σ e π em um Complexo Octaédrico Símbolo Orbitais do Metal Combinações de Orbitais Ligantes LIGAÇÕES σ a1g eg t1u s dx2-y2 σ1 + σ2 + σ3 + σ4 + σ5 + σ6 σ1 - σ2 + σ3 - σ4 - σ1 - σ2 - σ3 - σ4 + σ5 + σ6 d z2 px σ1 - σ3 py pz σ2 -σ4 σ5 - σ6 px πy2 + πx5 - πx4 - πy6 py πx1 + πy5 - πy3 - πx6 pz πy1 + πx2 - πx3 - πy4 dxz πy1 + πx5 + πx3 + πy6 dyz πx2 + πy5 + πy4 + πx6 dxy πx1 + πy2 + πy3 + πx4 LIGAÇÕES π t1u t2g πy1 - πx5 + πx3 - πy6 t2g -------- πx2 - πy5 + πy4 - πx6 πx1 - πy2 + πy3 - πx4 πy2 - πx5 - πx4 + πy6 t2u -------- πx1 - πy5 - πy3 + πx6 πy1 - πx2 - πx3 + πy6 - 12 - Ligação Química nos Complexos - Prof. J. D. Ayala - 13 - Ligação Química nos Complexos - Prof. J. D. Ayala - 14 - px py pz dx2-y2 dz2 dxy dyz dxz dxy dxz dyz Ligação Química nos Complexos - Prof. J. D. Ayala - 15 - Ligação Química nos Complexos - Prof. J. D. Ayala - 16 - Ligação Química nos Complexos - Prof. J. D. Ayala - 17 -
Baixar