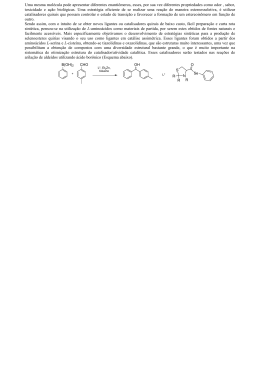
Química dos Compostos de Coordenação Prof. Dr. Élcio Barrak Universidade Federal de Itajubá Luiggi Dell’Amore Priolli Renan Rosa Martines Tiago Elias Castelo de Oliveira Yuri Lagoeiro Alvarenga 16973 16980 15985 16986 Complexos Metálicos • Definição • Compostos de coordenação • Moléculas ligantes 2/21 3/21 Uso dos Compostos de Coordenação Tornar solúveis espécies insolúveis em água Hemoglobina e o transporte de oxigênio EDTA e envenenamento por chumbo Compostos de coordenação no tratamento do câncer 4/21 Teoria de Werner 5/21 6/21 Ligação Metal-Ligante • A ligação entre um ligante e um íon metálico é um exemplo de interação entre uma base de Lewis e um ácido de Lewis. • A formação das ligações metal-ligante pode alterar profundamente as propriedades que observamos para o íon metálico. 7/21 Cargas, Números de Coordenação e Geometrias • Carga: a carga de um complexo é a soma das cargas do metal central e de seus ligantes circundantes. • Número de coordenação: é o número de átomos diretamente ligados ao átomo metálico em um complexo. 8/21 Ligantes com mais de um Átomo Doador • Ligantes monodentados: possuem um único átomo doador e são capazes de ocupar apenas um sítio em uma esfera de coordenação. • Ligantes polidentados: podem ter dois ou mais átomos doadores, podendo coordenar-se simultaneamente a um íon metálico, consequentemente ocupando dois ou mais sítios de coordenação. Estes também são chamados de agentes quelantes. 9/21 • Efeito Quelato: as constantes de formação geralmente maiores para os ligantes polidentados em comparação com os monodentados é conhecida como efeito quelato. • Os agentes quelantes são geralmente usados para prevenir uma ou mais reações possíveis de um íon metálico sem removê-lo da solução. 10/21 Exemplos de agentes quelantes, “ox”, “en”, EDTA 11/21 Aplicações • Os complexos derivados da porfina são chamados de porfirínicos e contêm diferentes íons metálicos; e têm diferentes grupos substituintes ligados aos átomos de carbono na periferia dos ligantes. • As clorofilas são porfirinas que contêm Mg(II) e são componentes-chave na conversão de energia solar em formas que podem ser usadas pelos organismos vivos. • Um método de tratar envenenamento por chumbo é administrar Na4[EDTA]. O EDTA quela-se ao chumbo, permitindo que ele seja removido do corpo pela urina. 12/21 Nomenclatura de Química de Coordenação 13/21 Se o complexo for um ânion, seu nome termina em –ato. O composto recebe o nome hexacianoferrato(II) de potássio, por exemplo, e o íon recebe o nome de íon tetraclorocobaltato(II). 14/21 Isomerismo 15/21 Cor e Magnetismo • É importante se estudar cores e propriedades magnéticas dos complexos de metais de transição para o desenvolvimento de modelos modernos para a ligação metal-ligante. 16/21 Cor • A cor de um complexo depende do elemento em particular, de seu estado de oxidação e dos ligantes unidos ao metal. • Para que um composto tenha cor ele deve absorver luz visível. A luz consiste em radiação eletromagnética com comprimento de onda variando de aproximadamente 400 até 700 nm. • Um composto absorverá radiação quando aquela radiação possuir a energia necessária para mover um elétron de seu estado de energia mais baixo para um mais excitado. 17/21 • Um objeto tem cor específica quando: 1) Ele reflete ou transmite luz daquela cor 2) Ele absorve luz da cor complementar. 18/21 Magnetismo • Muitos complexos de metais de transição exibem paramagnetismo simples. Neles, os íons metálicos individuais possuem certo número de elétrons desemparelhados. 19/21 Teoria do Campo Cristalino A Teoria de Campo cristalino é um dos modelos que explica a estrutura eletrônica e as cores de íons complexos. Ligação ente ligantes e um íon metálico, onde supõe-se que o único efeito dos ligantes seja criar um campo eletrostático em torno dos orbitais “d” do íon metálico. Energia de desdobramento de campo cristalino (∆q): É a diferença de energia entre os grupos de orbitais. A série espectroquímica relaciona os ligantes em ordem de suas habilidades de desdobrar as energias dos orbitais “d” em complexos octaédricos. Cl- < F- < H2O < NH3 < en < NO2- (ligado por N) < CN20/21 Referências Bibliográficas • T. L. Brown, H. E. LeMay Jr., B. E. Bursten e J. R. Burdge. Química: A Ciência Central, 9ª. ed.. São Paulo: Pearson, 2005. 21/21
Baixar