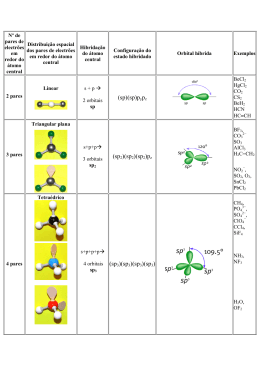
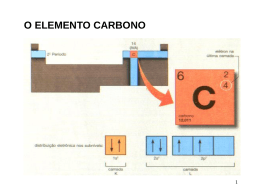
Moléculas poliatómicas: CH4 Molécula tetraédrica (4 ligações equivalentes!) OA’s não dão! (ângulos de 90º) H H C H H 109.47º H H θ θ C C θ H H H = θ C H θ = 109º 28´ H H TEV Hibridação TEV Combinações lineares de OA’s (mesmo n, R(r) semelhante) p.e.: uma orbital s e uma orbital p sp s p s+p sp sp sp sp ou, na representação simplificada s-p sp s±p redistribuição da núvem electrónica 2 orbitais sp parte-se de N OA’s → chegam-se a N orbitais híbridas 1 (Ψs + Ψ p ) Ψsp′ = 2 Ψsp′ = 1 (Ψs − Ψ p ) 2 Hibridação Se forem duas orbitais p: TEV + − + - + p±p direcção espacial da núvem electrónica É como somar vectores… Hibridações sp ( 1 Ψs ± Ψ p x 2 ) Geometria linear 2 orbitais! Hibridações sp2 y ( 1 Ψs + 2 Ψ p x 3 ) x ⎞ 1 ⎛ 1 3 ⎜ Ψs − ⎟ Ψ ± Ψ p p x y ⎟ 2 2 3 ⎜⎝ ⎠ Geometria triangular plana …não tem pz… 3 orbitais! Hibridações sp3 ( ) ( ) 1 Ψs + Ψ p x − Ψ p y − Ψ p z 2 1 Ψs + Ψ p x + Ψ p y + Ψ p z 2 ( ) ( ) 1 Ψs − Ψ p x + Ψ p y − Ψ p z 2 1 Ψs − Ψ p x − Ψ p y + Ψ p z 2 z y x Geometria tetraédrica 4 orbitais! Hibridações dsp2 1⎛ ⎜Ψs + Ψd 2 2 + 2 Ψpx ⎞⎟ x −y ⎠ 2⎝ 1⎛ ⎜Ψs +Ψd 2 2 − 2 Ψpx ⎞⎟ x −y ⎠ 2⎝ y 1⎛ ⎜Ψs −Ψd 2 2 + 2 Ψpy ⎞⎟ x −y ⎠ 2⎝ 1⎛ ⎜Ψs −Ψd 2 2 − 2 Ψpy ⎞⎟ x −y ⎠ 2⎝ …sem pz e com dx2-y2… x Geometria quadrangular plana 4 orbitais! Hibridações dsp3 ( 1 Ψs + 2 Ψ p x 3 ) ⎞ 1 ⎛ 1 3 ⎜ Ψs − Ψpx + Ψ p y ⎟⎟ ⎜ 2 2 3⎝ ⎠ z ⎞ 1 ⎛ 1 3 ⎜ Ψs − Ψpx − Ψ p y ⎟⎟ ⎜ 2 2 3⎝ ⎠ ( 1 Ψ p z + Ψd 2 z 2 ( 1 Ψ pz − Ψd 2 z 2 x ) y ) a s, as três p e mais uma d Geometria bipirâmide trigonal 5 orbitais! d2sp3 Hibridações ( 1 Ψs + 2Ψd 2 + 3Ψ p z z 6 ) ⎞ 1 ⎛ 1 3 ⎜ Ψs − Ψd 2 + Ψd x 2 − y 2 + 3Ψ p x ⎟⎟ ⎜ z 2 2 6⎝ ⎠ ⎞ 1 ⎛ 1 3 ⎜ Ψs − ⎟ Ψ − Ψ + Ψ 3 d 2 d x2 − y2 py ⎟ ⎜ z 2 2 6⎝ ⎠ ⎞ 1 ⎛ 1 3 ⎜ Ψs − Ψd + Ψd x2 − y 2 − 3Ψp ⎟ x⎟ 2 z2 2 6 ⎜⎝ ⎠ z x y ⎞ 1 ⎛ 1 3 ⎜ Ψs − ⎟ Ψ − Ψ − Ψ 3 2 2 d 2 d x −y py ⎟ ⎜ z 2 2 6⎝ ⎠ ( 1 Ψs + 2Ψd 2 − 3Ψ p z z 6 ) a s, as três p e mais duas d 6 orbitais! Geometria octaédrica Hibridações O que determina a hibridação de um “átomo central” (A)? Número de direcções independentes no espaço (em torno de A) em que existem pares de e-’s. Partilhados ou não! Será precisa uma orbital híbrida para cada direcção (i.e., para cada par de e-’s) Parte-se de igual número de OA’s CH4 TEV H H C H H Nº de direcções em torno de C = 4 Nº de orbitais híbridas = 4 Nº de orbitais atómicas de partida = 4 Quais ? Todas as de valência (só tem 4): a 2s e as três 2p (2px, 2py e 2pz) Combina-se uma orbital s com três orbitais p: obtêm-se quatro orbitais sp3. conf. electrónica do átomo isolado C 2s2 2px1 2py1 2pz0 conf. electrónica do átomo na molécula (valência) C (sp3)1(sp3)1(sp3)1(sp3)1 CH4 TEV C 2s2 2px1 2py1 2pz0 C (sp3)1(sp3)1(sp3)1(sp3)1 Promoção de um e- compensada pela formação de uma ligação H 1s1 Quatro ligações σ: (sp3)C1 – (1s)H1 1s H H sp3 H H C2H4, etileno H C H 3 direcções em torno de cada C TEV H C H C 2s2 2px1 2py1 2pz0 3 orbitais híbridas 3 orbitais atómicas de partida C (sp2)1(sp2)1(sp2)1pz1 a s (dá jeito: é esférica) e duas p sp2 Não foi usada (perpendicular ao plano das sp2) y x sp2 pz C2H4, etileno H H H C 1s1 H H C 2s2 2px1 2py1 2pz0 H H TEV H H Ligação C=C dupla: σ + π C Promoção de um e- compensada pela formação de uma ligação C (sp2)1(sp2)1(sp2)1pz1 Cada C usa as orbitais sp2 para fazer três ligações σ: duas ligações (sp2)C1 – (1s)H1 e uma ligação (sp2)C1 – (sp2)C1 As orbitais pz dos dois C orientam-se de forma a ficarem paralelas e a formarem uma ligação π: (pz)C1 - (pz)C1 z H 1s pz H C C x sp2 H H Isómeros geométricos z z Rotação impedida: quebra da ligação π Cl H C Cl µ= 0 Cl C C H trans Cl C H H cis µ = 0 C2H2, acetileno 2 direcções em torno de cada C 2 orbitais híbridas 2 orbitais atómicas de partida uma s e uma p sp H C C TEV H C 2s2 2px1 2py1 2pz0 C (sp)1(sp)1py1pz1 Não foram usadas (perpendiculares às sp) sp py pz C2H2, acetileno H C C C H 1s1 C 2s2 2px1 2py1 2pz0 Promoção de um e- compensada pela formação de uma ligação C (sp)1(sp)1py1pz1 Cada C faz duas ligações σ: (sp)C1 – (1s)H1 (sp)C1 – (sp)C1 z pz 1s sp H C y C x sp py H TEV H H Ligação C≡C tripla: σ + 2π e duas ligações π: (py)C1 – (py)C1 (pz)C1 – (pz)C1 C H C H H C C H H H H C H H C H H -1 H Energia de Ligação (kcal mol ) Multiplicidade da ligação C–C 200 150 100 50 1.1 1.2 1.3 1.4 1.5 1.6 Comprimento de Ligação (Å) Molécula Tipo de ligação Energia de ligação Comprimento da C-C / kcal mol-1 ligação C-C /Å C2H6 σ 83,1 1,54 C2H4 σ, π 148 1,34 C2H2 σ, 2π 194 1,20 Ligações π mais fracas que ligações σ Direccionalidade das orbitais híbridas Aumenta com o carácter s das orbitais híbridas Orbitais sp: 50% de s + > direccionalidade > densidade electrónica > > coalescência → ligações + fortes! Molécula Hibridação Energia da ligação Distância C-H / kcal mol-1 Internuclear C-H /Å H-C≡C-H sp ~121 1,06 H2C=CH2 sp2 ~106 1,07 CH4 sp3 98 1,09 Radical CH ~p ~80 1,12 Electronegatividade de orbital Electronegatividade O Aumenta com % carácter s das orbitais híbridas 4,0 N C 3,0 2,0 0 sp3 sp2 20 40 sp 60 80 % de carácter s Ex.: “Acidez” de alcinos terminais: R C C (pKa(C2H2) = 25) H + NaNH2 R C C Na + NH3 H2O H 1s1 O 2s2 2px2 2py1 2pz1 O (sp3)2(sp3)2(sp3)1(sp3)1 Duas ligações σ: (sp3)O1 – (1s)H1 TRPECV: 4 pares de e-’s em volta do O (2×1 + 6)/2 Dois pares de e-’s não partilhados: (sp3)O2 Geometria tetraédrica pares não partilhados (pares de e-’s) 4 direcções com pares de e-’s sp3 H H H2O Molécula polar pares não partilhados µ H H NH3 H 1s1 N 2s2 2px1 2py1 2pz1 N (sp3)2(sp3)1(sp3)1(sp3)1 Três ligações σ: (sp3)N1 – (1s)H1 TRPECV: 4 pares de e-’s em volta do N (3×1 + 5)/2 Um par de e-’s não partilhados: (sp3)N2 Geometria tetraédrica (pares de e-’s) H 4 direcções com pares de e-’s sp3 par não-partilhado 1s sp3 H H NH3 Molécula polar µ resultante H µ par não partilhado N θ = 107º sp3 H H par não-partilhado 1s H H S P −1 = cos θ = S −1 P 69% p e 31% s S % de s P % de p 70% p e 30% s H H N C H H 109.47º sp3 “pura”: 75% p e 25% s H 107º H H 77% p e 23% s O H H 104.5º 80% p e 20% s
Baixar