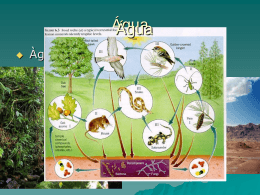
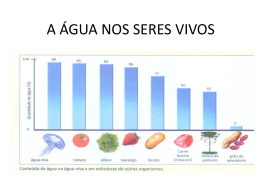
A química da célula Paula Costallat Cantão A química da célula Avanços da Química = séculos XIX e XX. Biólogos e Químicos Mundo submicroscópico (funcionamento da célula – átomos e moléculas) Bioquímica: ramo das ciências naturais que estuda a química da vida Componentes da matéria viva 1. Elementos químicos predominantes 2. Tipos de ligações químicas 3. Substâncias Orgânicas: - Proteínas - Lipídios - Glicídios - Ácidos Nucléicos 4. Sais Minerais 5. Água Elementos químicos predominantes Matéria Orgânica: matéria que forma os seres vivos. Presença constante de certos elementos químicos: 98% da massa corporal da maioria dos seres vivos: CHONPS Carbono Hidrogênio Oxigênio Enxofre Fósforo Nitrogênio 2% restantes: elementos químicos diversos (Ca, Fe, Zn, Na, ...) Tipos de Ligações Químicas Natureza = átomos dos elementos químicos = unidos (raramente isolados) Unidos = Ligações Químicas = Formando substâncias que constituem os seres vivos = Substâncias Orgânicas Substâncias Orgânicas: Proteínas, Lipídios, Glicídios e Ácidos Nucleicos. Ligações Químicas: Covalentes e Iônicas. Tipos de Ligações Químicas Ligação Covalente Átomos unem-se através do compartilhamento de pares de elétrons, formando moléculas. As moléculas de todas as substâncias orgânicas apresentam esse tipo de ligação. Tipos de Ligações Químicas Ligação Iônicas Atração de íons de cargas elétricas opostas. Transferência de um ou mais elétrons de um átomo para o outro. Átomo que cede: carga elétrica positiva (Cátion) Átomo que recebe: carga elétrica negativa (Ânion) Cátions e ânions: Íons Substâncias Orgânicas Formadas por átomos de carbono unidos em sequência. Cadeias carbônicas: • Constituem o “esqueleto” básico da molécula orgânica; • Ligam dezenas e até milhares de átomos; • Ligam átomos de outros elementos químicos (principalmente H, O, e N); • Versatilidade do carbono: torna possível a vida em nosso planeta (grande variedade de moléculas orgânicas). Cadeias Carbônicas Cadeias Carbônicas Ligações Químicas Composição da matéria viva Substâncias Orgânicas: 15 a 25% da massa de qualquer ser vivo Proteínas: 10 a 15% Lipídios: 2 a 3% Glicídios: 1% Ácidos Nucléicos: 1% Água: 75 a 85% Sais Minerais: 1% Ex: pessoa de 60 Kg = desidratada = 12 Kg de substância orgânicas 0,500 g sais minerais Sais Minerais Substâncias inorgânicas formadas por íons. Enquanto as vitaminas são perecíveis, os minerais ficam até mesmo depois da morte: voltam à terra, onde penetram nas plantas que comemos, reiniciando seu ciclo em nossas vidas. Os elementos minerais são aqueles componentes dos tecidos animais e vegetais que constituem as cinzas ou seja, o resíduo que fica depois de haver queimado a parte orgânica da matéria viva. Os elementos minerais assim como a água e as vitaminas não aportam energia ao organismo, mas se encontram no organismo desempenhando uma ou várias funções. Como componentes dos alimentos, os minerais, além de sua importância fisiológica, participam no sabor, ativam ou inibem a catálise enzimática e outras reações que influem na textura dos alimentos. Classificação dos Sais Minerais Segundo a participação dos elementos na constituição das cinzas, podemos classificar os minerais em: MACROELEMENTOS: São os elementos principais: C, H, O, N, P, S, Na, K, Ca, Mg, ... MICROELEMENTOS: São os elementos menores, também chamados oligoelementos: Fe, Zn, Cu, Co, F, Cr, Mn, Mo, Se, ... OBS.: A quantidade em que um elemento mineral está presente no organismo não é um índice de sua importância funcional, assim o Cobre, o Zinco e o Iodo, que se encontram em pequena quantidade, desempenham funções vitais essenciais ao nosso organismo. Alguns Sais Minerais Pirâmide Alimentar Pirâmide Alimentar Sais Minerais como reguladores Para regular o equilíbrio ácido-base, a excitabilidade neuromuscular e para manter e regular propriedades físicas da matéria orgânica (viscosidade, pressão osmótica), os sais minerais são de suma importância. pH (potencial hidrogeniônico): - Concentração relativa de íons H+ - Corresponde ao nível de acidez de um meio; - Extremamente importante para o funcionamento dos seres vivos; - Muitas reações químicas essenciais à vida só ocorrem se esse potencial estiver favorável; - pH fisiológico = 7 Ex: certos íons regulam a concentração de íons de H+ no meio celular, ou seja, neutralizam íons de H+ em excesso. Escala Logarítmica do pH ÁGUA E OS SERES VIVOS Solvente Universal Dissolve (separa) = Grande variedade de substâncias químicas: Sais Gases Glicídios Aminoácidos Proteínas Ácidos Nucléicos Possuem cargas elétricas em suas moléculas ÁGUA E OS SERES VIVOS H2O Polo + e - Substâncias que interagem Eletricamente polarizada Atua como um Pequeno imã Moléculas com cargas elétricas Água como solvente Ponto de vista químico: dissolver consiste em separar, por meio de um solvente, os agregados ou cristais que formam determinada substância. Substâncias Hidrofílicas (hidro = água; philos = amigo) Ex: sal ou açúcar = copo com água = moléculas se misturam = dissolvendo a união Água como solvente Água = solvente Solução Aquosa Substância dissolvida = soluto Água como solvente Soluções aquosas: Citosol Solutos: glicídios, proteínas, sais minerais, etc... Sangue Água como solvente Substâncias Hidrofóbicas (hidro = água; phobos = medo) Substâncias Apolares Gorduras Moléculas sem cargas elétricas não dissolvem em H2O Não interagem Água como solvente Para limpar as mãos sujas de graxa, utiliza-se a gasolina, pois ambas são substâncias orgânicas apolares Água nas reações químicas Reação química: transformação de uma ou mais moléculas (reagentes), em moléculas de outra ou outras substâncias (produtos). Água nas reações químicas Reagente: reações de hidrólise (hydro = água; lise = quebra), quebra pela água. Ex: reação de digestão (tubo digestório). Água nas reações químicas Produto: reações de condensação ou síntese por desidratação (união de moléculas). Ex: aminoácidos de compõem as proteínas. FIM!
Baixar