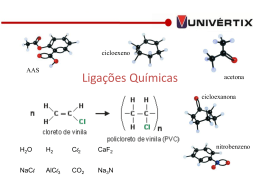
QUÍMICA GERAL LIGAÇÕES QUÍMICAS Prof. Sérgio Pezzin As ligações químicas e a energia eletrônica Uma ligação química entre dois átomos é formada se o sistema resultante é mais éável (tem uma energia mais baixa) que aquee com os dois átomos separados. distância de equilíbrio Comprimento da ligação ro = 74 pm 2 átomos de H Etot = 2 x EH EH2 < 2x EH distância internuclear Ediss = EH2 - 2x EH Ediss: energia de dissociação energia de ligação EH2 = 436 kJ/mol molécula H 2 Etot = EH2 As ligações químicas e a energia eletrônica Uma ligação pode ser dos seguintes tipos: - por uma transferência completa de um ou mais elétrons: ligação iônica - se dois átomos compartilham 2 elétrons (cada átomo contribui com um): ligação covalente - se dois átomos compartilham 2 elétrons (um contribui com 2 e outro com 0): ligação covalente coordenada - Se todos os átomos compartilham os elétrons entre eles: ligação metálica As ligações químicas e a érutura eletrônica des átomos 1. As ligações químicas são devidas às configurações dos elétrons de valência dos átomos. 2. A estrutura eletrônica de um átomo é dada por sua posição na tabela periódica. ═> pode-se prever o tipo de ligações químicas que são formadas por um átomo de pela sua posição na tabela periódica. As propriedades químicas de um átomo são dadas por sua posição na tabela periódica As diferenças de eletronegatividade A capacidade relativa dos átomos de atrair os elétrons de uma ligação química é chamada de eletronegatividade. atração relativa de cada átomo O átomo B tem maior eletronegatividade As diferenças de eletronegatividade (EN) Considere dois átomos A e B, com três possibilidades diferentes: • 1o caso: um dos átomos tem uma grande tendência de doar elétrons e outro uma grande tendência de aceitá-los, lDENABl >> 0 ‘ligação iônica’ • 2o caso: os dois átomos tendem a aceitar elétrons (ENs altas e comparáveis) eles compartilham dois elétrons ‘ligação covalente’ lDENABl 0 (ligação covalente não polar); lDENABl > 0 (ligação covalente polar) • 3o caso: os dois átomos tendem a doar elétrons (têm EN baixa) vários átomos doam seus elétrons de valência formando um mar de elétrons que são compartilhados por todos os átomos lDENABl 0 (e EN baixas) ‘ligação metálica’ Quiz 1) Que tipo de ligação química ocorre entre dois átomos de cloro? A) iônica B) covalente C) metálica 2) Que tipo de ligação é formada se um átomo de iodo e um átomo de potássio se encontram? A) iônica B) covalente C) metálica 3) Que tipo de ligação química é presente na molécula Al2? A) covalente B) iônica C) metálica 4) Que tipo de ligação química é presente no alumínio sólido ? A) covalente B) iônica C) metálica Quiz (continuação) 5) Que tipo de ligação química é presente no composto BaCl2? A) iônica B) covalente C) metálica 2) Que tipo de ligação química é presente na molécula O3 (ozônio)? A) iônica B) covalente C) metálica 3) Que tipo de ligação química ocorre na molécula CsAu? A) covalente B) iônica C) metálica 4) Que tipo de ligação química é presente no composto CuSn? A) covalente B) iônica C) metálica A ligação iônica: transferência completa de elétrons DENAB >>0 (entre metais e não-metais) Reação de alumínio (EN = 1.5) com bromo (EN = 2.8) (DEN = 1.3): 2Al + 3Br2 → 2Al3+Br-3 cristais iônicos NaCl MgAl2O4 Cu2CO3(OH)2 Cristalogênese MnCO3 CaF2 Al2O3 + Cr Energias associadas à formação de compostos iônicos Na+(g) + Cl(g) + eDHAE= -349 kJ/mol DHI= +496 kJ/mol Na+(g) + Cl-(g) Na(g) + Cl(g) DHD= +122 kJ/mol Na(g) + ½ Cl2(g) DHER= -787 kJ/mol DHs= +107 kJ/mol Na(s) + ½ Cl2(g) DHf = DHs + DHD + DHI + DHAE +DHER DHf = -411 kJ/mol (exotérmica) DHf NaCl(s) Ciclo de Born-Haber para 1 mol de NaCl A energia de retículo q1 q2 6 12 8 6 E 4 0 r r 2 r 3 r 4 R M 6 Na+ 12 2 r 8 3 6 4 Cl- NaCl r: distância Na+- Clq1: carga do cátion (q1 = +1e) q2: carga do ânion (q2 = -1e) 0: constante dielétrica do vácuo M: constante de Madelung (fator geométrico do retículo) M(NaCl) = 1.74756 E R q1 q2 4 0 r M Energia de retículo Retículos Cristalinos Um sólido cristalino é constituído pela repetição periódica (3 D) de uma estrutura atômica, iônica ou molecular, chamada de célula unitária. A periodicidade da estrutura de um cristal é representada por um conjunto de pontos dipostos regularmente. Este conjunto se chama retículo cristalino. Tipos de células unitárias primitiva (P) centrada (I) face centrada (F,C) Os 14 retículos cristalinos de Bravais cúbico tetragonal ortorrômbico romboédrico monoclínico triclínico As estruturas compactas Átomos estão arranjados o mais densamente possível. São caracterizadas por números de coordinação altos (CN = 12). Hexagonal compacta (hcp) sequência: ABABAB... Cúbica compacta (fcc) sequência: ABCABC.. Sólidos iônicos arranjo de esferas cúbico compacto rcation um pouco maior → contato cátionsânions máximo o cátion ocupa um sítio cúbico CNcation = 8 ranion/rcation > 0.73 Sítios intersticiais Sítio cúbico CNcation = 8 ranion/rcation > 0.73 Cátions grandes Sítio octaédrico CNcation = 6 ranion/rcation > 0.414 cátions médios Sítio tetraédrico CNcation = 4 ranion/rcation > 0.225 cátions pequenos As estruturas dos sólidos iônicos Compostos do tipo MX tipo cloreto de césio Retículo cúbico simples, cátions em sítio cúbico (CNcation = CNanion = 8 R > 0.73) CsCl, CsBr, CsI, NH4Cl etc.. tipo cloreto de sódio Retículo cúbico de face centrada, cátions em sítio octaédrico (CNcation = CNanion = 6, R > 0.414) NaCl, KBr,RbI, MgO,CaO, AgCl etc.. As estruturas dos sólidos iônicos Compostos do tipo MX tipo ZnS (esfalerita) Retículo cúbico de face centrada, cátions no ½ dos sítios tetraédricos (CNcation = 4, R > 0.225) ZnS, CdS,HgS etc.. Compostos do tipo MX2 tipo TiO2 (rutilo) Retículo cúbico tetragonal, cátions em sítios octaédricos (CNcation = 6, R > 0.414) TiO2,MnO2,SnO2,MgF2,ZnF2, etc.. Quanto mais próximos rcation e ranion, mais compacta a estrutura. entalpias reticulares a 25◦C E R q1 q2 4 0 r M Propriedades dos compostos iônicos - interações atrativas com água (hidrófilos) + - - em solução: conduz eletricidade
Baixar