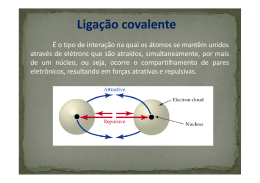
Ligações Química Bruno Santana lima Ligações Químicas Compostos Iônicos e Moleculares A união de átomos formam diversas substâncias, essa união (ligação química) pode ocorrer de três formas: ligação iônica; ligação covalente simples e dativa; ligação metálica. Os gases nobres são elementos estáveis, pois apresentam oito elétrons na sua camada de valência, exceção do gás hélio. Ligação Iônica Ocorre entre metal que tem tendência de perder elétron, com não-metal, que tem tendência de receber elétron, formando íons de cargas contrárias, que se atraem mutuamente. Exemplos Fazer o esquema de Lewis: Íon Fórmula Conhecendo as valências dos elementos cujos átomos vão se ligar para formar um composto iônico, podemos calcular a íon fórmula: Escrevemos os símbolos na ordem crescente de eletronegatividade, de modo que o índice corresponda à valência do outro (regra de 3): Cuidado Ligação Covalente Simples Ocorre entre não-metais, e entre não-metal e hidrogênio, e seu princípio é o compartilhamento de elétrons. O conjunto estável de átomos ligados entre sí apenas por ligações covalentes, ou seja por pares eletrônicos, recebe o nome de molécula. Exemplos Ligação Covalente Dativa Só ocorre se o átomo que vai contribuir com o par de elétrons estiver estabilizado pela covalente simples e tiver pares eletrônicos disponíveis: Ligação Covalente Ligação Covalente Apolar Ocorre entre ametais de mesmo elemento químico (solúveis em água) (mesma eletronegatividade). Por exemplo: . Ligação Covalente Polar Ocorre entre ametais de elementos diferentes (insolúveis em água) (eletronegatividade diferentes). Exemplo: molécula , pois o cloro é mais eletronegativo que o hidrogênio, ou seja, apresenta maior capacidade de atrair elétrons; portanto o par de elétrons da ligação é atraído por ele, criando-se nesse extremo uma maior densidade eletrônica. Assim, surgem pólos distintos (representado pela letra ) , formando uma ligação covalente polar: Ligações metálicas As ligações metálicas diferentemente das iônicas e covalentes, não têm representação eletrônica e sua representação estrutural depende de um conhecimento mais profundo dos retículos cristalinos. Os metais, em geral são representados por seus símbolos, sem indicação da quantidade de átomos envolvidos, que é muito grande e indeterminada. Propriedades dos metais Nos retículos cristalinos dos metais, cada átomo está circundado por 8 ou 12 outros átomos, isto é, apresentam elevado número de coordenação. Como o conjunto é formado por átomos do mesmo elemento, as atrações são iguais em todas as direções. Uma lamina, barra ou fio de cobre é constituído por inúmero cátions de cobre cercados por um "mar" de elétrons, sendo o agregado representado apenas por Cu, que é o símbolo do elemento e assim sucessivamente. Além disso os metais apresentam certas propriedades tais como a capacidade de se transformar em fios, chamada de ductibilidade , a capacidade de se transformar em lâminas, maleabilidade. Formação de ligas metálicas Ligas metálicas: materiais com propriedades metálicas que contém dois ou mais elementos sendo que pelo menos um deles é metal. As ligas possuem propriedades diferentes dos elementos que a origina. Algumas propriedades são tais como diminuição ou aumento do ponto de fusão, aumento da dureza , aumento da resistência mecânica. ligas metálicas mais comuns no cotidiano: Aço - constituído por Fe e C. Aço inox - constituído por Fe , C , Cr e Ni. Ouro de jóias - constituído por Au, Ag e ou Cobre. Amálgama dental (utilizada em obturação)constituído por Hg , Ag e Sn . Latão (utilizado em armas e torneiras)constituído por Cu e Zn. Entre tantas outras ligas existentes.
Baixar