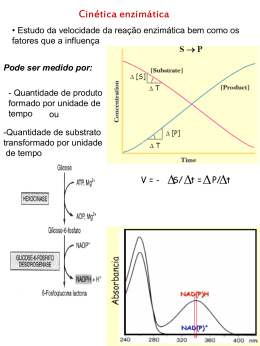
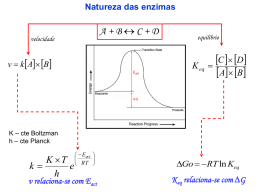
Dependente da ocorrência de um Conjunto de reações químicas: 1- devem ocorrer em velocidades adequadas à fisiologia celular 2- têm de ser altamente específicos, para produzir produtos específicos ENZIMA do Lat. “en”, dentro + “zyme”, fermento s. f., Bioquím., molécula de origem biológica, produzida por células vivas, que aumenta a velocidade de uma reação bioquímica específica, atuando como catalisador orgânico; fermento. CATALISADOR adj. e s. m., Quím., substância que tem a propriedade de acelerar ou retardar a velocidade de uma reação química sem se alterar no decorrer deste processo; o que provoca a catálise. ♣ Enzimas são proteínas com atividade catalítica. Praticamente todas as reações que caracterizam o metabolismo celular são catalisadas por enzimas. ♣ As enzimas são, portanto, consideradas as unidades funcionais do metabolismo celular. ♣ Participam da transformação de um tipo de energia em outro. • Como catalisadores celulares extremamente poderosos, as enzimas aceleram a velocidade de uma reação sem, no entanto, participar dela como reagente ou produto. • As enzimas atuam ainda como reguladoras de conjuntos complexos de reações. Têm a capacidade de se ligar especificamente a uma ampla gama de moléculas Nome Recomendado: Mais curto e utilizado no dia a dia de quem trabalha com enzimas; Utiliza o sufixo "ase" para caracterizar a enzima. Exs: Urease, Hexoquinase, Peptidase, etc. Nome Sistemático: Mais complexo, nos dá informações precisas sobre a função metabólica da enzima. Ex: ATP-Glicose-Fosfo-Transferase Nome Usual: Consagrados pelo uso; Exs: Tripsina, Pepsina, Ptialina. SUBSTRATO + (SUFIXO) ASE Glicosidase Urease Sacarase Nome originais: Quimiotripsina Pepsina AÇÃO QUE ELA REALIZA + (SUFIXO) ASE Lactato Desidrogenase Adenilato Ciclase Piruvato Decarboxilase Piruvato Carboxilase AÇÃO QUE ELA REALIZA + (SUFIXO) ASE Diagrama mostrando a variação de energia livre em função do caminho de uma reação espontânea hipotética. Na presença do catalisador, a reação ocorre por um caminho alternativo com energia de ativação (Ea) menor (substratos) Lehninger Principles of Biochemistry, Third Edition Alteração da distribuição de energia entre as moléculas de uma população que se encontram em uma temperatura T1 (a) por aumento da temperatura (T2˃T1 ) (b) e pela presença de um catalisador (c). A área colorida representa a fração da população com energia igual ou maior a energia de transição. Lehninger Principles of Biochemistry, Third Edition Lehninger Principles of Biochemistry, Third Edition • 1-Oxidorredutases: São enzimas que catalisam reações de transferência de elétrons, ou seja: reações de oxi-redução. São as Desidrogenases (redutases) e as Oxidases AH2 + B ↔ A + BH2 • 2-Transferases: Enzimas que catalisam reações de transferência de grupamentos funcionais como grupos amina, fosfato, acil, carboxil, etc. Como exemplo temos as Quinases (grupos fosfato) e as Transaminases A- X +B ↔ A+B-X • 3-Hidrolases: Catalisam reações de hidrólise de ligação covalente. Ex: As peptidades A- B + H2O ↔ A - H+ B – OH 4-Liases: Catalisam a quebra de ligações covalentes e a remoção de moléculas de água, amônia e gás carbônico. Em geral há remoção de grupamentos químicos. As Dehidratases e as Descarboxilases são bons exemplos. X Y A= B+X -Y↔ A–B • 5-Isomerases: Catalisam reações interconversão entre isômeros ópticos geométricos. As Epimerases são exemplos. de ou A_B↔A_B X Y Y X • 6-Ligases: Catalisam reações de formação de novas moléculas a partir da ligação entre duas já existentes, sempre às custas de energia (ATP). São as Sintetases. A+B ↔A_B ♣ São catalisadores eficientes biológicos extremamente ♣ Aceleram em média 103 a 1012x a velocidade da reação, transformando de 100 a 1000 moléculas de substrato em produto por segundo de reação (turnover) ♣ Atuam em concentrações muito baixas ♣ Atuam em condições temperatura e pH específicas de ♣ Possuem todas as características das proteínas ♣ Podem ter sua atividade regulada ♣ Estão quase sempre dentro da célula, e compartimentalizadas (lisossomos, mitocôndrias, citoplasma, núcleo, retículo endoplasmático). ♣ Altamente específicas Aceleram reações químicas Catalase H2O2 Ex: Decomposição do H2O2 Condições da Reação Sem catalisador Enzima Catalase H2O + O2 (Peróxido de hidrogênio = amônia) Energia livre de Ativação KJ/mol Kcal/mol Velocidade Relativa 1 75,2 18,0 48,9 11,7 2,77 x 104 23,0 5,5 6,51 x 108 Atuam em pequenas concentrações 1 molécula de Catalase decompõe 5 milhões de moléculas de H2O2 pH = 6,8 em 1 min Não alteram o estado de equilíbrio • Abaixam a energia de ativação; • Keq não é afetado pela enzima (equilíbrio químico) Energia de ativação sem enzima Diferença entre a energia livre de S e P S P Energia de ativação com enzima Caminho da Reação ♣ Cofatores são pequenas moléculas orgânicas (não protéicas), denominadas coenzimas (geralmente derivadas de vitaminas. Ex: NAD e FAD, Côa), ou inorgânicas (Zn, Fe, Mg) necessárias para a função de uma enzima. ♣ Estes cofatores não estão ligados permanentemente à enzima, mas, na ausência deles, a enzima é inativa (molibdênio) • A fração protéica de uma enzima, na ausência do seu cofator, é chamada de APOENZIMA ♣ Enzima + Cofator, chamamos de HOLOENZIMA ♣ HOLOENZIMA = ENZIMA + COFATOR ♣ APOENZIMA = PORÇÃO PROTÉICA DA HOLOENZIMA (SEM COFATOR) ENZIMAS – SÍTIO ATIVO Região da molécula enzimática que participa da reação com o substrato. Pode possuir componentes não protéicos:cofatores. Possui aminoácidos auxiliares e de contato. Porção protéica Cofator APOENZIMA HOLOENZIMA ENZIMAS – COENZIMAS Maioria deriva de vitaminas hidrossolúveis Classificam-se em: - transportadoras de hidrogênio - transportadoras de grupos químicos Transportadoras de hidrogênio Coenzima Abreviatura Reação Origem catalisada Nicotinamida adenina NAD+ Oxi-redução Niacina ou dinucleotídio Nicotinamida adenina NADP+ dinucleotídio fosfato Flavina adenina FAD dinucleotídio Vitamina B3 Oxi-redução Niacina ou Vitamina B3 Oxi-redução Riboflavina ou Vitamina B2 ♣ As enzimas são muito específicas para os seus substratos ♣ Esta especificidade se deve à existência, na superfície da enzima de um local denominado SÍTIO DE LIGAÇÃO DO SUBSTRATO ♣ O sítio de ligação do substrato de uma enzima é dado por um arranjo tridimensional especial dos aminoácidos de uma determinada região da molécula, geralmente complementar à molécula do substrato, e ideal espacial e eletricamente para a ligação do mesmo. ♣ Este sítio pode conter um segundo sítio, chamado SÍTIO CATALÍTICO ou SÍTIO ATIVO, ou estar próximo dele; é neste sítio ativo que ocorre a reação enzimática. Mudança da conformação da enzima induzida pela ligação com o substrato. O exemplo mostra a hexoquinase antes (a) e depois (b) de se ligar ao substrato, a glicose. A molécula da enzima consta de dois domínios, que se aproximam, encaixando o substrato. ♣ Modelo Chave/Fechadura = Prevê um encaixe perfeito do substrato no sítio de ligação, que seria rígido como uma fechadura. ♣ Modelo do Ajuste Induzido = Prevê um sítio de ligação não totalmente pré-formado, mas sim moldável à molécula do substrato; a enzima se ajustaria à molécula do substrato na sua presença. ♣ O substrato liga-se (em geral não covalentemente) ao sítio ativo formando um complexo enzima-substrato, que posteriormente é convertido a enzima-produto, que se dissocia em enzima e produto. ♣ As enzimas aceleram a velocidade de uma reação por diminuir a ENERGIA LIVRE DE ATIVAÇÃO; ♣ Para se superar a energia de ativação de uma reação, passa-se pela formação de um estado intermediário chamado "Estado de Transição", sempre um composto instável e de alta energia ligado com altíssima afinidade ao sítio catalítico. ou substratos ENZIMAS – COMPONENTES DA REAÇÃO E+S ES Substrato se liga ao SÍTIO ATIVO da enzima P+E E = Enzima S = Substrato P = Produto ♣ A cinética de uma enzima é estudada avaliando-se a quantidade de produto formado ou a quantidade de substrato consumido por unidade de tempo de reação. ♣ Uma reação enzimática pode ser expressa pela seguinte equação: E + S <==> [ES] ==> E + P ♣ A velocidade de uma reação enzimática depende das concentrações de ENZIMA e temperatura e pH, dentre outros. de SUBSTRATO, ♣ pH; ♣ temperatura; ♣ concentração das enzimas; ♣ concentração dos substratos; ♣ presença de inibidores. ♣ Temperatura = Quanto maior a temperatura, maior a velocidade da reação, até se atingir a TEMPERATURA ÓTIMA; a partir dela, a atividade volta a diminuir, por desnaturação da molécula. ♣ pH = Idem à temperatura; existe um pH ÓTIMO, onde a distribuição de cargas elétricas da molécula da enzima e, em especial do sítio catalítico, é ideal para a catálise (ESTÔMAGO). ♣ Concentração do substrato = [S] varia durante o curso da reação à medida que S é convertido em P. Representação do conteúdo energético das moléculas de uma população em duas temperaturas, sendo T2˃T1 Quando se eleva a temperatura de um sistema, as moléculas, no seu conjunto, adquirem um conteúdo energético maior, mas é respeitado o mesmo padrão de distribuição de energia entre elas. Lehninger Principles of Biochemistry, Third Edition ♣ Inibidores são compostos que podem diminuir a atividade de uma enzima. ♣ A inibição enzimática pode ser reversível (ligação não covalente) ou irreversível (ligação covalente). ♣ Existem 2 tipos de inibição enzimática reversível: – Inibição Enzimática Reversível Competitiva – Inibição Enzimática Reversível Não-Competitiva Qualquer substância que reduz a velocidade de uma reação enzimática. INIBIDORES REVERSÍVEIS COMPETITIVOS IRREVERSÍVEIS NÃO COMPETITIVOS ♣ Quando o inibidor se liga reversivelmente ao mesmo sítio de ligação do substrato; ♣ Quando o inibidor liga-se reversivelmente à enzima em um sítio próprio de ligação, podendo estar ligado à mesma ao mesmo tempo que o substrato; ♣ Este tipo de inibição depende apenas da concentração do inibidor. Permitem às indústrias usarem processos mais econômicos, diminuindo o consumo de energia e recursos; mais confiáveis e que poluem menos. São eficientes; Muito específicas; ENZIMA Origem vegetal Origem animal Origem microbiana FONTE APLICAÇÃO Papaína mamão Ajuda na digestão, Médica, bebidas, carnes Bromelina abacaxi Ajuda na digestão, Médica, bebidas, carnes Diastase malte Pepsina mucosa gástrica suíno Amaciamento de carne Lipase Candida rugosa Tratamento de efluentes Panificação, xarope Enzima e fonte Poluentes e efluentes Azorredutase (Pseudomonas luteola) Indústria de tinta Catalase (Baccilus sp.) Remoção de H2O2 presente em efluentes de branqueamento de tecidos -glicosidase e Manganês peroxidase Remoção de corantes na industria de alimentos e da industria têxtil Polifosfatase e Fosfotransferase Remoção de fosfato biológico de efluentes Protease pronase (Pseudomonas aeruginosa) Inativação de vírus bacteriófago Cox A9 de efluentes, para reutilização da água Naftaleno-dioxigenase Remoção de naftaleno Lipase Redução do teor de lipídeos de efluentes de indústrias
Baixar