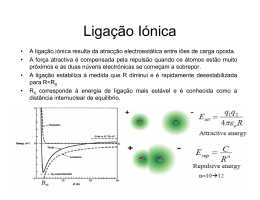
IPT Química 1 Ligação Química João Luís Farinha Antunes Escola Superior de Tecnologia de Tomar Departamento de Arte, Conservação e restauro 1 Sumário Tabela periódica Tendências na tabela periódica Interacção entre átomos de diferentes grupos da tabela periódica Ligação iónica Ligação covalente Ligação metálica Compostos iónicos e covalentes 2 1 Tabela periódica metais Não metais Grupo 1 Grupo 18 Metais alcalinos Gases raros 2He 2 10Ne 2;8 18Ar 2;8;8 36Kr 2;8;18;8 … … 11Na 2;8;1 19K 2;8;8;1 … Grupo 2 Metais de transição Metais alcalino-terrosos … 12Mg 2;8;2 2;8;8;2 20Ca … 9F 17Cl 35Br … Grupo 17 Halogéneos 2;7 2;8;7 2;8;18;7 3 1 2 17 Tendências na tabela periódica 18 Grupo 18 Grupo 1 Grupo 2 Grupo 17 Metais alcalinos … Metais alcalino-terrosos Halogéneos Gases raros 2He 11Na 2;8;1 2;8;8;1 19K … … 12Mg 2;8;2 20Ca 2;8;8;2 … 9F 2;7 17Cl 2;8;7 35Br 2;8;18;7 … Tendem a perder Tendem a perder Tendem a ganhar 1 electrão 2 electrões 1 electrão 11Na + 19K + 2;8 2;8;8 2+ 2;8 2+ Ca 2;8;8 - 12Mg 9F 20 17Cl - 2;8 2;8;8 10Ne 18Cl … 2 2;8 2;8;8 Os gases raros são muito estáveis devido a terem os seus níveis de energia preenchidos. Os outros elementos reagem de forma a terem os seus níveis preenchidos 4 2 Interacção entre 2 átomos A interacção entre dois átomos isolados ocorre pelos electrões de valência (os mais exteriores e de maior energia). A interacção pode ocorrer Entre dois átomos de metais (A na figura), ambos electropositivos Entre dois átomos de não-metais (B na figura), ambos electronegativos Entre um átomo de um metal e outro de um não metal (A e B), um átomo electronegativo e outro electropositivo Não metais B A Metais 5 Formação de uma ligação química B Entre um metal e um não metal Na Ex 11Na + Cl A 17Cl Na Cl Na+ Cl- 2;8;1 2;8;7 2;8 2;8;8 O cloro tende a ganhar 1 electrão O sódio tende a perder 1 electrão O electrão transfere-se do sódio para o cloro. Formam-se dois iões: Na+ e Cl- A ligação entre os dois átomos deve-se aos iões formados que se atraem mutuamente, porque têm cargas de sinal contrário. A este tipo de ligação chama-se ligação iónica 6 3 Ligação íónica (cont.) Composto formado Outros exemplos de ligações iónicas MgO K2O CaCl2 7 Formação de uma ligação química (cont.) B Cl Entre átomos de não metais Ex 17Cl + 17Cl Ambos tendem a guardar os electrões, e ambos tendem a ter o seu último nível preenchido 17Cl 2;8;7 Cada átomo cede 1 electrão para partilhar e emparelhar com o electrão do outro Forma-se a molécula Cl-Cl (Cl2) A ligação entre os dois átomos deve-se à presença dos dois electrões partilhados entre os dois átomos, que leva a uma atracção entre os protões dos átomos A este tipo de ligação chama-se ligação covalente 8 4 Ligação covalente (outros exemplos) 1H 8O - 1 - 2;6 1H - 1 14Si - 2; 8;4 6C - 2;4 1H - 1 9 Exemplos de moléculas pequenas, formadas por átomos ligados por covalência 10 5 Ligação covalente – ligação iónica átomos átomos Partilha de electrões molécula Ligação covalente Transferência de electrões Ião positivo Ião negativo Ligação iónica 11 Compostos iónicos – compostos covalentes Cl2 (sólido) NaCl Na+Cl•Todos os compostos iónicos formam cristais; •Tendem a ter pontos de fusão e ebulição muito altos; •Tendem a não formar cristais •Tendem a ter pontos de fusão e ebulição baixos; •São muito duros e frágeis; •São mais moles e flexíveis que os iónicos; •Conduzem a corrente eléctrica em solução aquosa; •Não conduzem a corrente eléctrica em solução aquosa; 12 6 Comparação de propriedades de um composto iónicos e um composto covalente iónico covalente Chang, R.-Química. México [etc.], McGraw Hill, 2002, 7ª ed., pag 340. (trad. espanhola) 13 Sólidos covalentes São muito diferentes dos restantes compostos covalentes e têm semelhanças físicas com os compostos iónicos: São muito duros. São insolúveis. Têm ponto de fusão muito alto. Não formam moléculas como os outros compostos covalentes. São sólidos, de estrutura tridimensional, onde todos os átomos estão ligados aos seus vizinhos por ligações covalentes. Quartzo SiO2 Diamante C 14 7 Cristal iónico versus cristal covalente • Estrutura do Cloreto de Sódio (sólido iónico) Carbono Estrutura do Diamante (sólido covalente) Constituição Constituição iões + e iões – átomos Ligação Ligação os iões atraem-se pelas suas cargas eléctricas Os átomos atraem-se por ligações covalentes entre cada 2. 15 Ligação metálica Ocorre entre átomos metálicos, iguais ou diferentes Ex 11Na 2;8;1 A Na Os electrões de valência dos metais estão pouco ligados ao átomo, que tende a largá-los. Os metais consistem numa estrutura de iões positivos (+) através da qual se movem os electrões de valência (-). Os iões positivos mantêm-se ligados pela atracção exercida pelos electrões que se movem entre eles. Na+ Na+ - - Na+ Na+ - Na+ - - Na+ Na+ - Na+ - - Na+ Na+ Na+ - - - Na+ Na+ - - Na+ - Na+ Na+ - Na+ - - Na+ Na+ Na+ - - Na+ - Na+ - 16 8 Fim O fantasma de Vermeer de Delft que pode ser usado como uma mesa Óleo sobre tábua 24 × 18 cm Salvador Dali 1934 17 9
Baixar