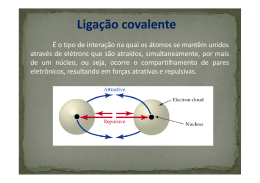
Ligações químicas – Introdução 1. (UFG) A molécula de H2 é caracterizada pela ligação covalente entre dois átomos de hidrogênio (H). O gráfico a seguir apresenta a relação entre a energia de ligação e a distância internuclear dos átomos. Com base na análise do gráfico apresentado, a) b) identifique (i) o raio covalente, em metros, e (ii) a energia da ligação molecular. identifique em qual das regiões ocorre atração e repulsão atômica, respectivamente. 2. (UFMG) A curva abaixo mostra a variação da energia potencial (Ep) em função da distância entre os átomos, durante a formação da molécula H2 a partir de dois átomos de hidrogênio, inicialmente a uma distância infinita um do outro. 3. (UFF-‐RJ) Para que um átomo neutro de cálcio se 2+ transforme em Ca , ele deve: Z(cálcio = 20) A) receber dois elétrons. B) receber dois prótons. C) perder dois elétrons. D) perder dois prótons. E) perder um próton. 4. Um elemento químico de configuração eletrônica 2 2 6 2 5 1s 2s 2p 3s 3p possui forte tendência para: A) perder 5 elétrons. B) perder 1 elétron. C) perder 2 elétrons. D) ganhar 2 elétrons. E) ganhar 1 elétron GABARITO –12 1. a) O raio covalente é igual a 75×10 m e energia de ligação molecular é igual a –450 kJ/mol. b) A região em que ocorre atração é a região B. A região em que ocorre repulsão é a região A. 2. [D] 3. [C] 4. [E] Ep/(kJ/mol) 0 -458 0 -11 7,40 . 10 Distância interatômica em metro Em relação às informações obtidas da análise do gráfico, assinale a afirmativa FALSA. a) A energia potencial diminui na formação da ligação química. b) A quebra da ligação H-‐H consome 458 kJ/mol. c) O comprimento de ligação da molécula H2 é de -‐11 7,40 x 10 m. d) Os átomos separados por uma distância infinita se atraem mutuamente. www.tenhoprovaamanha.com.br 1
Baixar