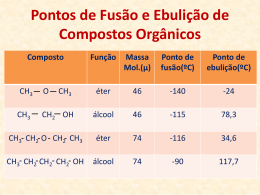
Estrutura e Síntese de Álcoois Estrutura de álcoois Grupo funcional hidroxi (OH) Oxigénio tem hibridação sp3 Classificação Primário: carbono ligado ao grupo –OH está ligado a outro carbono. Secundário: carbono ligado ao grupo –OH está ligado a dois carbonos. Terciário: carbono ligado ao grupo –OH está ligado a três carbonos. Aromático (fenol): -OH está ligado a carbono aromático. Nomes comuns Álcool pode ser nomeado por álcool alquílico. Útil só para grupos alquilicos pequenos. Exemplos: CH3 CH3 CH CH2OH isobutil álcool OH CH3 CH CH2CH3 sec-butil álcool Propriedades físicas Pontes de ebulição altos devido a pontes de hidrogénio entre as moléculas. Pequenos álcoois são miscíveis com a água, mas a solubilidade diminui à medida que o tamanho dos grupos alquilo aumenta. Pontos de ebulição Solubilidade em água Solubilidade diminui à medida que o grupo alquilo aumenta Acidez dos álcoois pKa varia entre: 15.5-18.0 (água: 15.7) Acidez diminui à medida que o grupo alquilo aumenta. Halogénios aumenta a acidez. Fenol é 100 milhões de vezes mais acidico que o ciclohexanol. Tabela de valores de Ka CH3 OH Reactividade Reacções de substituição dos álcoois Dado que o grupo hidróxido é uma mau grupo abandonante, os álcoois não são reactivos nas reacções de substituição nucleofilica e eliminação. R OH Nu R OH X X R+ Nu Não há reacção em nenhum caso + R HO- + Base forte SN1 HO- SN2 Grupo abandonante fraco Reacções de substituição dos Álcoois A situação melhora em condições ácido. O grupo abandonante transforma-se num grupo neutro. R OH H+ R O H NuNu R + H neutro O H neutro H - H2O R+ NuNu R Exemplos HI + H2O I HO iodocyclohexane cyclohexanol HCl OH 1-propanol Cl + H2O 1-chloropropane Mecanismo de Substituição Álcoois secundários e terciários sofrem reacção de substituição SN1. H3C H3C H3C H Br OH tert-butanol carbocation O H CH2 CH3 H3C H H3C H3C H3C CH3 H3C Br- CH3 HBr Br tert-butyl chloride - H2O Mecanismo de Substituição Álcoois primários sofrem reacção SN2. Carbocatiões primários são muito instáveis para se formarem. H Br O H OH 1-butanol H Br - H2O O H H Attack from back-side Br 1-bromobutane Reacção com HBr -OH é protonado -OH2+ é um bom grupo abandonante Álcoois 3° e 2° reagem com Br- via SN1 Álcoois 1° reagem via SN2 R O H H3O H + R O - H Br R Br Reacção com HCl Cloreto é um nucleófilo mais fraco que o brometo. Adiciona ZnCl2, o qual liga fortemente ao -OH, promovendo a reacção. O produto cloreto é insolúvel. Teste de Lucas: ZnCl2 em HCl conc. Álcoois 1° reagem lentamente ou não reagem. Álcoois 2 reagem em 1-5 minutos. Álcoois 3 reagem em menos de 1 minuto. Limitações das reacções de HX HI não reage Baixos rendimentos para cloretos 1° e 2° Pode obter alcenos em vez de haletos de alquilo Carbocatião intermediário pode rearranjar. Reacções com haletos de fosforo Bons rendimentos com álcoois 1° e 2° PCl3 para cloretos de alquilo (mas SOCl2 é melhor) PBr3 para brometos de alquilo P e I2 para iodeto de alquilo (PI3 not stable) Mecanismo com PBr3 P liga-se a -OH quando Br- sai Br- ataca por trás (SN2) HOPBr2 sai Reacção com cloreto de tionilo Produz cloreto de alquilo, SO2, HCl S liga-se a -OH, Cl- sai Cl- tira o H+ do grupo OH C-O quebra, enquanto o Cl- se transfere para C Eliminação A eliminação de água, deshidratação é comumente obtida usando ácido sulfúrico (H2SO4) como catalisador. H3C OH CH3 H2SO4 H3CHC CHCH3 + H2O A presença do ácido é essencial para converter o fraco grupo abandonante OH– em um bom grupo abandonante H2O. Eliminação O primeiro passo é a protonação do grupo hidroxilo. H H3C OH H2SO4 CH3 H3C O H CH3 A perda de água conduz à formação do carbocatião. H H3C O H - H2O CH3 H3C CH3 Eliminação Segundo, a base remove o protão b centro de carbocatião. H3C b H H H3CHC CHCH3 CH3 + H2SO4 OSO3H Esta reacção é uma E1. O passo determinante da reacção é a formação do carbocatião. Eliminação No caso de ter como escolha diferentes hidrogénios b, forma-se preferencialmente o alceno mais estável. CH3 H3PO4 H3C CH3CHCH2CH3 OH CH3 H2C CH + H3C H3C 84 % CH2 CH3 16 % Eliminação Como resultado do mecanismo E1, a desidratação segue a seguinte ordem: R H R R OH > H OH > R H R R OH O reflecte a estabilidade do carbocatião intermediário. R R R H R > H R > R H Eliminação Álcoois primários sofrem deshidratação via E2. Primeiro, contudo, gera-se um bom grupo abandonante. H + H OH O H Os passos seguintes, remoção da água e desprotonação tem lugar simultaneamente. OSO3H H H3C CH H O H H3C CH2 Reacções de deshidratação H2SO4 conc. produz alceno Carbocatião intermediário Produto Saytzeff Deshidratação bimolecular produz éter Baixa temp, 140°C e inferior, favorece éter Alta temp, 180°C e acima, favorece alceno Mecanismo de deshidratação H OH CH3CHCH3 H2SO4 OH CH3CHCH3 CH3CHCH3 alcohol H2O CH2 CHCH3 + CH3OH H3O CH3 OH2 CH3 O CH3 H CH3OH H2O CH3OCH3 Diagrama de Energia, E1 Oxidação de álcoois Existem 3 tipos de álcoois: R R CH R CH2 OH OH R R' 10 C OH R 20 30 Deshidratação (oxidação) é possivel para 10 e 20 formando-se aldeídos e cetonas, respectivamente. O O R R R' H aldeído cetona Oxidação de álcoois Aldeídos podem ser oxidados a ácidos. O O R R H OH aldeido ácido Agentes de oxidação tipicos são o ácido crómico (H2CrO4) ou clorocromato piridinium (PCC). O - O H O Cr Cl HO Cr OH N O O chromic acid PCC Exemplos H2CrO4 OH ciclopentanol OH O ciclopentanone H2CrO4 O H butanol butanal OH O Ácido butanoico H2CrO4 Exemplos OH PCC O CH2Cl2 butanol H butanal PCC é o agente de oxidação mais selectivo. Oxidação pode ser parada a nivel do aldeído. Redução dos álcoois Deshidratar com H2SO4 conc. Depois adicionar H2 OH CH3CHCH3 alcohol H2SO4 CH2 CHCH3 alkene H2 Pt CH3CH2CH3 alkane Iões alcóxido ROH + Na (or NaH) forma-se alcóxido de sódio RO- + 1° haleto de alquilo forma éter (Sintesis de éter de Williamson) CH3 CH3CH2CHCH3 O + CH3CH2 Br CH2CH2CH O CH2CH3 Resumindo: tipos de reacções de álcoois Deshidratação formando o alceno Oxidação a aldeído e cetona Substituição formando o haleto de alquilo Redução a alcano Síntese de Williamson: formação de éter Tabela de resumo Estados de oxidação Fácil para sais inorgânicos CrO42- reduzido a Cr2O3 KMnO4 reduzido a MnO2 Oxidação: perda de H2, ganho de O, O2, ou X2 Redução: ganho de H2 ou H-, perda de O, O2, ou X2 Nem um caso nem outro: ganho ou perda de H+, H2O, HX Carbonos 1º, 2º, 3º Síntese de álcoois Sintesis (Resumo) Substituição nucleofilica no haleto de alquilo por o grupo OH- Hidratação de alcenos água em solução ácida (não é muito efectiva) Reagentes Organometálicos Carbono é ligado ao metal (Mg ou Li). Carbono é nucleofílico (parcialmente negativo). O carbono parcialmente positivo é atacado. C-X C=O Forma-se uma ligação carbono-carbono. Reagentes de Grignard Formula R-Mg-X (reage como R:- +MgX) Estabilizada por éter anidro Iodetos mais reactivos Podem ser formados a partir de haletos do tipo primário secundário terciário vinil aril Alguns Reagentes de Grignard Br + ether Mg Cl CH3CHCH2CH3 + Mg CH3C CH2 Br + Mg ether ether MgBr MgCl CH3CHCH2CH3 CH3C CH2 MgBr Reagentes Organolitio Formula R-Li (reage como R:- +Li) Podem ser formados apartir de haletos de alquil, vinil, ou aril, tal como os reagentes de Grignard. Éter não é necessário, grande variedade de solventes podem ser usados. Reacção com Carbonilo R R:- ataca a carga parcialmente positiva do carbono do grupo carbonilo. O intermediário é o ião alcóxido. Adição de água ou ácido protona o álcool. C O R R C O C OH HOH OH Sinthesis de álcool 1° Grignard + formaldeido produz álcool primário com 1 carbono adicional. CH3 H3C C CH2 C H H CH3 H H MgBr C O CH3 CH CH2 H CH2 H H CH3 CH3 C O CH CH2 H CH2 C O H H HOH MgBr Sintesis de álcoois 2º Grignard + aldeido produz álcool secundário. CH3 H3C C CH2 C H H CH3 H3C H MgBr C O CH3 CH CH2 CH3 CH2 H H CH3 CH3 C O CH CH2 CH3 CH2 C O H H HOH MgBr Sintesis de álcoois 3º Grignard + cetone forma álcool terciário. CH3 H3C C CH2 C H H CH3 H3C H MgBr C O CH3 CH CH2 CH3 CH2 H3C CH3 CH3 CH3 C O CH CH2 CH3 CH2 C O H CH3 HOH MgBr Reacções de Grignard com cloretos de ácido e esteres Use 2 moles de reagente de Grignard. O produto é um álcool terciário com dois grupos alquilo idênticos. Reacção com uma mole de regentes de Grignard produz um intermediário que é cetona, o qual reage com a segunda mole de reagente de Grignard. Grignard + Ácido Cloridrico (1) Grignard ataca o carbonilo. Ião cloreto abandona. CH3 H3C R MgBr C O Cl CH3 R C O Cl R C O MgBr Cl CH3 MgBr R C + MgBrCl O Ketone intermediate Grignard and Ester (1) Grignard ataca o carbonilo. Ion alcóxido abandona! ? ! CH3 H3C R MgBr C O CH3O CH3 R C O OCH3 R C O MgBr OCH3 CH3 MgBr R C + O MgBrOCH3 Ketone intermediate Second step of reaction Segunda mole de Grignard reage cetona inermediária para formar ião alcóxido. Ião alcóxido é protonado com ácido diluido. CH3 CH3 R MgBr + R C R C O O R HOH CH3 R C OH R MgBr Reagente de Grignard + óxido de etileno Epóxidos são éteres muito reactivos. Produto é um álcool 1º com 2 carbonos adicionais. O O MgBr + CH2 CH2CH2 CH2 HOH O H CH2CH2 MgBr Limitações dos reagentes de Grignard Não pode estar presente água ou protões acidicos como O-H, N-H, S-H, or -C—C-H. O reagente de Grignard é destruido, torna-se alcano. Não pode haver ligações electrofílicas múltiplas, como C=N, C—N, S=O, ou N=O. Redução do carbonilo Redução do aldeido forma-se álcool 1º. Redução da cetona forma-se álcool 2º. Reagentes: Borohidreto de sódio, NaBH4 Hidreto de aluminio e lítio, LiAlH4 Raney Níquel Borohidreto de sódio Ião hidreto, H-, ataca o carbonilo formando ião alcóxido. Depois o ião alcóxido é protonado por ácido diluído. Só reage com carbonilos de aldeídos ou cetonas, e não com carbonilos de esteres ou de ácidos carboxílicos. O C H H H C H O + H H3O C O H H Hidreto de alumínio e lítio Agente redutor mais forte que o borohidreto de sódio, mas mais perigoso de trabalhar. Converte esteres e ácidos a álcoois 1º. O C OCH3 H LAH H3O+ C O H H Comparação de Agentes Redutores LiAlH4 é mais forte. LiAlH4 reduz compostos mais estáveisos quais são resistentes à redução. Hidrogenação catalítica Adiciona H2 com Raney níquel como catalisador. Também reduz qualquer ligação C=C. OH O NaBH4 OH H2, Raney Ni Fim Esterificação Fischer: álcool + ácido carboxilico Esteres de tosilato Esteres de sulfato Esteres de nitrato Esteres de fosfato Esterificação de Fischer Ácido + Alcool forma-se Ester + Água Ácido Sulfurico é catalisador. Cada passo é reversivel. O CH3 C OH CH3 + H O CH2CH2CHCH3 + H O CH3 CH3C OCH2CH2CHCH3 + HOH Esteres de Tosilato Álcool + ácido p-Toluenesulfonico, TsOH Ácido cloridrico é usado actualmente, TsCl O CH3CH2 O H + HO S CH3 O O CH3CH2 O S O CH3 => + HOH Formação do ester de Tosilato H C O C C H O O Cl O S O N O CH3 p-toluenesulfonyl chloride TsCl, “tosyl chloride” S O CH3 O S O CH3 ROTs, a tosylate ester Reacções de tosilatos (SN2) Com hidróxido produz álcool Com cianide produz nitrilo Com ião haleto produz haleto de alquilo Com ião alcóxido produz éter Com amónia produz sal de amina Com LiAlH4 produz alcano Sumário de reacções de Tosilato Esteres sulfato Álcool + Ácido Sulfúrico O HO S OH O + H + H O CH2CH3 O S OCH2CH3 O O CH3CH2O H + HO HO S O O + OCH2CH3 H CH3CH2O S O OCH2CH3 Esteres de Nitrato O O + N OH + H O CH2CH3 H O N OCH2CH3 O CH2 O H CH2 O H CH2 O H glycerine + 3 HO NO2 CH2 O NO2 CH2 O NO2 CH2 O NO2 nit roglycerine Esteres de fosfato O HO P OH O OH CH3OH CH3O P OH CH3OH O CH3O P OH OH CH3OH O CH3O P OCH3 OCH3 OCH3 Esteres fosfato no DNA O CH2 base O H H H O O CH2 O H P O base O H H O O CH2 O H P O base O H H O O CH2 O H P O base O H H O O P O O
Download