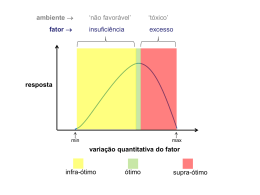
Parte III - Tolerância das plantas à salinidade 9 Efeitos dos sais no solo e na planta Nildo da S. Dias1 & Flávio F. Blanco2 1 2 Universidade Federal Rural do Semi-Árido Empresa Brasileira de Pesquisa Agropecuária Meio Norte Introdução Efeitos dos sais na planta Efeito osmótico Efeitos tóxicos Efeitos indiretos Efeito dos sais sobre o solo Efeitos sobre a estrutura Efeito sobre o pH Alteração dos parâmetros físico-hídricos do solo Tolerância das plantas à salinidade Estado nutricional das plantas Ajuste osmótico Sinalização bioquímica e melhoramento genético Toxidez Referências Manejo da salinidade na agricultura: Estudos básicos e aplicados ISBN 978-85-7563-489-9 Fortaleza - CE 2010 130 Nildo da S. Dias & Flávio F. Blanco Efeitos dos sais no solo e na planta INTRODUÇÃO EFEITOS DOS SAIS NA PLANTA A agricultura está enfrentando um grande problema em todo o mundo com a falta de recursos hídricos adequado, forçando muitos produtores a utilizar água salobra para a irrigação das culturas (Reed, 1996). Em muitas áreas de produção, o uso de água de baixa qualidade para irrigação e a aplicação de quantidades excessivas de fertilizantes são as principais razões para o problema do aumento da salinidade do solo. Em se tratando de regiões áridas e semiáridas irrigadas, constitui um sério problema, limitando a produção agrícola e reduzindo a produtividade das culturas a níveis anti-econômicos. Os efeitos da salinização sobre as plantas podem ser causados pelas dificuldades de absorção de água, toxicidade de íons específicos e pela interferência dos sais nos processos fisiológicos (efeitos indiretos) reduzindo o crescimento e o desenvolvimento das plantas. No solo, os efeitos negativos da salinização são desestruturação, aumento da densidade aparente e da retenção de água do solo, redução da infiltração de água pelo excesso de íons sódicos (Rhoades et al., 2000) e diminuição da fertilidade físico-química. A implicação prática da salinidade sobre o solo é a perda da fertilidade e a susceptibilidade à erosão, além da contaminação do lençol freático e das reservas hídricas subterrâneas. Nas plantas, estes efeitos implicam na perda de produtividade e de qualidade, ou perda total da produção. O conhecimento dos efeitos dos sais na planta e no solo, bem como os fenômenos envolvidos são fundamentais quando se pretende adotar práticas de manejos adequados da água e de cultivo visando à produção comercialmente com água salina. Deste modo, este capítulo trata das interações dos sais com a planta e o solo em cultivos agrícolas e a tolerâncias das culturas à salinidade. Efeito osmótico As plantas retiram a água do solo quando as forças de embebição dos tecidos das raízes são superiores às forças com que a água é retida no solo. A presença de sais na solução do solo faz com que aumentem as forças de retenção por seu efeito osmótico e, portanto, a magnitude do problema de escassez de água na planta. O aumento da pressão osmótica (PO) causado pelo excesso de sais solúveis, poderá atingir um nível em que as plantas não terão forças de sucção suficiente para superar esse PO e, em consequência, a planta não irá absorver água, mesmo de um solo aparentemente úmido (seca fisiológica). Dependendo do grau de salinidade, a planta, em vez de absorver, poderá até perder a água que se encontra no seu interior. Esta ação é denominada plasmólise e ocorre quando uma solução altamente concentrada é posta em contato com a célula vegetal. O fenômeno é devido ao movimento da água, que passa das células para a solução mais concentrada. A Figura 1 mostra a curva de retenção de água de um solo franco-argiloso para vários níveis de salinidade. Observa-se que a disponibilidade de água para a cultura é reduzida a medida em que a salinidade aumenta. O potencial osmótico de um solo pode ser estimado conhecendo-se a CE, a partir da equação: o 0,36 CE (1) em que: Ψ o - potencial osmótico, atm CE - condutividade elétrica, dS m-1 Assim, o potencial total com que a água é retida em um solo salino, pode ser expresso por: Efeitos dos sais no solo e na planta TENSÃO D’ ÁGUA % DE REDUÇÃO NA ABSORÇÃO DE em que: S - umidade do solo nas condições de saturação, 3 cm cm-3 ou % CC e PM - umidade do solo à capacidade de campo e ponto de murcha permanente, respectivamente, cm3 cm-3 ou %. 1 4 8 12 16 SALINIDADE DO SOLO (dS m-1) 0,33 CAPACIDADADE DE CAMPO Supõe-se: 1. Não há aumento nem diminuição de sais na água do solo 2. Os efeitos de esgotamento e da salinidade na disponibilidade de água se somam (Potencial osmótico = - 0,36 CE) 3. A água disponível é a diferença entre a capacidade de campo e o ponto de murchamento 4. A água é extraída do solo por efeito de evapotranspiração da cultura (ETc) Figura 1. Curvas de retenção de água de um solo francoargiloso para vários níveis de salinidade (Ayres & Westcot, 1999) T m o (2) em que: ΨT - potencial total com que a água é retida no solo, atm Ψm - potencial matricial do solo, atm Ψ o - potencial osmótico da solução do solo, atm. Devido à baixa concentração de sais solúveis, o potencial osmótico em solos não salinos é considerado desprezível (Ψ o = 0); logo, a água deste solo está disponível a uma faixa de potencial de -33 e -1500 kPa, em condições de capacidade de campo e ponto de murcha permanente, respectivamente, porém a presença de sais faz com que essa faixa de disponibilidade seja diminuída, em razão do aumento da tensão total pois, neste caso, considera-se o potencial osmótico (Ψ0 < 0). Exemplo: Procedimentos: a) Solo à capacidade de campo - A condutividade elétrica, em dS m-1, à capacidade de campo (CECC) é obtida considerando-se que a solução salina se concentra no solo duas vezes, mediante a Eq. 4: CE cc 2 CE es (4) CE cc 2 10 20 dS m 1 - O potencial osmótico deste solo à capacidade de campo é obtido segundo a Eq. 1: o 36 20 720 kPa - O potencial total com que a água é retida no solo a capacidade de campo, é obtido substituindo-se os valores do “Ψm” e “Ψ0” na Eq. 2: T 33 720 753 kPa - A contribuição relativa do Ψ0 na diminuição do potencial total à capacidade de campo é obtida mediante a relação percentual entre o potencial osmótico e o potencial total 720 % o 100 95% do potencial total 753 O procedimento a seguir determina a salinidade e a contribuição relativa do potencial osmótico para o aumento do potencial total de um solo salino de textura média, em condições de umidade à capacidade de campo e ponto de murcha permanente. Dados: - Salinidade do solo: CEes= 10 dS m-1 - Considerando-se que um solo de textura média tem, normalmente, umidade à capacidade de campo e ponto de murcha, respectivamente, igual à metade e a um quarto da condição de saturação, ou seja: S 2 CC 4 PM 131 (3) b) Solo no ponto de murcha - A condutividade elétrica, em dS m-1, no ponto de murcha (CEPM) é obtida, considerando-se que a solução salina se concentra no solo quatro vezes, conforme a Eq. 3: CE PM 4 10 40 dS m -1 - O potencial osmótico deste solo no ponto de murcha é obtido de acordo com a Eq. 1: o 36 40 1440 kPa 132 Nildo da S. Dias & Flávio F. Blanco - O potencial total com que a água é retida no solo em ponto de murcha é obtido, substituindo-se os valores do “Ψm” e “PO” na Eq. 8.2: T 1500 1440 2940 kPa - A contribuição relativa do Ψ0 na diminuição do potencial total no ponto de murcha é obtida mediante a relação percentual entre o potencial osmótico e o potencial total 1440 % o 100 48,97% do potencial total 2940 Os cálculos anteriores mostram que a tensão total com que a água é retida no solo à capacidade de campo e ponto de murcha é, respectivamente, 753 e 2940 kPa. É obvio que a contribuição relativa do Ψ0 é maior quando o solo se encontra à capacidade de campo e a mesma é aumentada a cada elevação da CEes. A medida em que o conteúdo de água no solo diminui, a disponibilidade de água para as plantas varia continuamente em cada camada da zona radicular, já que tanto o conteúdo de água como Ψ0 variam continuamente, entre dois eventos de irrigação, devido ao consumo de água pela planta. Para a mesma profundidade, pouco depois da irrigação o teor de água no solo se aproxima de seu máximo, enquanto a concentração dos solutos é mínima; consequentemente, ambos os teores variam à medida que a água é consumida pela planta, sendo que o teor de umidade diminui enquanto os sais aumentam. A salinidade do solo reduz a disponibilidade da água no solo; no entanto, nem todas as culturas são igualmente afetadas pelo mesmo nível de salinidade, pois algumas são mais tolerantes que outras e podem extrair água com mais facilidade. Com base na resposta aos sais, as plantas são classificadas em glicófitas e halófitas. As glicófitas representam o grupo das plantas cultivadas e, na sua maioria, são as menos tolerantes à ação dos sais, enquanto as halófitas compõem o grupo de plantas que adquirem condições fisiológicas; portanto, ajustam-se osmoticamente e sobrevivem em meio altamente salino. Plantas mais tolerantes ao meio salino aumentam a concentração salina no seu interior, de modo que permaneça um gradiente osmótico favorável para absorção de água pelas raízes. Este processo é chamado ajuste osmótico e se dá com o acúmulo dos íons absorvidos nos vacúolos das células foliares, mantendo a concentração salina no citoplasma em baixos níveis, de modo que não haja interferência com os mecanismos enzimáticos e metabólicos nem com a hidratação de proteínas das células. Esta compartimentação do sal é que permite, às plantas tolerantes, viverem em ambientes salinos, porém as plantas sensíveis à salinidade tendem a excluir os sais na solução do solo, mas não são capazes de realizar o ajuste osmótico descrito e sofrem com decréscimo de turgor, levando as plantas ao estresse hídrico, por osmose. Efeitos tóxicos Esses efeitos acontecem quando as plantas absorvem os sais do solo, juntamente com a água, permitindo que haja toxidez na planta por excesso de sais absorvidos. Este excesso promove, então, desbalanceamento e danos ao citoplasma, resultando em danos principalmente na bordadura e no ápice das folhas, a partir de onde a planta perde, por transpiração, quase que tão somente água havendo, nessas regiões, acúmulo do sal translocado do solo para a planta e, obviamente, intensa toxidez de sais. Os danos podem reduzir significativamente os rendimentos e sua magnitude depende do tempo, da concentração de íons, da tolerância das plantas e do uso da água pelas culturas. Os problemas de toxicidade frequentemente acompanham ou complicam os de salinidade ou permeabilidade, podendo surgir mesmo quando a salinidade for baixa. Os sintomas de toxicidade podem aparecer em qualquer cultura se as concentrações de sais no interior são suficientemente altas ou acima de níveis de tolerância da cultura. Normalmente, a toxicidade é provocada pelos íons cloreto, sódio e boro; entretanto, muitos outros oligoelementos são tóxicos às plantas, mesmo em pequenas concentrações. A absorção foliar acelera a velocidade de acumulação de sais dos íons tóxicos na planta sendo, muitas vezes, a fonte principal da toxicidade. Os íons, sódio e cloreto podem, também, ser absorvidos via foliar, quando se molham durante a irrigação por aspersão e, sobretudo, durante períodos de altas temperaturas e baixa umidade. A Tabela 1 mostra algumas culturas afetadas por íons específicos. Cloreto: O cloreto não é retido nem adsorvido pelas partículas do solo, deslocando-se facilmente com a água do solo, mas é absorvido pelas raízes e translocado às folhas, onde se acumula pela transpiração. O primeiro sintoma deste íon, evidenciado pelas plantas, é a queimadura do ápice das folhas que, em estágios avançados, atinge as bordas e promove sua queda prematura; nas culturas sensíveis, os sintomas aparecem quando se alcançam concentrações de 0,3 a 1,0 % de cloreto, em base de peso seco das folhas. Efeitos dos sais no solo e na planta Tabela 1. Algumas culturas afetadas por íons específicos (Pizarro, 1978) A sensibilidade das culturas a este íon é bastante variável como, por exemplo, as frutíferas, que começam a mostrar sintomas de danos a concentrações acima de 0,3 % de cloreto, em base de peso seco, as espécies tolerantes podem acumular até 4,0 a 5,0 % de cloreto sem manifestar qualquer sintoma de toxicidade. A Tabela 2 apresenta, para certas culturas, os valores de tolerância ao cloreto, medidos no extrato de saturação e na água de irrigação. É recomendável manter baixos os níveis de salinidade no solo durante o plantio e lembrar que os dados publicados na literatura foram obtidos de parcelas com culturas irrigadas por superfície. Por esta razão, é necessário considerar-se que a irrigação por aspersão pode causar queimaduras das folhas a nível inferior a esses, pois as folhas também absorvem os sais. Sódio: A toxicidade ao sódio é mais difícil de diagnosticar que ao cloreto, porém tem sido identificada claramente como resultado de alta proporção de sódio na água (alto teor de sódio ou RAS). Ao contrário dos sintomas de toxicidade do cloreto, que têm início no ápice das folhas, os sintomas típicos do sódio aparecem em forma de queimaduras ou necrose, ao longo das bordas. As concentrações de sódio nas folhas alcançam níveis tóxicos após vários dias ou semanas e os sintomas aparecem, de início, nas folhas mais velhas e em suas bordas e, a medida em que o problema se intensifica, a necrose se espalha progressivamente na área internervural, até o centro das folhas. Para as culturas arbóreas, o nível tóxico nas folhas se encontra em concentrações acima de 0,25 a 0,50 % de sódio, em base de peso seco. A Tabela 3 classifica a tolerância de várias culturas ao sódio, utilizando-se três níveis de percentagem de sódio trocável. 133 Tabela 2. Tolerância relativa das plantas (variedades e porta enxerto) ao cloreto, medidas no extrato de saturação e na água de irrigação (Ayers & Westcot, 1991) * Valores máximos aplicáveis apenas para culturas irrigadas por superfície. Para culturas irrigadas por aspersão pode causar queimadura das folhas a nível inferiores a esses Tabela 3. Tolerância relativa das culturas* ao porcentagem do sódio trocável (PST) (Ayers & Westcot, 1991) Sensíveis Semi-tolerantes Tolerantes (PST < 15) (PST de 15 a 40) (PST > 40) Caupi Trigo Capim de Rhodes Grão de bico Tomate Capim Angola Amendoim Espinafre Algodão Lentilha Sorgo Capim Bermuda Beterraba Tangerina Centeio Açucareira Pêssego Arroz Beterraba Laranja Rabanete Cevada Alfafa Pomelo (grapefruit) Cebola Ervilha Aveia Milho Mostarda Algodão Trevo (germinação) Feijão Cana-de-açúcar Noz Milheto Frutas caducifólias Alface Abacate Fetusca Cenoura * Listada em ordem crescente de tolerância 134 Nildo da S. Dias & Flávio F. Blanco Boro: O boro é um elemento essencial ao desenvolvimento das plantas, porém em quantidades relativamente pequenas. Para algumas culturas, se o nível de boro na água é de 0,2 mg L -1 , as concentrações entre 1 e 2 mg L -1 são tóxicas. As águas superficiais raramente contêm níveis tóxicos de boro, mas as águas de nascentes e as águas de poços podem conter concentrações tóxicas, principalmente nas proximidades de falhas sísmicas e áreas geotérmicas. De modo geral, os critérios de qualidade de água em relação ao boro podem ser interpretados a partir das Tabelas 4 e 5. Tabela 4. Níveis de tolerância das culturas ao boro na água de irrigação (Ayers & Westcot, 1999) Concentração Interpretação (mg L-1) < 0,5 Bom para todas as plantas Danos ocorrem nas folhas de plantas 0,5 a 1,0 sensíveis sem alterar a produção Tolerado por semi-tolerantes, mas 1,0 a 2,0 reduz a produção de plantas sensíveis Somente plantas tolerantes produzem 2,0 a 4,0 satisfatoriamente > 4,0 Danos em quase todas as plantas Tabela 5. Tolerância relativa das plantas* ao boro na água de irrigação (Ayers & Westcot, 1999) Sensíveis Semi-tolerantes Tolerantes (0,5 a 1,0 mg L-1) (1,0 a 2,0 mg L-1) (2,0 a 4,0 mg L-1) Limão Batata Doce Cenoura Pomelo (grapefruit) Pimentão Alface Abacate Tomate Repolho Laranja Morango Nabo Amora Aveia Cebola Damasco Milho Alfafa Pêssego Trigo Beterraba Cereja Cevada Tâmara Caqui Azeitona Aspargo Figo Ervilha Uva Algodão Maçã Batata Pera Girassol Ameixa Alcachofra Noz Noz Pecan * Listadas em ordem crescente de tolerância Os problemas de toxicidade ocorrem, com maior frequência, por causa do boro na água que no solo. Os sintomas causados na folha pelo boro se resumem em manchas amarelas ou secas, principalmente nas bordas e no ápice das folhas velhas. Na medida em que o boro se acumula, os sintomas se estendem pelas áreas internervurais até o centro das folhas. Em alguns casos, os sintomas se manifestam mediante exudação gomosa nos ramos e no tronco como, por exemplo, na amendoeira. Na maioria das culturas, os sintomas aparecem quando a concentração de boro nas folhas excede 250 a 300 mg kg-1 de matéria seca. Efeitos indiretos Esses efeitos acontecem quando as altas concentrações de sódio ou outros cátions na solução interferem nas condições físicas do solo ou na disponibilidade de alguns elementos, afetando o crescimento e o desenvolvimento das plantas, indiretamente. Quando no extrato de saturação há teores apreciáveis de carbonato de sódio, o pH do solo poderá alcançar valores elevados e haver a diminuição na disponibilidade de zinco, cobre, manganês, ferro e boro, podendo ocorrer deficiência nas plantas cultivadas nessas condições, principalmente se em pequenas quantidades. Portanto, o crescimento da planta é influenciado não diretamente pelo excesso de carbonato de sódio, mas pelo seu efeito sobre o pH do solo. A presença de um íon em excesso poderá provocar deficiência ou inibir a absorção de outro, devido à precipitação. Por exemplo, o excesso de sulfato, carbonato e bicarbonato, poderá precipitar o cálcio e afetar o crescimento da planta pela falta do elemento precipitado e não pelo excesso de outro íon. Um outro efeito indireto é o excesso de sódio trocável no solo, que provoca condições físicas desfavoráveis para o crescimento das plantas, sobretudo para o desenvolvimento do sistema radicular. A presença de sais de sódio também tende a restringir a taxa de mineralização do nitrogênio (N) já que, com o aumento de sua concentração no solo, em geral a mineralização do N orgânico é reduzida, afetando o crescimento da planta, pela redução do N disponível e não pelo excesso de sódio. EFEITO DOS SAIS SOBRE O SOLO Efeitos sobre a estrutura O efeito dos sais sobre a estrutura do solo ocorre, basicamente, pela interação eletroquímica existente entre os cátions e a argila. A característica principal deste efeito é a expansão da argila quando úmida e a contração quando seca, devido ao excesso de sódio trocável. Se a expansão for exagerada, poderá ocorrer a fragmentação das partículas, causando a dispersão da argila e modificando a estrutura do solo. De modo generalizado, os solos sódicos, ou seja, com excesso de sódio trocável, Efeitos dos sais no solo e na planta apresentam problemas de permeabilidade e qualquer excesso de água causará encharcamento na superfície do solo, impedindo a germinação das sementes e o crescimento das plantas, por falta de aeração. A dispersão do solo pode ser explicada com base na interação dos cátions com a argila. Como já mencionado, a micela do solo ou partícula de argila tem cargas predominantemente negativas que são neutralizadas por atraírem cátions presentes no sistema coloidal. Por outro lado, os ânions, por terem cargas negativas, são repelidos, afastando-se da partícula de argila. Deste modo, é formada ao redor da argila uma dupla camada iônica. O modelo mais aceitável desta dupla camada é o de Stern, que consiste de uma camada de íons adsorvidos na superfície da argila e de uma camada difusa de cátions, de concentração decrescente, à medida que se afasta da partícula de argila. A certa distância da argila a concentração de cátions diminui e a de ânions aumenta na solução a medida que se afasta da partícula, tornadose balanceadas (Figura 2). Contraíons Líquido polar Partícula Camada difusa Camada adsorvida (Stern) Figura 2. Modelo de Stern (distribuição dos íons em solução em função da distância da superfície da argila) Quanto maior a carga, maior também será a força de atração, razão pela qual os cátions bivalentes (como Ca2+ e Mg2+) são atraídos pela superfície da argila com maior força eletrostática que os monovalentes (como Na+ e K+). A força de atração entre as cargas opostas (positiva e negativa) é inversamente proporcional ao quadrado da distância entre as cargas, ou seja, quanto maior o raio iônico, menor é a espessura da dupla camada, porém a hidratação dos cátions é um fator importante a se considerar quando se refere ao raio iônico. Assim, embora o lítio seja o cátion de menor raio iônico, ao se hidratar ele tem maior raio e, portanto produzirá menor espessura da dupla camada (Tabela 6). A força eletrostática dos bivalentes é superior ao efeito da hidratação, diminuindo a espessura entre cargas negativas da argila e as cargas positivas dos cátions; 135 Tabela 6. Raio iônico hidratado e não hidratado em Aº (angstrons) Raio não Raio Íon hidratado hidratado Lítio 0,60 10,03 Sódio 0,98 7,90 Potássio 1,33 5,32 Magnésio 1,43 5,37 assim, a força de hidratação é superada com mais facilidade pelos bivalentes, fazendo com que o cálcio e o magnésio sejam mais atraídos à argila que, por exemplo, o sódio; então, a dupla camada de íons existente ao redor da argila tem espessura menor quando predominam cátions bivalentes ou mesmo trivalentes, como o Al3+. Por outro lado, o aumento da concentração da solução do solo faz com que os cátions sejam atraídos fortemente pela superfície da argila (Tabela 7); assim, com o aumento da relação Ca/Na na solução do solo, a espessura da dupla camada diminui porém, quando a dupla camada de íons junto à argila contiver muito sódio e poucos íons em solução (solo irrigado com água de baixa concentração de sais) terá espessura relativamente maior. Então, a alta concentração de sais solúveis no solo (salinidade) não altera a estrutura do solo com argilas expansivas mas, sim, a baixa concentração de sais (CE < 0,2 dS m-1) e/ou a alta concentração de sódio. Tabela 7. Efeito da concentração de cátions no tamanho da dupla camada difusa Concentração (Normal) 10-5 10-4 10-3 10-2 10-1 10 0 Tamanho da dupla camada iônica (Å) NaCl CaCl2 AlCl3 954 302 95 30 10 3 477 151 48 15 5 1,5 318 101 32 10 3 1 A espessura da dupla camada exerce efeito pronunciado no comportamento físico do solo e quando este se encontra mais ou menos em capacidade de campo, a espessura da dupla camada desenvolve seu potencial máximo e, a medida em que o solo vai perdendo água, pode alcançar níveis em que a dupla camada não poderá permanecer em sua espessura normal, particularmente as camadas grossas encontradas em solos sódicos, transformando-se em uma dupla camada truncada. Ao umedecer o solo, a dupla camada se expande, causando o fechamento dos poros interagregados e reduzindo a condutividade hidráulica do solo; além disso, a pressão que originou a expansão empurra as partículas individuais de argila uma contra a 136 Nildo da S. Dias & Flávio F. Blanco outra, dispersando o solo e seus agregados, fazendo-os desaparecer em partes. As partículas finas que ficam soltas, obstruem os poros do solo, reduzindo ainda mais a permeabilidade à água e ao ar. Efeito sobre o pH Em geral, para reduzidas concentrações de sais o pH das águas pode ser elevado, pois a medida em que aumenta a salinidade da água, o pH diminui. Para salinidade maior que 5 dS m-1 as águas têm pH neutro. Fenômeno semelhante ocorre com a solução do solo. Por exemplo, a Figura 3 mostra como o pH de um solo aluvial, textura argilosa e pobre em matéria orgânica, diminui quando se aumenta a condutividade elétrica, cujos valores não podem ser generalizados para outros tipos de solo, pois esta diminuição varia com as características do solo. pH do solo PST > 10 PST < 10 Retenção de água no solo: Os solos, cuja estrutura foi modificada pela sodicidade e/ou ausência de íons em solução, tendem a armazenar mais água quando expostos aos mesmos níveis de potencial matricial (Russo & Bresler, 1980). As alterações na curva característica de água do solo são maiores para níveis de umidade próximos da saturação, podendo ocorrer mesmo sob baixos níveis de potencial como 1,5 MPa. Lima et al. (1990) estudaram os efeitos da sodicidade e da concentração de sais sobre as curvas características de um solo argiloso e também observaram aumento da umidade retida quando o solo era exposto a maior concentração de sódio na fase trocável e/ou menor concentração de sais em solução. Após ajustarem os dados obtidos à equação de van Genuchten (1980), conforme a Eq. 5, observaram que a sodicidade reduz o valor do parâmetro (alfa), enquanto aumenta os valores de n e m. r s r 1 (h) n m (5) em que: - umidade volumétrica, h - é o potencial matricial e os subscritos r e s correspondem, respectivamente, aos níveis de umidade residual e de saturação. TOLERÂNCIA DAS PLANTAS À SALINIDADE -1 CEes (mS cm a 25 ºC) Figura 3. Relação entre o pH de um solo aluvial e a condutividade elétrica (Pizarro, 1977) Alteração dos parâmetros físico-hídricos do solo Densidade aparente: A contração das partículas de argila com a redução da umidade do solo pode ser caracterizada pela curva de encolhimento que relaciona o volume ocupado pelo solo com a umidade. Lima & Grismer (1994) observaram que solos sódicos encolhemse mais acentuadamente com a redução da umidade do que solos normais, apresentando densidade aparente maior, provavelmente como consequência da desestruturação do solo que elimina os poros. As diferenças notadas no encolhimento dos solos permitiram observar, através de análise computadorizada de imagens, que solos normais apresentam, quando secos, cerca de 8% de sua superfície aberta na forma de fendas, enquanto nos solos sódicos esta área varia de 15 a 20% (Lima & Grismer, 1994). A redução do crescimento da planta devido o estresse salino pode estar relacionado com os efeitos adversos do excesso de sais sob homeostase iônica, balanço hídrico, nutrição mineral e metabolismo de carbono fotossintético (Zhu, 2001; Munns, 2002). Os mecanismos pelo qual o estresse salino deprecia as plantas ainda é uma questão discutida devido à natureza muito complexa do estresse salino na planta. Devido ao rápido acúmulo de sais no solo das áreas irrigadas, os problemas de salinização é um fator crítico para produção vegetal. Entre as espécies sensíveis ao estresse salino, o efeito da salinidade manifesta-se por severas reduções do crescimento e distúrbio na permeabilidade da membrana, atividade de troca hídrica, condutância estomática, fotossíntese e equilíbrio iônico (Shannon & Grieve, 1999; Navarro et al., 2003; Cabanero et al., 2004). Existem na literatura muitas tabelas de tolerância das plantas à salinidade, expressando o efeito generalizado de sais sobre as plantas. Entre estas, pode-se destacar os dados publicados por Berstein (1974), Maas e Hoffman Efeitos dos sais no solo e na planta (1977), Ayers (1977), Bresler et al. (1982), Maas (1984), e Ayers e Westcot (1999). Alguns valores extraídos dessas publicações são listados na Tabela 8. Existem diferentes mecanismos de tolerância das plantas à salinidade. Tester e Davenport (2003) sugerem a existência de dois grupos de mecanismos de tolerância: (1) tolerância individual das células, envolvendo, por exemplo, a compartimentação intracelular e a sinalização bioquímica, e (2) tolerância a um nível superior em relação ao grupo anterior, envolvendo, por exemplo, o controle da absorção e transporte interno de sais e o acúmulo de Na nos interior da planta. Estado nutricional das plantas Dentre os fatores estudados para caracterizar a tolerância das plantas à salinidade, uma grande atenção 137 deve ser dada ao estado nutricional das plantas. Incrementos na concentração de NaCl na solução do solo prejudicam a absorção radicular de nutrientes, principalmente de K e Ca, e interferem nas suas funções fisiológicas (Zhu, 2001; Yoshida, 2002). Então, a habilidade dos genótipos de plantas em manter altos teores de K e Ca e baixos níveis de Na dentro do tecido é um dos mecanismos chaves que contribui para expressar a maior tolerância à salinidade. Na maioria dos casos, genótipos tolerantes à salinidade são capazes de manter altas relações K/Na nos tecidos (Mansour, 2003; Zeng et al., 2003). Pelo aumento da absorção de K e consequente redução da absorção de Na, o K contribui para manter a relação K/Na alta na planta conforme constatado em plantas de pimentão (Rubio et al., 2003). A habilidade dos genótipos de excluir Na da raiz é uma Tabela 8. Valores limites de condutividade elétrica do extrato saturado do solo para evitar efeitos generalizados no desenvolvimento das plantas CEes CEes Nome Nome cientifico Nome Nome cientifico (dS m-1) (dS m-1) Abacate Persea americana 1,3 Damasqueiro Prunus armeniaca 1,6 Abobrinha Cucumis sativus 2,5 Elimo Elymus triticoides 2,7 Abobrinha Cucurbita pepo melopepo 3,2 Ervilha Pisum sativum L. 2,5 Abobrinha italiana Cucurbita pepo melopepo 4,7 Espinafre Spinacia oleracea 2,0 Aipo, salsão Apium graveolens 1,8 Feijão fava Vicia faba 1,6 Alface Lactuca sativa 1,3 Feijoeiro Phaseolus vulgaris 1,0 Alfafa Medicago sativa 2,0 Festuca Festuca elatior 3,9 Algodoeiro Gossypium hirsutum 7,7 Figo Ficus carica 2,5 Ameixa Prunus domestica 1,5 Framboesa Rubus idaeus 1,0 Amêndoa Prunus dulcis 1,5 Laranja Citrus sinensis 1,7 Amendoim Arachis hypogaea 3,2 Limão Citrus limon 1,7 Amoreira Rubus ursinus 1,5 Linho Linum usitatissimum 1,7 Amoreira preta Rubus spp, 1,5 Maçã Malus sylvestris 1,7 Arroz Oryza sativa 3,0 Melão cantaloupe Cucumis melo 2,2 Azeitona Olea europaea 2,7 Milho doce Zea mays 1,7 Azevém Lolium perenne 5,6 Milho forrageiro Zea mays 1,8 Batata Solanum tuberosum 1,7 Milho grão Zea mays 1,7 Batata doce Ipomoea batatas 1,5 Morango Fragaria spp, 1,0 Beterraba Beta vulgaris 4,0 Nabo Brassica rapa 0,9 Beterraba açucareira Beta vulgaris 7,0 Noz Junglans regia 1,7 Brassica oleraceae botrytis 2,8 Pêra Pyrus communis 1,5 Brócolis Cana de açucar Saccharum officinarum 1,7 Pêssego Prunus pérsica 1,7 Capim bermuda Cynodon dactylon 6,9 Pimentão Capsicum annuum 1,5 Capim doce Phalaris tuberose 4,6 Pomelo (grapefruit) Citrus paradisi 1,8 Capim dos pomares Dactylis gromerata 1,5 Rabanete Raphanus sativus 1,2 Capim mimoso Eragrostis spp, 2,0 Repolho Brassica oleracea capitata 1,8 Capim sudão Sorghum sudanense 2,8 Romã Punica granatum 2,5 Cártamo Carthamus tinctorius 5,3 Sesbânia Sesbania exaltata 2,3 Caupi Vigna unguiculata 1,3 Soja Glycine Max 5,0 Cebola Allium cepa 1,2 Sorgo Sorghum bicolor 4,0 Cenoura Daucus carota 1,0 Tamareira Phoenix dactylifera 4,0 Cevada (forragem) Hordeum vulgare 6,0 Tomateiro Lycopersicon lycopersicum 2,5 Cevada (grão) Hordeum vulgare 8,0 Trigo Triticum aestivum 6,0 Cornichão Lotus uliginosus 2,3 Vagem Phaseolus vulgaris L. 1,5 Couve-flor Brassica oleracea 2,5 Videira Vitis spp. 1,5 138 Nildo da S. Dias & Flávio F. Blanco importante característica da planta, contribuindo para aumentar a relação K/Na e expressar a alta tolerância aos sais (Yoshida, 2002; Zhu, 2002). Como a aplicação de fertilizantes aumenta a concentração de nutrientes no solo, alguns autores têm afirmado que a aplicação de fertilizantes em quantidade maior do que a quantidade recomendada traria benefícios em condições de salinidade moderada, pois haveria maior absorção de nutrientes, aumentando as relações K/Na, Ca/Na e NO3/Cl (Cuatero & Muñoz, 1999). O aumento da absorção de K, e consequente redução da absorção de Na, contribuiu para manter a relação K/ Na mais alta em plantas de pimentão (Rubio et al., 2003) e espinafre (Chow et al., 1990). Com relação à relação NO 3 /Cl, o aumento na concentração de NaCl na solução nutritiva promoveu redução nos teores foliares de NO 3 em plantas de tomate, e não teve efeito sobre os teores de K, apesar do aumento dos teores de Na nas folhas (Phills et al., 1979). Pessarakli e Tucker (1988) verificaram que sob baixas concentrações de NaCl na solução nutritiva a absorção de N não foi afetada, porém esta foi reduzida em 70% sob altos níveis de salinidade. A inibição da absorção de nitrato pode ocorrer devido à interação NO3/ Cl nos sítios de absorção ou à despolarização da membrana pelo Na (Suhayda et al., 1990), o que tem sido associado à inibição não-competitiva de absorção de NO3 (Hawkins e Lewis, 1993). Além do N e do K, outros íons também podem conferir certo grau de tolerância das culturas à salinidade. A aplicação de Si em plantas de moringa cultivadas em solução nutritiva elevou os teores foliares de K e Ca e reduziu os de Na e Cl; entretanto, não se observou redução nos efeitos depressivos do NaCl sobre a produção de matéria seca das folhas, caule e raízes (Miranda et al., 2002). Por outro lado, Matoh et al. (1986) demonstraram que o Si promove aumento do teor de K e da relação K/Na nas folhas em arroz e da produção de matéria seca em cevada. Apesar dessas evidências, existem controvérsias sobre o aumento da tolerância das culturas à salinidade pelo aumento da adubação. Em extensa revisão bibliográfica sobre os efeitos de doses de nutrientes na tolerância de culturas à salinidade, Grattan e Grieve (1999) verificaram que muitos estudos têm sido conduzidos com o solo ou o substrato deficiente em N, P e/ou K. Com isso, os efeitos benéficos de altas doses de nutrientes não implicam em aumento da tolerância das culturas à salinidade, uma vez que as culturas respondem positivamente aos níveis crescentes de fertilizantes mesmo nos tratamentos não-salinos. Plantas que se desenvolvem em solos férteis podem parecer mais tolerantes aos sais em relação àquelas que crescem em solos deficientes, pois a fertilidade é o principal fator limitante do crescimento; então, a adição de fertilizante extra não alivia a inibição do desenvolvimento causada pela salinidade (Rhoades et al., 2000). De fato, algumas pesquisas têm demonstrado que a aplicação de fertilizantes não resultam em aumento da tolerância à salinidade de algumas culturas. Blanco et al. (2008a, 2008b) utilizaram água de irrigação de alta salinidade na irrigação do tomateiro em ambiente protegido e verificaram, nas folhas, aumento da relação N/Cl com as doses de N, e da concentração de K e prolina (aminoácido relacionado à tolerância das plantas à salinidade) com as doses de K. Entretanto, os efeitos da salinidade não foram aliviados e a produtividade não foi alterada, demonstrando que o aumento na dose de fertilizantes aplicados não conferiu maior tolerância do tomateiro à salinidade. Resultados apresentados por Tabatabaei e Fakhrzad (2008) demonstram aumento na relação K/Na em folhas de azevem somente quando compararam plantas que receberam nitrato de potássio com plantas que não receberam (condição de deficiência em K); já na presença de doses crescentes desse fertilizante, não houve aumento de K/Na nas folhas do azevem, corroborando com a afirmação de Rhoades et al. (2000). Com base nessa discussão, nota-se que ainda há controvérsias sobre a eficiência da aplicação de nutrientes em excesso visando aumentar a tolerância das culturas à salinidade. De qualquer forma, é fato que plantas bem nutridas toleram mais à salinidade do que plantas submetidas à deficiência de algum nutriente e, portanto, é importante que haja um programa eficiente de manejo do solo e da adubação para que a convivência com a salinidade seja possível. De acordo com Munns e James (2003), o mecanismo de exclusão de Na correlaciona-se muito bem com a tolerância em genótipos de trigo tetraplóide. Em plantas de Arabidopsis thaliana (Elphick et al., 2001) e yeast (Almagro et al., 2001), foram observados elevadas sensibilidade à NaCl sendo associada com a habilidade deficiente dos genótipos no sistema de efluxo de Na. O ‘screening’ em genótipos de plantas para alta tolerância ao estresse salino as relações K/Na e Na/Ca e a concentração de Na nos tecidos, entretanto, são parâmetros usados constantemente para diferentes espécies cultivadas (Munns e James, 2003). Ajuste osmótico As plantas tolerantes à salinidade são designadas como plantas halófitas e podem necessitar cerca de 15 g L -1 de cloreto de sódio, equivalente à metade da Efeitos dos sais no solo e na planta concentração da água do mar, para completar seu ciclo fenológico. Essas plantas absorvem, por exemplo, o cloreto de sódio em altas taxas e o acumula em suas folhas para estabelecerem um equilíbrio osmótico com o baixo potencial da água presente no solo. Este ajuste osmótico se dá com o acúmulo dos íons absorvidos nos vacúolos das células das folhas, mantendo a concentração salina no citoplasma e nas organelas em baixos níveis de modo que não haja interferência com os mecanismos enzimáticos e metabólicos e com a hidratação de proteínas das células. Esta compartimentação do sal é que permite, segundo Lauchi e Epstein (1984), às plantas halófitas viverem em ambiente salino. Para esse ajuste osmótico, na membrana que separa o citoplasma e o vacúolo não há fluxo de um compartimento para outro, mesmo que haja elevado gradiente de concentração. O ajuste osmótico é obtido por substâncias compatíveis com as enzimas e os metabólitos ali presentes. Esses solutos são, na maioria, orgânicos como compostos nitrogenados e, em algumas plantas, açúcares, como o sorbitol (Lauchi e Epstein, 1984). As plantas sensíveis à salinidade tendem, em geral, a excluir os sais na absorção da solução do solo, mas não são capazes de realizar o ajuste osmótico descrito e sofrem com decréscimo de turgor, levando as plantas ao estresse hídrico por osmose. Embora o crescimento da parte aérea das plantas se reduza com o aumento da concentração salina do substrato onde vivem, a redução da absorção de água não é necessariamente a causa principal do reduzido crescimento das plantas em ambientes salinos. De fato, Kramer (1983) aponta que plantas que crescem em substratos salinos mantêm seu turgor e chama atenção para o fato de que suculência é uma característica comum entre as halófitas. Este fato sugere que essas plantas não percam água por salinidade como se estivessem em solos secos e também não se recuperem, como fazem as plantas estressadas por falta de água, ao receberem água novamente. Assim, parece que o efeito no crescimento, de níveis similares de potencial osmótico e mátrico, é diferente. Esta inferência permite questionar o emprego da soma algébrica com a mesma ponderação para potencial gravitacional, matricial e osmótico ao calcular o potencial total da água no solo. Plantas muito sensíveis à salinidade também absorvem água do solo juntamente com os sais permitindo que haja toxidez na planta por excesso de sal absorvido. Este excesso promove desbalanceamentos no citoplasma resultando em danos principalmente na bordadura e no ápice das folhas, a partir de onde a planta perde, por transpiração, quase que tão somente água, havendo 139 nestas regiões acúmulo do sal translocado do solo para a planta, e obviamente intensa toxidez de sais. Sinalização bioquímica e melhoramento genético Já se pode conseguir cultivares de espécies de plantas originalmente sensíveis à salinidade mais tolerantes aos sais. A resposta das plantas aos estresses abióticos, nos quais inclui-se o estresse salino, envolve uma série de reações bioquímicas, que são reguladas por genes específicos. Para entender completamente a resposta biológica das plantas à salinidade, é preciso entender os mecanismos pelos quais as plantas “percebem” os sinais de estresse do meio e como elas respondem a esses sinais, através da transmissão de sinais às células, os quais ativarão os mecanismos de resposta adaptativa da planta. De acordo com Xiong et al. (2002), de um modo geral, a transcrição de um sinal começa com a percepção, seguido da geração de mensageiros secundários (fosfatos, inositol, dentre outras). Esses mensageiros secundários podem alterar as concentrações intracelulares de Ca, iniciando várias fosforilações de proteínas que, no final, resultam na síntese de proteínas diretamente envolvidas na proteção celular ou em fatores de transcrição que controlam grupos específicos de genes reguladores de estresse. Os produtos desses genes podem participar da geração de moléculas reguladoras, como o ácido abscísico (ABA), etileno e ácido salicílico. Um desses genes é o SOS1 (Wu et al., 1996), um gene altamente sensível ao Na e o responsável pelo fluxo Na+/ H+ que ocorre pela membrana celular, regulando, assim, a concentração de Na no interior das células (Shi et al., 2000). O avanço no conhecimento dos processos bioquímicos envolvidos na tolerância das plantas à salinidade possibilitam a inserção de novos genes ao código genético desses organismos, dando origem às variedades transgênicas tolerantes à salinidade. Pela introdução do gene AtNHX1 tem-se obtido aumento considerável na tolerância à salidade do milho (Yan et al., 2004), tomate (Zhang e Blumwald, 2001), festuca alta (Tian et al., 2006), dentre outras. Toxidez Os sais também podem apresentar toxidez específica originada de alguns íons como por exemplo cloreto, boro e sódio. Sousa (1995) observou que o feijoeiro apresenta danos maiores quando irrigado com altos níveis de cloreto de sódio comparado ao cloreto de cálcio. Também há diferenças entre cloreto e sulfato. Por exemplo, sabe-se que algumas plantas crescem menos quando sujeitas a 140 Nildo da S. Dias & Flávio F. Blanco níveis de sulfato do que aos mesmos níveis de cloreto. Alguns autores citados por Kramer (1983) também citam que o cloreto aumenta a suculência das plantas, enquanto o sulfato diminui. REFERÊNCIAS Almagro, A., Prista, C., Benito, B., Loureiro Dias, M.C., Ramos, J. Cloning and expression of two genes coding for sodium pumps in the salt-tolerant yeast Debaryomces hanseii. Journal of Bacteriology, v.183, p.3251-3255, 2001. Ayers, R. S. Quality of water for irrigation. Journal of Irrigation and Drainage Division ASCE, v.103, n.IR2, p.135-154, 1977. Ayers, R. S.; Westcot, D. W. A qualidade da água na agricultura. 2. ed. Campina Grande: UFPB. 1999. 153p. Estudos da FAO Irrigação e Drenagem, 29 Berstein, L. Crop growth and salinity. In: Drainage for Agriculture. van J. Schilfgaarde. Agronomy Journal 17, p.39-54, 1974. Blanco, F. F.; Folegatti, M. V. Doses de N e K no tomateiro sob estresse salino: III. Produção e qualidade de frutos. Revista Brasileira de Engenharia Agrícola e Ambiental, v.12, n.2, p.122-127, 2008. Blanco, F. F.; Folegatti, M. V. Doses de N e K no tomateiro sob estresse salino: I. Concentração de nutrientes no solo e na planta. Revista Brasileira de Engenharia Agrícola e Ambiental, v.12, n.1, p.26-33, 2008. Bresler, E.; McNeal, B. L.; Carter, D. L. Saline and sodic soils - Principles-Dynamics-Modeling. Springer-Verlag, New York, 1982. 236p. Cabanero, F. J., Martinez, V., Carvajal, M. Does calcium determine water uptake under saline conditions in pepper plants, or is it water flux, which determines calcium uptake. Plant Science, v.166, p.443-450, 2004. Chow, W. S.; Ball, M. C.; Anderson, J. M. Growth end photosynthetic responses of spinach to salinity: implications of K+ nutrition for salt tolerance. Australian Journal of Plant Physiology, v.17. p.563-578, 1990. Cuartero, J.; Muñoz, R. F. Tomato and salinity. Scientia Horticulturae, v.78, n.1/4, p.83-125, 1999. Elphick, C. H.; Sanders, D.; Maathuis, F. J. M. Critical role of divalent cations and Na efflux in Arabidopsis thaliana salt tolerance. Plant Cell Environment, v.24, p.733-740, 2001. Grattan, S. R.; Grieve, C. M. Salinity-mineral relations in horticultural crops. Scientia Horticulturae, v.78, p.127-157, 1999. Hawkins, H. J.; Lewis, O. A. M. Effect of NaCl salinity, nitrogen form, calcium and potassium concentration on nitrogen uptake and kinetics in Triticum aestivum L. cv. Gametoos. The New Phytologist, v.124, n.1, p.171-177, 1993. Kramer, P. J. 1983. Water relations of plants. New York: Academic Press, Inc. 489p. Lauchi, A.; Epstein, E. Mechanisms of salt tolerance in plants. California Agriculture, v. 38, n.10, p.18-21. 1984. Lima, L. A.; Grismer, M. E. Application of fracture mechanics to cracking of saline soils. Soil Science, v.158, n.2, 1994. Lima, L. A.; Grismer, M. E.; Nielsen, D. R. Salinity Effects on Yolo Loam Hydraulica Properties. Soil Science, v.150. 1990. Maas, E. V. Crop Tolerance. California Agriculture, v.36, n.10, p.20 -21, 1984. Maas, E. V.; Hoffman, G. J. Crop salt tolerance - Current assessment. Journal of irrigation and Drainage Division ASCE. v.103, n. IR2, p.115-134.1977. Mansour, M. M. F. 2003. Transport proteins and salt tolerance in plants. Plant Science, v.164, p.891-900, 2003. Miranda, J. R. P.; Carvalho, J. G.; Santos, D. R.; Freire, A. L. O.; Bertoni, J. C.; Melo, J. R. M.; Caldas, A. L. Silício e cloreto de sódio na nutrição mineral e produção de matéria seca de plantas de moringa (Moringa oleifera LAM.). Revista Brasileira de Ciência do Solo, v.26, n.4, p.957-965, 2002. Motoh, T.; Kairusmee, P.; Takahashi, E. Salt-induced damage to rice plants and alleviation effect of silicate. Soil Science and Plant Nutrition, v.32, n.2, p.295-304, 1986. Munns, R. Comparative physiology of salt and water stress. Plant, Cell and Enviroment, v.25, p.239-250, 2002. Munns, R.; James, R. A. Screening methods for salinity tolerance: a case study with tetraploid wheat. Plant Soil, v.253, n.02, p.201-218, 2003. Navarro, J. M.; Garrido, C.; Martinez, V.; Carvajal, M. Water relations and xylem transport of nutrients in pepper plants grown under two different salts stress regimes. Plant Growth Regulators, v.41, p.237-245, 2003. Pessarakli, M.; Tucker, T. C. Dry matter yield and nitrogen-15 uptake by tomatoes under sodium chloride stress. Soil Science Society of America Journal, v.52, n.3, p.698-700, 1988. Phills, B. R.; Peck, N. H.; MacDonald, G. E.; Robinson, R. W. Differential response of Lycopersicon and Solanum species to salinity. Journal of the American Society for Horticultural Science, v.104, n.3, p.349-352, 1979. Reed, D. W. Combating poor water quality with water purification systems. In: Reed, D.W. (ed.). Water, Media and Nutrition for Greenhouse Crops. Illinois: USA, Ball Publishing, 1996, p.51-67. Rhoades, J. D.; Kandiah, A.; Mashali, A. M. Uso de águas salinas para produção agrícola. Campina Grande: UFPB, 2000. 117p. Estudos FAO Irrigação e Drenagem, 48 Rubio, F.; Flores, P.; Navarro, J. M.; Martinez, V. Effects of Ca+2 K+ and cGMP on Na + uptake in pepper plants. Plant Science, v.165, p.1043–1049, 2003. Russo, D.; Bresler, E. Soil-water-suction relationships as affected by soil solution composition and concentration. p.287-296. In: Banin, A.; Kafkafi, U. (ed.). Agrochemicals in Soils. New York: Pergamon Press. 1980. 448p. Shannon, M. C.; Grieve, C. M. Tolerance of vegetable crops to salinity. Science Horticulture, v.78, p.5-38, 1999. Shi, H.; Ishitani, M.; Kim, C.; Zhu, J. K. The Arabidopsis thaliana salt tolerance gene SOS1 encodes a putative Na+/ H+ antiporter. Proceedings of the National Academy of Sciences, v.97, n.12, p.6896-6901, 2000. Sousa, M. R. de. Comportamento do feijoeiro (Phaseolus vulgaris L. CV Eriparza) submetido a diferentes níveis de salinidade da água de irrigação. Lavras: UFLA. 1995. 94p. Dissertação Mestrado Efeitos dos sais no solo e na planta Suhayda, C. G.; Giannini, J. L.; Briskin, D. P. Eletrostatic changes in Lycopersicon esculentum root plasma membrane resulting from salt stress. Plant Physiology, v.93, n.2, p.471-478, 1990. Tabatabaei, S. J.; Fakhrzad, F. Foliar and soil application of potassium nitrate affects the tolerance of salinity and canopy growth of perennial ryegrass (Lolium perenne var Boulevard). American Journal of Agricultural and Biological Sciences, v.3, n.3, p.544-550, 2008. Tester, M.; Davenport, R. Na+ tolerance and Na+ transport in higher plants. Annals of Botany, v.91, n.5, p.503-527, 2003. Tian, L.; Huang, C.; Yu, R.; Liang, R.; Li, Z.; Zhang, L.; Wang, Y.; Zhang, X.; Wu, Z. Overexpression AtNHX1 confers salt-tolerance of transgenic tall fescue. African Journal of Biotechnology, v.5, n.11, p.1041-1044, 2006. Valentine, R. C. Genetic engineering of salinity tolerant plants. California Agriculture, v.38, n.10, p.36-37, 1984. van Genuchten, M. Th. A closed-form equation for predicting the hydraulic conductivity of unsaturated soils. Soil Science Society of America Journal. v.44, p.892-898. 1980. Wu, S. J.; Ding, L.; Zhu, J. K. SOS1, a genetic lócus essential for salt tolerance and potassium acquisition. The Plant Cell, v.8, n.4, p.617-627, 1996. 141 Xiong, L.; Schumaker, K. S.; Zhu, J. K. Cell signaling during cold, drought, and salt stress. The Plant Cell, v.14, p.S165S183, 2002. suplemento. Yan, Y. X.; Fang, Y. A.; Wei, Z. K.; Ren, Z. J. Production and analysis of transgenic maize with improved salt tolerance by the introduction of AtNHX1 gene. Acta Botanica Sinica, v.46, n.7, p.854-861, 2004. Yoshida, K. Plant biotechnology genetic engineering to enhance plant salt tolerance. Jounal Bioscience Bioengineering, v.94, n.4, p.585-590, 2002. Zeng, L., Poss, J., Wilson, C., Draz, A. S. E., Grieve, C. M. Evaluation of salt tolerance in rice genotypes by physiological characters. Euphytica, v.129, p.281-292, 2003. Zhang, H. X.; Blumwald, E. Transgenic salt tolerant tomato plants accumulate salt in the foliage but not in the fruits. Nature Biotechnology, v.19, n.8, p.765-768, 2001. Zhu, J. K. Plant salt tolerance. Trends in Plant Science, v.6, p.66-71, 2001. Zhu, J. K. Salt and drought stress signal transduction in plants. Annual Review of Plant Biology, v.53, p.247-273, 2002. 10 Fisiologia e bioquímica do estresse salino em plantas José T. Prisco1 & Enéas Gomes Filho1 1 Universidade Federal do Ceará Introdução Retrospectiva histórica da fisiologia e bioquímica do estresse salino Seca fisiológica e ajustamento osmótico Estresse hídrico em plantas osmoticamente ajustadas Solutos responsáveis pelo ajustamento osmótico Hormônios e o estresse salino Ca2+ como meio para minorar os efeitos da salinidade (NaCl) Uso de culturas in vitro de células e tecidos Estresse oxidativo decorrente do estresse salino Estresse salino e a biologia molecular Efeitos da salinidade no crescimento e desenvolvimento Respostas fisiológicas e bioquímicas ao estresse salino Percepção e transdução do sinal do estresse salino Transdução do sinal do estresse salino Outras mudanças no metabolismo Aclimatação ao estresse Homeostase osmótica e homeostase iônica Homeostase bioquímica Desintoxicação Considerações finais Agradecimentos Referências Anexo 1. Glossário de termos usados Manejo da salinidade na agricultura: Estudos básicos e aplicados ISBN 978-85-7563-489-9 Fortaleza - CE 2010 144 José T. Prisco & Enéas G. Filho Fisiologia e bioquímica do estresse salino em plantas INTRODUÇÃO A maioria dos cientistas acredita que a solução de grande parte dos problemas da salinidade na produção agrícola depende da compreensão do que acontece com a Fisiologia e Bioquímica das Plantas cultivadas sob essas condições. Imagina-se que o esclarecimento dos mecanismos de tolerância e susceptibilidade à salinidade seja de fundamental importância para o desenvolvimento de cultivares que produzam economicamente sob condições de estresse. Além disso, esses conhecimentos poderão contribuir para o desenvolvimento de novas técnicas de manejo das culturas, que possibilitem aumentar a tolerância das plantas à salinidade. Apesar da importância desses estudos, as pesquisas nessa área só começaram a apresentar resultados promissores a partir da segunda metade do século passado. Pretende-se, neste capítulo, fazer uma retrospectiva histórica das descobertas mais relevantes dos efeitos da salinidade no crescimento e desenvolvimento das plantas e, com base em resultados experimentais, alguns deles obtidos em nosso laboratório, apresentar uma sequência de mudanças fisiológicas e bioquímicas que ocorrem quando uma planta é submetida ao estresse salino. RETROSPECTIVA HISTÓRICA DA FISIOLOGIA E BIOQUÍMICA DO ESTRESSE SALINO Existem registros na literatura que responsabilizam a salinidade pelos prejuízos causados à agricultura que remontam a mais de 3.000 anos (Läuchli & Grattan, 2007) e, apesar dos avanços científicos que ocorreram no mundo, esses danos ainda são evidentes na atualidade (Türkan & Demiral, 2008). Nos últimos 50 anos, a fisiologia e a bioquímica do estresse salino progrediram bastante, mas antes de analisar os resultados mais recentes, pretende-se apresentar e discutir as descobertas mais relevantes que ocorreram ao longo de mais de um século de estudos. Seca fisiológica e ajustamento osmótico No final do século XIX, o botânico alemão Schimper tentou explicar os efeitos do estresse salino como sendo resultantes da “seca fisiológica” (Schimper, 1898). De acordo com essa teoria, o excesso de sais acumulado na solução do solo seria responsável pela diminuição do potencial osmótico () e do potencial hídrico (w) da solução do solo e provocaria uma diminuição no gradiente de potencial hídrico (w) entre o solo e a planta, dificultando, portanto, a absorção de água pelas plantas. Como as plantas que crescem sob condições de estresse salino continuam transpirando, as diminuições na taxa de absorção de água seriam responsáveis pelo aparecimento de um déficit hídrico (Transpiração >> Absorção → Déficit hídrico). Segundo a teoria de Schimper, plantas cultivadas nessas condições, na realidade, sofreriam déficit hídrico, ou seja, “seca fisiológica”. Portanto, as reduções no crescimento deveriam ser proporcionais aos aumentos na concentração de sais da solução do solo (diminuição no e no w), ou seja, a diminuição do w da solução do solo, resultante do decréscimo do potencial mátrico () ou do , deveria acarretar reduções equivalentes no crescimento. Em outras palavras, a reação da planta à salinidade seria idêntica a da falta de água no solo e os efeitos do estresse salino nas plantas seriam os mesmos daqueles decorrentes do déficit hídrico. Fisiologia e bioquímica do estresse salino em plantas Essa teoria foi aceita durante muitos anos e recebeu suporte de vários pesquisadores do Laboratório de Salinidade do USDA (Ministério de Agricultura dos Estados Unidos). Eles demonstraram que as reduções na produção de grãos de Phaseolus vulgaris (Wadleigh & Ayers, 1945) e no crescimento de guayule (Wadleigh et al., 1946) eram proporcionais às reduções no w do solo. Isso ocorria quando as reduções no w do solo eram devidas ao aumento na concentração de sais da solução do solo (diminuição no ), à redução no conteúdo de água (diminuição no ) ou à combinação dos dois (diminuição de e de ). No início da década de 1960, Leon Bernstein, do Laboratório de Salinidade dos Estados Unidos, descobriu que plantas de Phaseolus vulgaris cultivadas sob condições de salinidade eram capazes de absorver íons e em decorrência disso, diminuir o de suas células. Fenômeno semelhante foi observado na Austrália, quando tomateiro foi cultivado sob condições de estresse salino (Slatyer, 1961). A consequência dessas observações seria a diminuição do w celular, de modo a garantir a manutenção do w do sistema solo-planta. A esse fenômeno deu-se o nome de “ajustamento osmótico”. Entretanto, devido à metodologia usada para determinação do (medições crioscópicas do suco celular), argumentava-se, à época, que os valores de do suco celular não correspondiam à realidade, pois a solução do vacúolo era contaminada com solutos do citosol (endosmose) ou era diluída com a água proveniente do apoplasto (efeito diluição). Para esclarecer isso, Bernstein realizou uma série de experimentos com algodão e pimentão, usando os métodos plasmolítico e crioscópico para determinação do das raízes. Teve o cuidado de levar em conta não só o efeito diluição como também a endosmose. Seus resultados mostraram, mais uma vez, que as plantas diminuíam o à medida que a salinidade do ambiente radicular aumentava e que isso se devia ao acúmulo de íons em seus tecidos. Se isso acontecesse, o w entre o ambiente radicular e a planta deveria ser mantido e, se a turgescência das células fosse também mantida, não se poderia pensar em “seca fisiológica” em plantas que se “ajustam osmoticamente” (Bernstein, 1961). A seca fisiológica foi também questionada por pesquisadores soviéticos, os quais demonstraram que quando plantas eram submetidas à mesma concentração salina, provocada por diferentes tipos de sais, por exemplo, concentrações isosmóticas de NaCl e de Na2SO4, as respostas eram diferentes, ou seja, a inibição do crescimento dependia do tipo de sal e não apenas do da rizosfera (Strogonov, 1964). Esses resultados, portanto, eram conflitantes com a teoria da “seca 145 fisiológica”, que também passou a ser questionada por cientistas de outros países (Flowers et al., 1977; Greenway & Munns, 1980). Estresse hídrico em plantas osmoticamente ajustadas Examinando-se a literatura, verifica-se que mesmo plantas consideradas como osmoticamente ajustadas podem apresentar sintomas que se assemelham àqueles induzidos pelo estresse hídrico (Bernstein & Hayward, 1958; Oertli, 1966). Cabe então a indagação: será que uma planta cultivada em ambiente salino e ajustada osmoticamente pode sofrer déficit hídrico? Quando e w da solução do solo são baixos, como no caso dos solos salinizados, a planta tende a absorver íons e há diminuições nos valores de e de w das raízes e das folhas. Essas diminuições nos w da planta possibilitam a manutenção do w no sistema solo-planta, ou seja, manutenção da capacidade de absorção de água pela planta. Acontece que o aumento da concentração de solutos nas raízes, especialmente os iônicos, pode provocar uma redução da permeabilidade do sistema radicular à água, ou seja, redução na condutividade hidráulica das raízes (O’Leary, 1969). A consequência disso é que, apesar da manutenção do w, a planta passa a absorver menos água e, se isso acontece em um ambiente de alta demanda evaporativa do ar, a taxa de transpiração da planta passa a ser mais elevada do que a taxa de absorção de água. O resultado disso é que o vegetal passa a sofrer déficit hídrico, que, eventualmente, levará à redução na taxa de fotossíntese e na taxa de crescimento (O’Leary, 1971; Prisco, 1980). Solutos responsáveis pelo ajustamento osmótico Os descobridores do ajustamento osmótico preconizaram que a diminuição no da planta devia-se, basicamente, ao acúmulo de íons nas células (Bernstein, 1961). Entretanto, isso conflitava com o fato de que enzimas isoladas do citosol, tanto de glicófitas como de halófitas, eram igualmente inibidas na presença de Na+ e de Cl- (Greenway & Munns, 1980) e isso só poderia acontecer se todos os íons, inclusive os tóxicos (Na+ e Cl-), estivessem compartimentalizados no vacúolo. Mesmo partindo do princípio de que os íons estariam concentrados no vacúolo, os baixos valores de e de w no ambiente externo à célula e no vacúolo iriam expor o citosol e as organelas nele mergulhadas a um estresse hídrico, pois estariam entre dois ambientes com w inferiores ao seu, (w)vac < (w)cito > (w)ext, ou seja, estariam perdendo água para o ambiente externo e para o vacúolo. Para equilibrar os potenciais hídricos do sistema ambiente externo, citosol + organelas nele mergulhadas e vacúolo, o citosol teria que acumular íons, 146 José T. Prisco & Enéas G. Filho solutos orgânicos ou ambos. O acúmulo de íons não seria factível, pois provocaria inibição das enzimas envolvidas no metabolismo. Portanto, a diminuição do e do w do citosol teria que ser feita, principalmente, à custa de solutos orgânicos que não inibissem o metabolismo, mesmo quando acumulados em elevadas concentrações (solutos compatíveis). A partir da década de 1970, foram identificados vários desses solutos compatíveis (Hellebust, 1976; Wyn Jones & Gorham, 1983; Bray et al., 2000; Sairam & Tyagi, 2004), sendo os mais conhecidos: açúcares (glicose, frutose, sacarose, trealose, rafinose); álcoois poliídricos (sorbitol, manitol, glicerol, arabinitol, pinitol, inositóis metilados); proteínas (peptídios de pequena massa molecular); aminoácidos e seus derivados (glutamato, aspartato, glicina, prolina, prolina-betaina, glicina-betaina e -alanina-betaina); ácidos orgânicos (oxaloacetato, malato); aminas terciárias (1,4,5,6-tetrahidro-2-metil-4carboxil piridamina); poliaminas (putrescina, cadaverina, espermidina, espermina); e compostos derivados de sulfonium (propionato de dimetil-sulfonio e colina-Osulfato). Infelizmente, ainda persistem muitas dúvidas sobre o papel metabólico e a importância fisiológica desses solutos compatíveis (Bray et al., 2000). Entretanto, pode-se afirmar que o ajustamento osmótico se faz à custa da absorção e acúmulo de íons (principalmente os tóxicos) no vacúolo e de íons não tóxicos e solutos orgânicos no citosol, compatíveis com a manutenção da atividade metabólica das células. Convém salientar que esse fenômeno é uma resposta da planta ao baixo w existente no ambiente externo, seja ele causado pelo excesso de sais na solução do solo (baixo ), seja pela carência hídrica (baixo ) ou por ambos (O’Leary, 1971). Hormônios e o estresse salino Durante a década de 1960, verificou-se que plantas submetidas a estresses abióticos mostravam decréscimo na atividade das citocininas (CITOC) presentes na solução exsudada das raízes para a parte aérea (Adreenko et al., 1964; Itai & Vaadia, 1965; Kuraishi et al., 1966; Burrows & Carr, 1969) e que essa diminuição repercutia no metabolismo e crescimento desta última (Ben-Zioni, et al., 1967; Itai et al., 1968). Verificou-se, posteriormente, uma correlação entre decréscimo na atividade das CITOC exsudadas das raízes e a aceleração da senescência dos tecidos foliares de plantas não ajustadas (O’Leary & Prisco, 1970) ou ajustadas osmoticamente (Prisco & O’Leary, 1972), depois de submetidas ao estresse salino. Sabe-se que estresses abióticos também induzem alterações nos níveis de ácido abscísico, ABA (Mizrahi et al., 1970), de brassinoesteróides, BR (Clouse & Sasse, 1998), de etileno e de giberelinas, Gib (Taiz & Zeiger, 2006). Entretanto, o que se tem observado ultimamente é que as pesquisas têm se concentrado apenas nos efeitos do ABA, como se ele fosse o único “hormônio envolvido nos estresses abióticos” (Taiz & Zeiger, 2006; Maathuis, 2007). Ca2+ como meio para minorar os efeitos da salinidade (NaCl) Durante a década de 1960, observou-se que a adição de Ca2+ ao ambiente radicular minimizava os efeitos deletérios do Na+ no estresse salino (LaHaye & Epstein, 1969). Isso foi atribuído ao fato de que o Na+, além de desestabilizar as membranas, que, por sua vez, são estabilizadas por Ca2+, compete com o K+ por sítios nos canais existentes nas membranas, provocando aumento na concentração de Na+ e diminuição na de K+ dentro das células, ou seja, diminuição da relação K+/Na+. Essas mudanças provocariam distúrbios metabólicos, com sérias implicações no crescimento e desenvolvimento das plantas estressadas pela salinidade. Portanto, esperavase que aplicações exógenas de Ca 2+ ao ambiente radicular minorassem os efeitos da salinidade no crescimento e desenvolvimento das plantas (LaHaye & Epstein, 1971). Infelizmente, isso não tem acontecido (Caines & Shenan, 1999; Sohan et al., 1999; Silva et al., 2003) e quando acontece, a resposta depende das condições ambientais em que a planta foi cultivada (Lacerda, 1995). Posteriormente, usando-se técnicas de biologia molecular em mutantes com diferentes tolerâncias à salinidade, chegou-se à conclusão de que o Ca2+ parece estar envolvido, não apenas na manutenção da integridade das membranas (Cramer et al., 1985), mas também no processo de “transdução do sinal” do local de percepção do estresse para o de síntese das proteínas codificadas pelos “genes do estresse”, os quais regulam o controle da “homeostase” da célula, do tecido ou do indivíduo (Türkan & Demiral, 2009). Uso de culturas in vitro de células e tecidos Os soviéticos usaram culturas de células e tecidos como meio de entender porque as halófitas toleravam o estresse salino enquanto que as glicófitas eram sensíveis à salinidade (Strogonov, 1974). A conclusão mais importante que eles chegaram foi a de que a tolerância à salinidade era uma característica do indivíduo, que não se mantinha quando suas células ou tecidos eram cultivados in vitro. Essa publicação e uma anterior (Strogonov, 1964) repercutiram em muitos Laboratórios do ocidente, principalmente em Israel (Universidade Hebraica de Jerusalém e Instituto do Negev), Austrália (CSIRO) e Grã Bretanha (Universidade de Sussex), que Fisiologia e bioquímica do estresse salino em plantas passaram a estudar a fisiologia comparada de halófitas e glicófitas, na esperança de encontrar marcadores fisiológicos ou bioquímicos que conferissem tolerância à salinidade e que não afetassem qualitativa nem quantitativamente a produção (Flowers et al., 1977). Infelizmente, os resultados obtidos pelos soviéticos foram relegados por muitos pesquisadores, especialmente americanos e canadenses, que àquela época estavam deslumbrados com a possibilidade de se produzir uma planta a partir de uma célula (Nabors, 1983; Salisbury & Ross, 1985). Achavam eles que células tolerantes à salinidade poderiam ser selecionadas e a partir delas se obter plantas tolerantes. Durante a década de 1970 e grande parte da de 1980, surgiram vários trabalhos que mostraram culturas de células com alta tolerância à salinidade (Nabors, 1983). Os autores, por razões óbvias, selecionaram espécies que possuíam protocolos mostrando como se obtinha uma planta, partindo-se de células ou de embrióides. Infelizmente, os resultados obtidos foram completamente diferentes do que eles esperavam. As plantas selecionadas dessa maneira não conservaram a tolerância das células que lhes deram origem e, mesmo aquelas que conseguiam aumentar a tolerância, perdiam suas características de valor econômico. Apesar disso, esses resultados negativos forneceram importantes informações metodológicas sobre culturas de células in vitro que possibilitaram progressos nos estudos de fisiologia do estresse salino. A partir da década de 1990, dois grupos de excelência nessa área, um na Universidade de Purdue e outro na Universidade do Arizona, ambos nos Estados Unidos, passaram a explorar essa metodologia nos estudos dos mecanismos de absorção e compartimentalização de íons sob condições de salinidade (Hasegawa et al., 2000). Essa metodologia também auxiliou no estudo do papel dos solutos compatíveis no ajustamento osmótico e na proteção das membranas e das enzimas presentes no citosol e nas organelas nele mergulhadas (Bray et al., 2000). Estresse oxidativo decorrente do estresse salino Durante a década de 1990, vários pesquisadores demonstraram que plantas produzem intermediários metabólicos, conhecidos como EROs (Espécies Reativas de Oxigênio) ou ROS (do inglês, Reactive Oxigen Species), tais como o peróxido de hidrogênio (H2O2) e os radicais livres superóxido (·O2-) e hidroxil (·OH), que são capazes de oxidar lipídios de membranas, desnaturar proteínas e reagir com DNA, provocando mutações. Sob condições normais de cultivo, as plantas neutralizam esses efeitos deletérios graças aos antioxidantes por elas produzidos. Quando a produção desses antioxidantes não 147 é suficiente para neutralizar as EROs, estas se acumulam e a planta passa a sofrer de estresse oxidativo. Isso também acontece em plantas submetidas a outros estresses abióticos (Scandalios, 2002; Azevedo Neto et al., 2008). Essas descobertas abriram novas perspectivas para os estudos de fisiologia e bioquímica da tolerância ao estresse salino (Azevedo Neto et al., 2008). Estresse salino e a biologia molecular Nos últimos 20 anos, foram observados inúmeros progressos na fisiologia e bioquímica do estresse salino, graças ao uso de mutantes de Arabidopsis thaliana e das técnicas de biologia molecular. Em decorrência disso, caminha-se para o estabelecimento de como as plantas percebem os agentes estressores, como ocorre a transdução do sinal de estresse do local de percepção para o local onde irão ocorrer as reações metabólicas responsáveis pela mudança no funcionamento celular e, finalmente, como ocorre a homeostase das células, tecidos e indivíduos que são submetidos ao estresse salino (Zhu, 2001, 2002, 2003; Türkan & Demiral, 2009). EFEITOS DA SALINIDADE NO CRESCIMENTO E DESENVOLVIMENTO De posse dessa análise retrospectiva do estudo da fisiologia e bioquímica do estresse salino e tentando escalonar as mudanças que ocorrem em uma escala temporal, pode-se afirmar que a salinidade altera, inicialmente, a absorção de água, de nutrientes e a permeabilidade das membranas (Figura 1). Essas alterações refletem no balanço hídrico e nutricional da planta e provocam mudanças no metabolismo, no balanço hormonal, nas trocas gasosas e na produção de EROs. Todas essas mudanças comprometem a expansão e divisão das células, o crescimento vegetativo e reprodutivo e a aceleração da senescência das folhas, que resultam na eventual morte da planta. Senescência foliar Crescimento vegetativo e reprodutivo Expansão e divisão celulares Balanço hormonal, trocas gasosas e produção de EROs Mudanças Mudançasno no metabolismo metabolismo Balanço hídrico e nutricional Absorção de água, nutrientes e permeabilidade de membranas SALINIDADE Figura 1. Mudanças na fisiologia das plantas em consequência da salinidade 148 José T. Prisco & Enéas G. Filho As mudanças no metabolismo e seus efeitos no crescimento e desenvolvimento da planta irão depender das interações que ocorrem entre as características do estresse e as características do vegetal que está sendo submetido ao estresse (Figura 2). Essa figura mostra que os efeitos da salinidade irão depender: da concentração e da composição iônica da solução que estará em contato com a rizosfera (Strogonov, 1964), da granulometria do solo (Boyko, 1966), do local da planta exposto ao estresse (raiz ou parte aérea), do modo como o estresse é aplicado (abrupto ou escalonado), da duração da exposição ao estresse e, finalmente, da interação do estresse salino com outros, de natureza biótica ou abiótica. Analisando-se as características do vegetal, pode-se afirmar que a tolerância à salinidade varia com a espécie, e dentro de uma mesma espécie, ela varia com o genótipo e o estádio de desenvolvimento em que a planta se encontra e se o estresse é imposto a uma célula, a um tecido ou a um órgão do indivíduo. As interações entre as características do estresse com as do vegetal podem resultar em tolerância ou susceptibilidade, ou seja, vida ou morte da planta. CARACTERÍSTICAS DO ESTRESSE CARACTERÍSTICAS DO VEGETAL RESPOSTA RESULTADO Concentração de sais Composição iônica Espécie Granulometria do solo Genótipo Tolerância VIDA Local e modo de aplicação Estádio de desenvolvimento Susceptibilidade MORTE Duração da exposição Célula, tecido ou órgão Interação com outros estresses Figura 2. Interações entre características do estresse salino, características do vegetal e a resposta da planta ao estresse (Adaptado de Bray et al., 2000) Essas interações complicam o estabelecimento de uma metodologia que possa ser considerada como ideal para os estudos da Fisiologia e Bioquímica do Estresse Salino. Portanto, o que se tem feito é tentar compatibilizar o que se pretende estudar com o que é possível fazer, em termos de condições de cultivo. Por essa razão, a maioria dos estudos tem sido realizada em: 1. sistemas hidropônicos cuja solução nutritiva contém NaCl, Na2SO4 ou uma mistura de sais; 2. solo ou vermiculita irrigados com soluções salinas de composição iônica e condutividade elétrica conhecidas; 3. gel de ágar ao qual são adicionados os sais; e, finalmente, 4. culturas de células, tecidos ou órgãos (nos estudos em que são investigados os efeitos do estresse em nível celular e molecular). Portanto, torna-se difícil comparar resultados obtidos em condições experimentais diferentes, do mesmo modo que se deve ter muito cuidado em extrapolar resultados obtidos com culturas de células, tecidos ou órgãos para a condição de planta inteira. Também não se deve esquecer que, nas condições de campo, a planta pode ser exposta simultaneamente a mais de um estresse. RESPOSTAS FISIOLÓGICAS E BIOQUÍMICAS AO ESTRESSE SALINO Apesar das dificuldades experimentais, tentar-se-á apresentar esquemas que generalizem, resumidamente, o que acontece quando uma planta é submetida ao estresse salino. A salinidade possui dois componentes que são responsáveis pelo estresse: um osmótico e outro iônico. O componente osmótico altera o balanço hídrico da planta, enquanto que o componente iônico é responsável pelos efeitos sobre o desbalanceamento nutritivo e pelos efeitos tóxicos dos íons (Läuchli & Grattan, 2007; Munns & Tester, 2008). A predominância de um desses fatores irá depender das características e condições do estresse, que serão discutidos mais adiante. De maneira geral, quando uma planta é exposta ao estresse, observa-se que sua resposta irá depender de uma sequência de reações que ocorrem desde a exposição ao estresse até que se possa perceber o efeito daquele estresse na planta (Figura 3). Estresse Percepção do sinal Transdução do sinal Processamento da Informação Mudanças Metabólicas Resposta Figura 3. Seqüência de reações que ocorrem quando uma planta é submetida a um estresse Em termos de tempo, essa sequência pode ocorrer em milissegundos, segundos, minutos, horas, semanas ou meses, dependendo das condições e características do estresse e da respostas que se está observando. Na maioria das situações, o órgão do vegetal que é exposto à salinidade em primeiro lugar é a raiz, exceto quando a planta é irrigada por aspersão com água salina ou quando está exposta à maresia. Nessas situações, a parte aérea passa a ser exposta em primeiro lugar. Percepção e transdução do sinal do estresse salino Baseando-se em resultados obtidos com leveduras, com culturas de células de plantas superiores e com Fisiologia e bioquímica do estresse salino em plantas mutantes de Arabidopsis thaliana, acredita-se que a nível celular a percepção seja feita pela membrana plasmática e nela estejam envolvidos receptores que detectam o componente osmótico e o componente iônico. Alguns detalhes do que acontece nessa etapa ainda são especulativos, mas sabe-se que existe mais de um sensor para esses sinais e que os caminhos de transdução desses sinais também variam. Para simplificar, serão mostrados os mais conhecidos. 149 um registro da percepção do estresse, que dará inicio a transdução do sinal de estresse (Figura 5). Perda da turgescência Volume celular (osmo-sensor) Retração da membrana Abertura de canais Despolarização da membrana e [Ca2+]cito Percepção do componente osmótico: Descobriu-se, em Arabidopsis thaliana, uma proteína na membrana plasmática que parece ser o osmo-sensor (receptor) do sinal do componente osmótico do estresse salino. Esta proteína, AtHK1 (do inglês, Arabidopsis thaliana Histidine Kinase 1), é constituída de um domínio quinase do tipo histidina e de outro, que funciona como regulador de resposta. A hiper-osmolaridade do meio externo induz uma perda de turgescência das células, que provoca mudanças de conformação da membrana plasmática e ativa o processo de autofosforilação de um resíduo de histidina (His) no domínio quinase da AtHK1. Posteriormente, se dá a transferência desse radical fosforil para um resíduo de aspartato (Asp), que pertence ao domínio regulador de resposta e que irá exercer sua ação via transdução desse sinal (Figura 4). [sais]ext Perda da turgescência Mudança conformacional em AtHK1 His domínioquinase ~PO4 (autofosforilação.) P Asp regulador da resposta P Asp His domínioquinase regulador da resposta Transdução do sinal Figura 4. Percepção do componente osmótico do estresse salino pela AtHK1, presente na membrana plasmática e início do processo de transdução do sinal (Adaptado de Urao et al., 1999) Outra maneira da célula perceber o estresse osmótico decorre do “efeito mecânico” que o excesso de sais no ambiente extracelular exerce sobre os canais iônicos existentes na membrana plasmática. Quando a célula perde água, ela diminui de volume e a membrana plasmática sofre mudanças de conformação, que facilitam a entrada de íons na célula, via canais iônicos, que funcionam como osmo-sensores. A entrada desses íons na célula provoca a despolarização da membrana plasmática e aumento na concentração de cálcio no citoplasma. Esse aumento na [Ca2+]cito funciona como Transdução do sinal Figura 5. Percepção do componente osmótico do estresse salino pelos canais iônicos presentes na membrana plasmática e início do processo de transdução do sinal (Adaptado de Urao et al., 1999) Essas duas maneiras de percepção do componente osmótico do estresse salino podem refletir na expressão gênica de enzimas envolvidas, por exemplo, na biossíntese de osmólitos (solutos compatíveis), os quais podem contribuir para o ajustamento osmótico do citosol + organelas, e de proteínas componentes das membranas, como a aquaporina (canal de água), que aumenta a capacidade de absorção de água das células. Sabe-se que o ABA está relacionado com algumas respostas da planta às variações de osmolaridade ocasionadas, por exemplo, pelo componente osmótico do estresse salino, no entanto, ainda não foi possível identificar os receptores desse hormônio vegetal (Fan et al., 2004; Wasilewska et al., 2008). Contudo, estudos recentes têm revelado algumas proteínas candidatas a esse papel e que a percepção ao ABA pode ocorrer tanto no nível extracelular quanto no intracelular (Fan et al., 2004; Maggio et al., 2006). Percepção do componente iônico: A descoberta dos mutantes de Arabidopsis thaliana possuidores de hipersensibilidade ao íon Na+, mutantes SOS (do inglês, Salt-Overly-Sensitive), possibilitou uma melhor compreensão, não só da percepção do componente iônico, como da transdução desse sinal do estresse. Sob condições normais (ausência de salinidade), as células vegetais mantêm um potencial eletroquímico através da membrana plasmática (j) da ordem de -140 mV (lado interno negativo). Isso se deve às diferenças em concentrações de íons dentro e fora das células, resultante do funcionamento das bombas de prótons (H+ATPases) da membrana. Do mesmo modo, a ação das bombas presentes no tonoplasto (H +-ATPases e H +PPases) faz com que a membrana vacuolar também esteja polarizada (j + 60 mV). 150 José T. Prisco & Enéas G. Filho Sob condições de salinidade, há um aumento da [Na+]ext, que favorece a penetração de cátions na célula. Assim, o Na+ pode penetrar passivamente, através de diferentes tipos de canais ou transportadores, os quais podem funcionar como sensores de Na +. Dentre os canais, destacam-se o NSCC (do inglês, NonselectiveCation-Channels), que transporta Na+ e K+ para dentro da célula, dependendo da concentração externa desses íons (se a [Na+] > [K+] → entra Na+ e quando a [Na+] < [K+] → entra K+) e o NORC (do inglês, NonselectiveOutward-Retifying-Channels), que não discrimina K+ de Na + . Neste caso, o NORC abre-se durante a despolarização da membrana, entretanto, sob condições de salinidade, quando a [Na+]ext > [K+]ext → entra Na+. Dentre os transportadores, destaca-se o simporte HKT1 (do inglês, High-affinity K + -Transporter 1,) que, dependendo da [Na+]ext, pode transportar: Na+/Na+, Na+/ K+, K+/K+, K+/Na+ e K+/H+, sendo considerado um dos sensores do estresse salino (Blumwald et al., 2000; Yamagushi & Blumwald, 2005; Türkan & Demiral, 2009). Nos últimos anos, uma proteína conectada a resíduos de arabino-galactanas, a SOS5, que está presente na parte externa da membrana plasmática também tem sido apontada como forte candidata para detectar [Na + ] ext (Mahajan et al., 2008; Türkan & Demiral, 2009). A despolarização decorrente da passagem do Na + para o citosol pode contribuir para a abertura de outros canais, tanto da membrana plasmática como do tonoplasto, permitindo a entrada de outros íons (Cl-, K+, etc), que contribuem para alterar a turgescência da célula (ajustamento osmótico). Outro aspecto importante é que os canais de Ca2+, que são dependentes do potencial eletroquímico da membrana, podem aumentar a [Ca 2+ ] cito , fato de grande relevância, porque ele é importante como sinal secundário de transdução (Figura 6). Já existem dados que mostram que quando as raízes são expostas a excesso de Na+ ocorre um aumento na [Na + ] e na [Ca 2+ ] no citosol das células do córtex radicular (Munns & Tester, 2008). O aumento na [Na+]cito, seguido pelo incremento na [Ca2+]cito pode ser visualizado na Figura 6. Transdução do sinal do estresse salino Após a percepção do sinal, há um aumento na [Ca2+]cito que funciona como um mensageiro secundário e inicia uma série de reações (cascata de sinalização) que serão responsáveis pelas mudanças no funcionamento das células. A essa “cascata de sinalização” deu-se o nome de transdução do sinal do estresse, que pode ser bastante complexa, envolvendo: proteínas, lipídios, hormônios vegetais, cálcio e espécies reativas de Receptores da membrana Ativa vias de sinalização [Na+] [Ca2+]cito Despolarização da membrana Abertura de canais de Ca2+ Transdução do sinal Figura 6. Percepção do componente iônico do estresse salino pelos canais e transportadores presentes na membrana plasmática e início do processo de transdução do sinal (Baseado em Tyerman & Skerret, 1999) oxigênio. As transduções mais conhecidas são: a sinalização SOS, já definida anteriormente; a das quinases protéicas do tipo MAPK (do inglês Mitogenic-ActivatedProtein-Kinases); a que envolve fosfolipídios; a dependente de cálcio/calmodulina; a sinalizada por ABA; e, finalmente, a sinalizada por H 2O2 (Taiz & Zeiger, 2006). Transdução do sinal osmótico: A transdução do sinal desencadeada pela percepção do componente osmótico do estresse salino pode ser classificada em duas rotas de sinalização distintas: a dependente de ABA e a independente de ABA (Taiz & Zeiger, 2006). Ambas as rotas levam à ativação de proteínas reguladoras (fatores de transcrição) que interagem com regiões específicas dos genes, denominadas promotores, resultando na indução ou repressão da expressão de um determinado gene. Na rota de sinalização dependente de ABA, os promotores dos genes regulados por este hormônio possuem uma sequência de seis nucleotídeos, denominada elemento de resposta ao ABA ou ABRE (do inglês, ABA Response Element), à qual se ligam os fatores de transcrição envolvidos nesse processo. Já na rota independente de ABA, os fatores de transcrição se ligam a outro tipo de elemento de regulação nos promotores, o elemento de resposta à desidratação ou DRE (do inglês, Dehydration Response Element). A rota independente de ABA pode também envolver a atuação direta de uma cascata de sinalização de MAPK (Taiz & Zeiger, 2006) (Figura 7). Em alguns genes que possuem o ABRE, pode haver também o DRE, o que leva à intensificação das respostas ao estresse, já que ambas as rotas estão presentes na transdução do sinal, sendo os íons Ca2+ os responsáveis pela interação entre essas vias de sinalização (Mahajan & Tujeta, 2005). Dentre os genes cuja expressão é induzida pelo estresse osmótico, através das vias mencionadas anteriormente, estão aqueles que codificam vários tipos de transportadores, proteínas reguladoras (fatores de transcrição, quinases protéicas e fosfatases) e proteínas Fisiologia e bioquímica do estresse salino em plantas Receptor do estresse osmótico Dependente de ABA Fatores de transcrição Independente de ABA Cascata de MAPK Expressão gênica alterada Figura 7. Transdução do sinal do componente osmótico do estresse salino através das vias dependente e independente de ABA (Adaptado de Taiz & Zeiger, 2006) envolvidas na tolerância ao estresse, tais como as enzimas do sistema antioxidativo e as que atuam na síntese dos solutos compatíveis. Já dentre os que são reprimidos, estão genes cujos produtos atuam no crescimento da célula, incluindo a parede celular, e que codificam algumas proteínas dos cloroplastos e da membrana plasmática (Cutler et al., 2010). Transdução do sinal iônico: Existem várias rotas de transdução do sinal iônico, mas aqui será descrita a via de sinalização SOS, porque é a melhor caracterizada e, segundo Türkan & Demiral (2009), já foi observada tanto em glicófitas (arroz, trigo e Arabidopsis thaliana) como em halófitas (Tellungiella halophyla e Populus euphratica). Como ilustrado na Figura 8, a percepção de ambos os componentes do estresse salino provoca um aumento na [Ca2+] cito (mensageiro secundário). Esse aumento é percebido pela proteína SOS3, que é o produto da transcrição do gene SOS3 e que faz parte de uma família de genes responsáveis pela hipersensibilidade ao sódio, encontrada em mutantes de Arabidopsis thaliana (Zhu, 2002). A proteína SOS3 liga-se ao íon cálcio, formando um complexo que irá interagir com uma proteína quinase do tipo histidina, a proteína SOS2. O complexo SOS3SOS2-PO4 (proteína SOS2 ativada) dirige-se para a membrana plasmática, a fim de ativar, via fosforilação, a proteína SOS1 que, depois de ativada (SOS1-PO4) passa a funcionar como antiporte Na+/H+, que transporta para o apoplasto o excesso de Na+ presente no citoplasma, ao mesmo tempo em que transporta H + para dentro do citosol. Portanto, este antiporte é fundamental para a manutenção da relação K + /Na + adequada para o metabolismo. Convém salientar que a proteína SOS2 151 ativada, também atua como ativador do antiporte Na+/H+ localizado no tonoplasto ou NHX1 (do inglês, Na +/H+ Exchanger Protein 1), que regula o nível de Na + citoplasmático ao compartimentalizá-lo no vacúolo. Além disso, SOS2 ativada regula a expressão gênica da proteína SOS1 e restringe a entrada de Na + para o citoplasma, através de seu efeito inibitório na atividade do transportador simporte HKT1, que se encontra na membrana plasmática. A proteína SOS2 ativada atua como regulador da [Ca2+]cito, através da modulação da atividade do transportador CAX1 (do inglês, Calcium Exchanger 1) existente no tonoplasto. Além desses papéis, a SOS2 ativada, também está envolvida na regulação da expressão do gene SOS4, cujo produto é uma quinase do piridoxal, responsável pela produção de piridoxal-5-fosfato, o qual contribui para a homeostase iônica da célula através da regulação de canais iônicos e transportadores (Turkan & Demiral, 2009). Estresse salino Cadeias polissacarídicas Componente Componente osmótico iônico Na+ SOS5 ? ABA P [Ca2+] ? AKT1 HKT1 SOS3 SOS2 Na+ SOS1 P Apoplasto Membrana plasmática Citosol H+ K+ Piridoxal-P Regulação da expressão gênica (p. ex., SOS1 e SOS4) H+ NHX1 H+ ATP Vacúolo Ca 2+ CAX1 Núcleo H+ V-ATPase e PPase H+ SOS5 Quinase do piridoxal-P Na + ADP + Pi Citosol Membrana plasmática Apoplasto Figura 8. Estresse salino e a via de sinalização SOS (Adaptado de Türkan & Demiral, 2009) Outras mudanças no metabolismo Como consequência das mudanças no metabolismo, iniciadas com a percepção e transdução do sinal de estresse, ocorrem alterações no balanço hormonal e na produção de EROs. Desbalanceamento hormonal: Sabe-se que CITOC, Gib, etileno e ABA podem ser sintetizados nas raízes e transportados para a parte aérea, onde afetam o crescimento e desenvolvimento (Weiss & Vaadia, 1965; Skene, 1967; Taiz & Zeiger, 2006). Por outro lado, as auxinas e os BR são sintetizados e exercem sua ação tanto nas raízes como na parte aérea (Taiz & Zeiger, 2006). Um fato que merece mais investigação é o de que os BRs parecem estar envolvidos no estresse salino (Clouse & Sasse, 1998), pois são capazes de minorar os efeitos do estresse na produtividade vegetal (Ikekawa & 152 José T. Prisco & Enéas G. Filho Zhao, 1991; Taiz & Zeiger, 2006). Os estresses hídrico e salino diminuem a atividade das CITOC e das Gib na parte aérea do vegetal ao mesmo tempo em que aumenta a atividade do ABA (Itai et al., 1968; Taiz & Zeiger, 2006). Essas mudanças foram associadas com o fechamento dos estômatos, a diminuição do crescimento e a aceleração da senescência das folhas de plantas submetidas a estresse hídrico ou salino (Prisco & O’Leary, 1972; Taiz & Zeiger, 2006) e todos os hormônios, acima mencionados, atuam nos caminhos de transdução do sinal de estresse e na expressão gênica (Hedden & Thomas, 2006). Mesmo sabendo das dificuldades experimentais encontradas quando se estudam os efeitos de balanços hormonais sobre plantas submetidas a estresse salino, os dados existentes sugerem que as mudanças no balanço hormonal estão mais próximas da realidade do que se atribuir a apenas um “hormônio do estresse”, o ABA (Taiz & Zeiger, 2006). Partindo dessa premissa, quando se descreve a sequência de mudanças fisiológicas e bioquímicas que ocorrem quando uma planta é submetida a estresse salino, os efeitos atribuídos ao ABA (Hirt & Shinozaki, 2004; Taiz & Zeiger, 2006) foram substituídos pelos efeitos devidos ao “desbalanceamento hormonal”. Isto será discutido mais adiante. Produção de EROs: O estresse salino provoca acúmulo de espécies reativas de oxigênio (EROs), que são responsáveis pelo estresse oxidativo. Como a salinidade é o agente estressor primário, o estresse oxidativo é considerado como um estresse secundário. O termo EROs é aplicado às espécies químicas intermediárias, que aparecem durante a redução do O2 a H 2O (O 2 + 4e - + 4H + → H2O) como mostra a Figura 9. e- e- e- eH+ 2 H+ Oxigênio Superóxido Peróxido de hidrogênio Hidroxil Água Figura 9. Espécies químicas intermediárias que aparecem durante a redução do O2 a H2O (O2 + 4e- + 4H+ → H2O). São consideradas espécies reativas de oxigênio (EROs): radical livre superóxido, peróxido de hidrogênio e o radical livre hidroxil (modificado de Scandalios, 2002) Reações produtoras de EROs ocorrem nos cloroplastos, mitocôndrias e peroxissomos durante a fotossíntese, respiração e fotorrespiração, respectivamente (Figura 10). Além do que é produzido nessas organelas, pode também haver formação de ‘ EROS na membrana plasmática (Slesak et al., 2007). A fotossíntese é o processo metabólico que mais produz EROs nas células vegetais (Apel & Hirt, 2004; H2 O O2 e- Ribulose1,5-bifosfato NADP+ Fotossistema II e- Fotossistema I e- Ferredoxina O2 e- Cloroplasto HO· e- e- H2 O2 NADPH O2 3-Fosfoglicerato 2-Fosfoglicolato O2 ·- Fumarato e- NADH e- Desidrogenases do NAD(P)H Complexo I eO2 e- e- Ubiquinona O2 ·- e- Complexo II e- e- Complexo III eO2 Succinato e- Glicolato O2 Complexo IV eH2 O O2 H2 O2 Glioxalato H2 O2 eHO· Mitocôndria Peroxissomo Figura 10. Principais sítios de produção de espécies reativas de oxigênio (EROs) nas células vegetais (Adaptado de Apel & Hirt, 2004) Miller et al., 2010); além da produção de H 2O2 nos peroxissomos durante a fotorrespiração, também pode haver a fotorredução direta do O2 a superóxido (·O2-) pelos elétrons provenientes dos componentes da cadeia transportadora de elétrons associados ao fotossistema I, nos cloroplastos (Figura 10). Já na mitocôndria, os sítios principais de produção de EROs são os complexos I e III da cadeia transportadora de elétrons, nos quais os elétrons são doados ao O2, gerando ·O2-, o qual pode sofrer redução e levar à produção das demais EROs (Apel & Hirt, 2004; Miller et al., 2010). O superóxido, o peróxido de hidrogênio e o hidroxil são altamente reativos e podem lesionar membranas, ácidos nucléicos e proteínas. Nas condições normais, as plantas não sofrem esses danos porque há um equilíbrio entre a produção de EROs e a de antioxidantes (enzimas e outros compostos orgânicos). Entretanto, sob condição de estresse, há o acúmulo de EROs, pois nessas condições a planta não produz antioxidantes suficientes para neutralizar os efeitos deletérios desses poderosos oxidantes. Recentemente, esse estresse secundário tem recebido muita atenção dos pesquisadores, tendo em vista que a tolerância à salinidade parece estar correlacionada com a atividade antioxidante dos diferentes órgãos do vegetal (Azevedo Neto et al., 2008). ACLIMATAÇÃO AO ESTRESSE Enquanto essas alterações no metabolismo acontecem, as plantas realizam ajustes metabólicos, estruturais e fisiológicos a fim de conseguir seu equilíbrio homeostático (osmótico, iônico e bioquímico), bem como a desintoxicação de suas células (eliminação das EROS e exclusão e compartimentalização de íons tóxicos). Esses ajustes são sincronizados e obedecem a uma sequência, que no final pode resultar em tolerância ou Fisiologia e bioquímica do estresse salino em plantas susceptibilidade ao estresse, como será visto mais adiante. Homeostase osmótica e homeostase iônica A homeostase osmótica e a iônica podem ser tratadas simultaneamente, uma vez que são interdependentes. A primeira é o resultado do ajustamento osmótico, descrito anteriormente, e envolve a absorção de íons (Bernstein, 1961; Slatyer, 1961), sua compartimentalização em certos tecidos (Munns & Tester, 2008) e organelas das células, associadas ao acúmulo de solutos orgânicos no citoplasma. Nas condições consideradas fisiológicas, a concentração de K+ no citosol varia de 100-200 mM, enquanto que a de Na+ está na faixa de 0-10 mM. Para que se tenha uma idéia da importância fisiológica da manutenção de uma relação K+/Na+ alta no citosol, a síntese de proteínas depende de uma concentração de K+ entre 100-150 mM e é inibida quando a concentração de Na+ ultrapassa 100 mM (Blumwald et al., 2000). Além disso, o K + é ativador de enzimas importantes do metabolismo, enquanto que o Na+ é inibidor da atividade de várias enzimas citoplasmáticas. Portanto, a homeostase iônica e a osmótica devem envolver exclusão de Na+ do citosol para o meio externo e sua compartimentalização no vacúolo, a fim de manter uma alta relação K +/Na + e o balanço hídrico entre meio externo, citosol + organelas nele mergulhadas e vacúolo. Para se compreender os mecanismos de exclusão e compartimentalização de Na+, precisa-se ter em mente que, em condições normais, as membranas plasmáticas das células vegetais estão polarizadas, devido às diferenças em concentrações de íons dentro e fora das células, resultante do funcionamento das bombas de prótons (H + -ATPases) da membrana. No caso do vacúolo, existem no tonoplasto, além das bombas de próton, as pirofosfatases (H+-PPases), que bombeiam H+ do citosol para o interior do vacúolo, de modo que essa membrana também fica polarizada. As mudanças que ocorrem durante a homeostase iônica têm forte repercussão na homeostase osmótica. A concentração de íons (tóxicos ou não), ácidos orgânicos e, em menor proporção, de outros compostos orgânicos contribui para a redução do e do w dos vacúolos. Com relação ao que acontece no citoplasma, a fim de que seja mantido o equilíbrio osmótico entre apoplasto, citosol + organelas nele mergulhadas e vacúolo, pode-se afirmar que se concentram neste compartimento celular, além dos íons não tóxicos, como K + , os solutos compatíveis. Estes últimos possuem baixa massa molecular, alta solubilidade em água e não possuem carga líquida em pH neutro. Essas características permitem que 153 eles provoquem redução do no citosol + organelas nele mergulhadas sem inibir as reações metabólicas. Além disso, eles são hidrofílicos e podem desempenhar papel protetor da estrutura das proteínas citoplasmáticas e daquelas associadas às membranas (Botela et al., 2005). Outra função desses osmólitos é a de proteção das macromoléculas da célula contra a ação deletéria das EROs (Hasegawa et al., 2000; Zhu, 2001). Homeostase bioquímica A homeostase bioquímica é bastante complexa, pois envolve todas as reações do metabolismo, ou seja, representa os ajustes metabólicos necessários para que o organismo possa manter-se funcional, a despeito do aumento na concentração de íons que ocorre no ambiente externo. Durante esse processo, a atividade de certas enzimas é aumentada, a de outras é diminuída e novas enzimas podem também ser sintetizadas. Tudo isso requer um controle coordenado da percepção e transdução do sinal do estresse e da síntese e degradação das proteínas. Isso pode ser visualizado quando se compara, quantitativa e qualitativamente, as proteínas solúveis presentes em determinado órgão de uma planta que foi submetida ao estresse com outra cultivada sob condições normais (Figuras 11 e 12). pI 4,0 Mr (kDa) 7,0 4,0 pI 7,0 66 45 36 29 24 20 14,2 NaCl a 150 mM ( 15 dS.m-1 ) Controle Total de 358 proteínas 91 sofreram alterações 49 aumentaram 36 diminuíram 04 desapareceram 02 sintetizadas de novo Figura 11. Proteínas solúveis de folhas de plântulas de cajueiro anão-precoce irrigadas com solução nutritiva (controle) e com solução nutritiva contendo NaCl a 150 mM (Abreu et al., 2008) Nos últimos anos foram identificados vários RNAs pequenos, que se formam em consequência de estresses abióticos e foram estabelecidos os seus papéis no estresse oxidativo, no acúmulo de compostos orgânicos, que, além de contribuírem para o ajustamento osmótico funcionam como osmo-protetores e, finalmente, no silenciamento pós-transcricional de certos genes (Chinnusamy et al., 2007; Türkan & Demiral, 2009). 154 José T. Prisco & Enéas G. Filho Controle 22 Estresse Controle Estresse 22 Aumento 23 23 21 21 Diminuição Desaparecimento 18 19 18 19 Síntese de novo Figura 12. Aumento, diminuição, desaparecimento e síntese de novo de proteínas solúveis de folhas de plântulas de cajueiro anão-precoce irrigadas com solução nutritiva (controle) e com solução nutritiva contendo NaCl a 150 mM (estresse), obtidas a partir das eletroforeses bidimensionais (Abreu et al., 2008) percepção do sinal do estresse até a aclimatação das plantas à salinidade. Já está bem estabelecido que as raízes da planta percebem os dois componentes da salinidade: o osmótico e o iônico, sendo o local de percepção mais provável a membrana plasmática. Como resultado da percepção desses componentes, produz-se um ou mais mensageiros secundários que iniciarão o processo de transdução do sinal. Na parte final dessa sequência, observa-se a homeostase (osmótica, iônica e bioquímica) e a desintoxicação. O equilíbrio ou desequilíbrio das diferentes homeostases resultará em plantas tolerantes ou susceptíveis ao estresse salino. Componente Osmótico Componente Iônico Salinidade Percepção e Transdução do Sinal do Estresse Fitormônios desbalanceados Alterações Metabólicas Produção de EROs Aclimatação Desintoxicação O processo de desintoxicação envolve a exclusão dos íons tóxicos do citoplasma, que foi vista anteriormente, e a remoção sincronizada de EROs nos diferentes compartimentos celulares, que é feita por antioxidantes de natureza enzimática ou não-enzimática a fim de que a planta não sofra estresse oxidativo. Os principais antioxidantes celulares, bem como sua localização subcelular e as EROs alvo estão listados na Tabela 1. CONSIDERAÇÕES FINAIS A Figura 13 resume o que foi discutido anteriormente, mostrando uma sequência de etapas que vão desde a Homeostase Osmótica Homeostase Iônica Relações Hídricas Equilibradas Níveis normais de EROs e de íons tóxicos Tolerância Nutrição Equilibrada Homeostase Bioquímica Desintoxicação Desbalanceamento das Relações Hídricas Excesso de EROs e Íons Tóxicos Desbalanceamento Nutricional Sensibilidade Figura 13. Proposta para a seqüência de mudanças fisiológicas e bioquímicas que ocorrem quando plantas são submetidas a estresse salino (Modificado de Azevedo-Neto et al., 2008) Tabela 1. Tipos, natureza e locais de atuação de antioxidantes dentro da célula (Adaptado de Mittler (2002) Mecanismo Antioxidante Enzima ou Composto Orgânico Local na Célula EROs Dismutase do Superóxido Cloroplasto Citosol Mitocôndria O2(SOD – EC 1.15.1.1) Peroxissomo Apoplasto Peroxidase do Ascorbato Cloroplasto Citosol Mitocôndria H2O2 (APX – EC 1.11.1.11) Peroxissomo Apoplasto Catalase Peroxisomo H2O2 (CAT – EC 1.11.1.6) Enzimático Peroxidase da Glutationa Citosol H2O2 e ROOH (GPX – EC 1.11.1.9) Peroxidases Parede Citosol Vacúolo H2O2 (POD – EC 1.11.1.7) Peroxidase da Tiorredoxina Parede Citosol Mitocôndria H2O2 e ROOH (TPX – EC 1.11.1) Cloroplasto Citosol Mitocôndria Ácido Ascórbico O2- e H2O2 Peroxissomo Apoplasto Cloroplasto Citosol Mitocôndria Glutationa H2O2 Não Enzimático Peroxissomo Apoplasto Membranas -Tocoferol O2- e ROOH Carotenóides Cloroplasto O2- Fisiologia e bioquímica do estresse salino em plantas Apesar do progresso científico no campo da fisiologia e bioquímica de plantas submetidas ao estresse salino, pouco se conseguiu em termos de produção de genótipos mais tolerantes à salinidade e que produzam economicamente. Os resultados obtidos em laboratório e casa de vegetação com a superexpressão de genes que codificam para antiportes responsáveis pela exclusão e compartimentalização de Na+ (Apse et al., 1999) e pela síntese de alguns solutos compatíveis (Hmida-Sayari et al., 2005) não se repetiram em condições de campo. A tolerância ao estresse salino, por ser dependente da expressão coordenada e sincronizada de vários genes, não pode ser conseguida com a simples transferência ou superexpressão de um ou dois genes. Além disso, os estudos sobre tolerância em condições de campo são bem mais complexos e requerem o trabalho coordenado de fisiologistas, geneticistas, especialistas em solo e em engenharia de irrigação. Nos últimos anos, se tem trabalhado tanto em laboratório como em condições de campo, utilizando-se técnicas do melhoramento tradicional e da engenharia genética, visando à obtenção de cultivares mais tolerantes ao estresse salino. Os resultados obtidos com arroz (Li & Xu, 2007), trigo (Munns & Richards, 2007), milho (Bänziger & Araus, 2007), cevada (Li et al., 2007), tomateiro (Fooland, 2007), mandioca (Setter & Fregene, 2007), batata (Byun et al., 2007), soja (Pathan et al., 2007), algodão (Lubbers et al., 2007), espécies arbóreas (Bem-Hayyim & Moore, 2007; Griplet et al., 2007) e forrageiras (Zhang & Wang, 2007) são promissores, mas até que se consiga o que se espera obter, o caminho a percorrer ainda é longo. No que se refere ao manejo do solo e da água, podese afirmar que em determinadas situações o uso de lavagem, de correção química do solo e de métodos de irrigação mais apropriados para uso de águas salobras algumas vezes têm se mostrado eficazes. Como foi visto anteriormente, o estresse salino induz ao acúmulo de H 2 O 2 e segundo alguns autores o peróxido de hidrogênio pode desempenhar papeis diferentes, dependendo da concentração em que ele se encontra no tecido: em baixas concentrações ele pode funcionar como um sinal para aclimatação ao estresse e em concentração alta, ele funciona como indutor da morte programada das células (Dat, 2000; Van Breusegem et al., 2001). Resultados recentes demonstram a existência de várias isoenzimas antioxidantes que variam de acordo com o local de produção e remoção das EROs (Miller et al., 2010). Isso nos leva a sugerir que os estudos nessa área deveriam ser feitos no nível de organelas e não, de planta ou órgão, a fim de que se tenha um quadro mais claro do processo de desintoxicação. Apesar disso, o pré-tratamento de 155 plantas com peróxido de hidrogênio, na concentração adequada, aumentou a tolerância à salinidade em arroz (Uchida et al., 2002) e em um genótipo de milho sensível ao estresse (Azevedo Neto et al., 2005). Também o prétratamento de sementes de trigo com H2O2 acelerou a germinação e aumentou a tolerância das plantas à salinidade (Wahid et al., 2007). A indução dessa tolerância precisa ser melhor investigada em condições de campo, pois poderá resultar em uma prática de manejo a ser usada, visando minorar os efeitos deletérios do estresse salino no crescimento e produção das culturas. Como conclusão final, pode-se afirmar que a complexidade dos problemas de salinidade necessita de mais estudos básicos sobre fisiologia e bioquímica do estresse, mas para que eles possam produzir os resultados práticos que se deseja, precisam ser acoplados aos programas de pesquisa em melhoramento genético, em solos e em engenharia de irrigação. Não se pode continuar trabalhando em compartimentos estanques - o solo, a água e a planta – deve-se enfatizar a abordagem que envolva o sistema solo-água-planta. AGRADECIMENTOS Ao CNPq, a CAPES, e a FUNCAP, que direta ou indiretamente financiaram parte das pesquisas aqui relatadas. Aos nossos colegas dos Departamentos de Bioquímica e Biologia Molecular e de Engenharia Agrícola da UFC e aos nossos alunos, especialmente Elton Camelo Marques e Carlos Eduardo Braga de Abreu pela ajuda que deram na preparação desta revisão. REFERÊNCIAS Abreu C. E. B.; Prisco, J. T.; Nogueira, A. R. C.; Bezerra, M. A.; Lacerda, C. F.; Gomes Filho, E. Physiological and biochemical changes occurring in dwarf-cashew seedlings subjected to salt stress. Brazilian Journal of Plant Physiology, v.20, p.105-118, 2008. Adreenko, S. S.; Potapor, N. G.; Kosulina, L. G. The effect of sap from maize plants grown at various pH levels on growth of carrot callus. Botanical Science: Proceedings of the Academy of Sciences of the URSS (English translation), v.35, p.155-156, 1964. Apel, K.; Hirt, H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, v.55, p.373-399, 2004. Apse, M. P.; Aharon, G. S.; Snedden, W. A.; Blumwald, E. Salt tolerance conferred by overexpression of a vacuolar Na+/ H+ antiport in Arabidopsis. Science, v.285, p.1256-1258, 1999. 156 José T. Prisco & Enéas G. Filho Azevedo-Neto, A. D.; Gomes-Filho, E.; Prisco, J. T. Salinity and oxidative stress. In: Khan, N. A.; Singh, S. (ed.). Abiotic stress and plant responses. New Delhi: I.K. International, 2008. cap.4, p.57-82. Azevedo Neto, A. D.; Prisco, J. T.; Eneas-Filho, J.; Medeiros, J.-V. R.; Gomes-Filho, E. Hydrogen peroxide pretreatment induces salt-stress acclimation in maize plants. Journal of Plant Physiology, v.162, p.1114-1122, 2005. Bänziger, M.; Araus, J.-L. Recent advances in breeding maize for drought and salinity stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.531-564. Ben-Hayyim, G.; Moore, G. A. Recent advances in breeding citrus for drought and salinity stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.627-642. Ben-Zioni, A.; Itai, C.; Vaadia, Y. Water and salt stresses, kinetin and protein synthesis in tobacco leaves. Plant Physiology, v.42, p.362-365, 1967. Bernstein, L. Osmotic adjustment of plants to saline media. I. Steady state. American Journal of Botany, v.48, p.909-918, 1961. Bernstein, L.; Hayward, H. E. Physiology of salt tolerance. Annual Review of Plant Physiology, v.9, p.25-46, 1958. Blumwald, E.; Aharon, G. S.; Apse, M. P. Sodium transport in plant cells. Biochimica et Biophysica Acta, v.1465, p.140151, 2000. Botela, M. A.; Rosado, A.; Bressan, R. A.; Hasegawa, P. M. Plant adaptive responses to salinity stress. In: Jenks, M. A.; Hasegawa P. M. (ed.). Plant abiotic stress. Ames: Blackwell Publishing Ltd, 2005. p.37-70. Boyko, H. Salinity and aridity: new approaches to old problems. Monographiae Biologicae. Vol. XVI, The Hague: W. Junk Publishers, 1966. 408p. Bray, E. A.; Bailey-Serres, J.; Weretilnyk, E. Responses to abiotic stress. In: Buchanan, B. B.; Gruissem, W.; Jones, R. L. (ed.). Biochemistry and molecular biology of plants. Rockville: American Society of Plant Physiology, 2000. p.1158-1203. Burrows, W. F.; Carr, D. J. Effect of flooding the root system of sunflower plants on the cytokinin content in xylem sap. Physiologia Plantarum, v.22, p.1105-1112, 1969. Byun, M. O.; Kwon, H. B.; Park, S. C. Recent advances in genetic engineering of potato crops for drought and saline stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.713-738. Caines, A. M.; Shenan, C. Interactive effects of Ca2+ and NaCl salinity on the growth of two tomato genotypes differingin Ca2+ use efficiency. Plant Physiology and Biochemistry, v.37, p.569-576, 1999. Chinnusamy, V.; Zhu, J; Zhou, T.; Zhu, J. K. Small RNAs: big role in abiotic stress tolerance of plants. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.223-260. Clouse, S. D.; Sasse, J. M. Brassinosteroids: essential regulators of plant growth and development. Annual Review of Plant Physiology and Plant Molecular Biology, v.49, p.427-451, 1998. Cramer, G. R.; Läuchli, A.; Polito, V. S. Displacement of Ca2+ by Na + from the plasmalemma of root cells. A primary response to salt stress? Plant Physiology, v.79, p.207-211, 1985. Cutler, S. R.; Rodriguez, P. L.; Finkelstein, R. R.; Abrams, S. R. Abscisic acid: emergence of a core signaling network. Annual Review of Plant Biology, v.61, p.651-679, 2010. Dat, J.; Vandenabeele, S.; Vranová, E.; von Montagu, M.; Inzé, D.; van Breusegen, F. Dual action of the active oxygen species during plant stress responses. Cell Molecular Life Science, v.57, p.779-795, 2000. Fan, L. M.; Zhao, Z.; Assmann, S. M. Guard cells: a dynamic signaling model. Current Opinion in Plant Biology, v.7, p.537-546, 2004. Flowers, T. J.; Troke, P. F.; Yeo, A. R. The mechanism of salt tolerance in halophytes. Annual Review of Plant Physiology, v.28, p.89-121, 1977. Fooland, M. R. Current status of breeding tomatoes for salt and drought tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.713-738. Greenway, H.; Munns, R. Mechanism of salt tolerance in nonhalphytes. Annual Review Plant Physiology, v.31, p.149-190, 1980. Griplet, J.; Deluc, L. G.; Cramer, G. R.; Cushman, J. C. Integrating functional genomics with salinity and water deficit stress responses in wine grape. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.643-668. Hmida-Sayari, A.; Gargouri-Bouzid, R.; Bidani, A.; Jaoua, L.; Savouré, A.; Jaoua, S. Overexpression of 1-pyrroline-5carboxylate synthetase increases proline production and confers salt tolerance in transgenic potato plants. Plant Science, v.169, p.746-752, 2005. Hasegawa, P. M.; Bressan, R. A.; Zhu, J.-K.; Bohnert, H. J. Plant cellular and molecular responses to high salinity. Annual Review of Plant Physiology and Molecular Biology, v.51, p.463-499, 2000. Hedden, P.; Thomas, S. G. (ed.). Plant hormone signaling. Oxford: Blackwell Publishing Ltda., 2006. 346p. Hellebust, J. A. Osmoregulation. Annual Review of Plant Physiology, v.27, p.485-505, 1976. Hirt, H.; Shinozaki, K. Plant salt tolerance. In: Hirt, H.; Shinozaki K. (ed.). Plant responses to abiotic stress. Heidelberg: Springer-Verlag, 2004. p.241-270. Ikekawa, N.; Zhao, Y. Application of 24-epibrassinolide in agriculture. In: Cutler, H. G.; Yokota, T.; Adam, G. (ed.). Brassinosteroids: chemistry, bioactivity, and applications. Washington: American Chemical Society, 1991. p.280-291. Itai, C.; Richmond, A.; Vaadia, Y. The role of root cytokinins during water and salinity stress. Israel Journal of Botany, v.17, p.187-193, 1968. Fisiologia e bioquímica do estresse salino em plantas Itai, C.; Vaadia, Y. Kinetin-like activity in root exudate of water stressed sunflower plants. Physiologia Plantarum, v.18, p.941-944, 1965. Kuraishi, S. T.; Tezuka, T.; Ushijima, T.; Tazaki, T. Effect of cytokinins on frost hardiness. Plant and Cell Physiology, v.7, p.705-706, 1966. Lacerda, C. F. Efeitos da salinidade no desenvolvimento e composição mineral de feijão-de-corda (Vigna unguiculata (L.) Walp.) e utilização de Ca2+ como meio de minorar tais efeitos. Fortaleza: UFC, 1995. 87p. Dissertação Mestrado LaHaye, P. A.; Epstein, E. Salt toleration by plants: enhancement with calcium. Science, v.166, p.395-396, 1969. LaHaye, P. A.; Epstein, E. Calcium and salt tolerance by bean plants. Physiologia Plantarum, v.25, p.213-218, 1971. Läuchli, A.; Grattan, S. R. Plant growth and development under salinity stress. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.1-32. Li, Z. K.; Xu, J. L. Breeding for drought and salt tolerant rice (Oryza sativa L.): progress and perspectives. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.531-564. Li, G.; Zhang, G.; Lance, R. Recent advances in breeding barley for drought and saline stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.603-626. Lubbers, E. L.; Chee, P. W.; Saranga, Y.; Paterson, A. H. Recent advances and future perspective in molecular breeding of cotton for drought and salinity stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.775-796. Maathuis, F. J. M. Root signaling in response to drought and salinity. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.317331. Maggio, A.; Zhu, J.-K.; Hasegawa, P. M.; Bressan, R. A. Osmogenetics: Aristotle to Arabidopsis. The Plant Cell, v.18, p.1542-1557, 2006. Mahajan S.; Pandey, G. K.; Tuteja, N.; Calcium and salt stress signaling in plants: shedding light on SOS pathway. Archives of Biochemistry and Biophysics, v.471, p.146-158, 2008. Mahajan S.; Tuteja, N. Cold, salinity and drought stresses: an overview. Archives of Biochemistry and Biophysics, v.444, p.139-158, 2005. Miller, G.; Suzuki, N.; Ciftci-Yilmaz, S.; Mittler, R. Reactive oxygen species homeostasis and signaling during drought and salinity stresses. Plant, Cell and Environment, v.33, p.453-467, 2010. Mittler, R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, v.7, p.405-410, 2002. Mizrahi, Y.; Blumenfe, A.; Richmond, A. E. Abscisic acid and transpiration in leaves in relation to osmotic root stress. Plant Physiology, v.46, p.169-171, 1970. 157 Munns, R.; Richards, R. A. Recent advances in breeding wheat for drought and salt stress. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.565-586. Munns, R.; Tester, M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, v.59, p.651-681, 2008. Nabors, M. W. Increasing the salt and drought tolerance of crop plants. In: Randall, D. D. (ed.). Current topics in plant biochemistry and physiology. vol. 2. Columbia: University of Missouri Press, 1983. p.165-184. Oertli, J. J. Effect of external salt conventrations on water relations in plants. II. Effect of the osmotic differential between external medium and xylem on water relations in the entire plant. Soil Science, v.102, p.285-263, 1966. O’Leary, J. W. The effect of salinity on the permeability of roots to water. Israel Journal of Botany, v.18, p.1-9, 1969. O’Leary, J. W. Development and reversal of plant responses to salinity and water stress. In: Kreitlow, K. W.; Hart, R. H. (cords). Plant Morphogenesis as the Basis for Scientific Management of Range Resources. Proceedings of Workshop USA-Australia Rangeland Panel, Washington: ARS-USDA, 1971. p.14-24. O’Leary, J. W.; Prisco, J. T. Response of osmotically stressed plants to growth regulators. Advancing Frontiers in Plant Science, v.25, p.129-139, 1970. Pathan, M. S.; Lee, J.-D.; Shannon, J. G.; Nguyen, H. T. Recent advances in breeding for drought and salt stress tolerance in soybean. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.739-774. Prisco, J. T. Alguns aspectos da fisiologia do “stress” salino. Revista Brasileira de Botânica, v.3, p.85-94, 1980. Prisco, J. T.; O’Leary, J. W. Enhancement of intact bean leaf senescence by NaCl salinity. Physiologia Plantarum, v.27, p.95-100, 1972. Richards, L. A. (ed.). Diagnosis and improvement of saline and alkali soils. Agriculture Handbook No. 60, Washington: USDA, 1954. 160p. Sairam, R. K.; Tyagi, A. Physiology and molecular biology of salinity stress tolerance. Current Science, v.86, p.407-421, 2004. Salisbury, F. B. Units, symbols, and terminology for plant physiology: a reference for presentation of research results in plant sciences. New York: Oxford University Press, 1996. 234p. Salisbury, F. B.; Ross, C. W. Plant Physiology. 3th ed. Belmont: Wadsworth Publishing Company, 1985. 540p. Scandalios, J. G. The rise of ROS. Trends in Biochemical Science, v.27, p.483-486, 2002. Schimper, A. F. W. Pflanzengeographie auf physiologischer grundlage. Jena: G. Fischer, 1898. 588p. Setter, T. L.; Fregene, M. A. Recent advances in molecular breeding of cassava for improved drought stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.701-712. 158 José T. Prisco & Enéas G. Filho Silva, J. V.; Lacerda, C. F.; Costa, P. H. A.; Enéas Filho, J.; Gomes-Filho, E.; Prisco, J. T. Physiological responses of NaCl stressed cowpea plants grown in nutrient solution supplemented with CaCl 2. Brazilian Journal of Plant Physiology, v.15, p.99-105, 2003. Skene, K. G. M. Giberellin-like substances in root exudation of Vitis vinifera. Planta, v.74, p.250-162, 1967. Slatyer, R. O. Effects of several osmotic substances on water relations of tomato. Australian Journal of Biological Sciences, v.14, p.519-540, 1961. Slesak, I.; Libik, M.; Karpinska, B.; Karpinski, S.; Miszalski, Z. The role of hydrogen peroxide in regulation of plant metabolism and cell signaling in response to environmental stresses. Acta Biochimica Polonica, v.54, p.39-50, 2007. Sohan, D.; Jasoni, R.; Zajisek, J. Plant-water relations of NaCl and calcium-treated sunflower plants. Environmental and Experimental Botany, v.42, p.105-111, 1999. Strogonov, B. P. Physiological basis of salt tolerance of plants. Jerusalem: Israel Program for Scientific Translation, 1964. 279p. Strogonov, B. P. Structure and function of plant cells in saline habitats. New trends in the study of salt tolerance. Jerusalem: Israel Program for Scientific Translation, 1974. 284p. Taiz, L.; Zeiger, E. Plant Physiology. 4 th ed. Sunderland: Sinauer Associates, Inc., 2006. 764p. Türkan, I.; Demiral, T. Salinity tolerance of higher plants. In: Khan, N. A.; Singh, S. (ed.). Abiotic stress and plant responses. New Delhi: I.K. International, 2008. p.105-123. Türkan, I.; Demiral, T. Recent developments in understanding salinity tolerance. Environmental and Experimental Botany, v.67, p.2-9, 2009. Tyerman, S. D; Skerret, I. M. Root ion channels and salinity. Scientia Horticulturae, v.78, p.175-235, 1999. Uchida, A.; Jagendorf, A. T.; Hibino, T.; Takabe, T. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant Science, v.163, p.515-523, 2002. Urao, T.; Yakubov, B.; Satoh, R.; Yamaguchi-Shinozaki, K.; Seki, M.; Hirayama, T.; Shinozaki, K. A transmembrane hybrid-type histine kinase in Arabidopsis functions as an osmosensor. The Plant Cell, v.11, p.1743-1754, 1999. van Breusegem, F.; Vranová, E.; Dat, J. F.; Inzé, D. The role of active oxygen species in plant signal transduction. Plant Science, v.161, p.405-414, 2001. Wadleigh, G. H.; Ayers, A. D. Growth and biochemical composition of bean plants as conditioned by soil moisture tension and salt concentration. Plant Physiology, v.20, p.106-132, 1945. Wadleigh, G. H.; Gauch, H. G.; Magistad, O. C. Growth and rubber accumulation in guayule as conditioned by soil salinity and irrigation regime. USDA Technical Bulletin 925, 1946. 34p. Wahid, A.; Perveen, M.; Gelani, S.; Basra, S. M. A. Pretreatment of seed with H2O2 improves salt tolerance of wheat seedlings by alleviation of oxidative damage and expression of stress proteins. Journal of Plant Physiology, v.164, p.283-294, 2007. Wasilewska, A.; Vlad, F.; Sirichandra, C.; Redko, Y.; Jammes, F.; Valon, C.; Frey, N. F.; Leung, J. An update on abscisic acid signaling in plants and more... Molecular Plant, v.1, p.198-217, 2008. Weiss, C.; Vaadia, Y. Kinetin-like activity in root apices of sunflower plants. Life Science, v.4, p.1323-1326, 1965. Wyn Jones, R. G.; Gorham, J. Osmoregulation. In: Lange, O. L.; Nobel, P. S.; Osmond, C. B.; Ziegle, H. (ed.). Physiological plant ecology III: responses to chemical and biological environment. Encyclopedia of Plant Physiology, v.12C. New York: Springer-Verlag, 1983. p.35-58. Yamagushi, T.; Blumwald, E. Developing salt-tolerant crop plants: challenges and opportunities. Trends in Plant Science, v.10, p.615-620, 2005. Zhang, J.-Y.; Wang, Z.-Y. Recent advances in molecular breeding of forage crops for improved drought and salt stress tolerance. In: Jenks, M. A.; Hasegawa, P. M.; Jain, S. M. (ed.). Advances in molecular breeding toward drought and salt tolerant crops. Dordrecht: Springer, 2007. p.797-817. Zhu, J.-K. Cell signaling under salt, water and cold stresses. Current Opinion on Plant Biology, v.4, p.401-406, 2001. Zhu, J.-K. Salt and drought stress signal transduction in plants. Annual Review of Plant Biology, v.53, p.247-273, 2002. Zhu, J.-K. Regulation of ion homeostasis under salt stress. Current Opinion on Plant Biology, v.6, p.441-445, 2003. Fisiologia e bioquímica do estresse salino em plantas ANEXO Glossário de termos usados Os filósofos da Grécia antiga, quando se reuniam para discutirem as preocupações dos homens que tentavam desvendar o mundo que os cercava, iniciavam pela conceituação dos termos que iriam ser usados durante suas discussões. Com isso, evitavam mal entendidos, comuns nessas ocasiões. Infelizmente, essa prática foi esquecida e tem sido muitas vezes a causa de desencontros. Partindo-se desse princípio, estão relacionados abaixo, os conceitos dos principais termos usados neste capítulo. - Aclimatação – refere-se a mudanças fisiológicas, bioquímicas e morfológicas temporárias, que ocorrem em um organismo e aumentam sua tolerância às variações no ambiente externo; embora possa envolver mudanças na expressão gênica, ela é uma resposta homeostática que não se transmite para as gerações futuras (Salisbury, 1996; Taiz & Zeiger, 2006). - Adaptação - refere-se à capacidade desenvolvida por um organismo, através da seleção natural ou artificial, de tolerar ambientes estressantes, graças a mudanças fisiológicas, bioquímicas e morfológicas permanentes; como essas mudanças são reguladas por genes elas são transmitidas para as gerações futuras (Salisbury, 1996; Taiz & Zeiger, 2006). - Antioxidante - pode ser definido como qualquer substância que, mesmo presente em baixas concentrações em relação a um substrato oxidável, retarda significativamente ou evita sua oxidação. 159 - Aquaporinas – também conhecidas como canais de água, são proteínas integrais da membrana, que formam poros nas mesmas e, através deles a água penetra ou sai das células. - Estresse ambiental – qualquer componente do meio ambiente que seja capaz de alterar o funcionamento normal do indivíduo que está crescendo nesse ambiente. - Estresse oxidativo – quando o fator de estresse é uma Espécie Reativa de Oxigênio (ERO), resultante das reações metabólicas que reduzem parcialmente o oxigênio molecular. - Estresse salino – quando o fator de estresse ou agente estressante é o excesso de sais solúveis; são considerados salinos os solos que possuem CEes ≥ 4,0 dS m-1, PST < 15% e pH < 8,5; são considerados sódicos, aqueles que possuem CEes < 4,0 dS.m-1, PST > 15% e pH > 8,5; e, finalmente, os salino-sódicos são os possuidores de CEes ≥ 4,0 dS m-1, PST > 15% e pH < 8,5 (Richards, 1954). - Homeostase – é o processo de manutenção do equilíbrio interno das células, tecidos e órgãos do indivíduo, a despeito das variações no ambiente externo. - Percepção do sinal de estresse – maneira como as células do indivíduo percebem a presença de um fator de estresse. - Transdução do sinal de estresse – uma sequência de processos em que um fator de estresse interage com um receptor, em geral, junto à superfície celular, causando uma alteração no nível de um mensageiro secundário e, por fim, uma mudança no funcionamento celular (Taiz & Zeiger, 2006). 11 Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas Joaquim A. G. Silveira1, Sérgio L. F. Silva1, Evandro N. Silva1 & Ricardo A. Viégas2 1 2 Universidade Federal do Ceará Universidade Federal de Campina Grande Introdução Efeitos do estresse salino e principais respostas das plantas Efeitos osmóticos e efeitos iônicos Mecanismos da inibição do crescimento de plantas pela salinidade Mecanismos biomoleculares da resistência à salinidade Considerações iniciais Papel da expressão gênica na resistência ao estresse salino Ajustamento osmótico e homeostase hídrica: Aspectos fisiológicos Papel da prolina no ajustamento osmótico e proteção celular de plantas sob estresse salino Papel de glicina betaina no ajustamento osmótico e proteção celular sob estresse salino Outros solutos importantes no ajustamento osmótico sob estresse salino Homeostase iônica Considerações iniciais Vias de transporte de Na+ na célula vegetal Exclusão e compartimentalização do Na+ celular Homeostase redoxi e proteção oxidativa Considerações iniciais Fotossíntese, fotorespiração e produção de EROS Mecanismos de proteção oxidativa Seleção assistida com marcadores moleculares Conclusões e perspectivas Referências Manejo da salinidade na agricultura: Estudos básicos e aplicados ISBN 978-85-7563-489-9 Fortaleza - CE 2010 162 Joaquim A. G. Silveira et al. Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas INTRODUÇÃO Com a expansão da área agrícola cultivada no mundo, partes marginais sujeitas à secas frequentes e solos salinos estão sendo progressivamente incorporadas. Além disso, com a expansão da irrigação, o problema da salinização secundária tem se tornado grave, particularmente nas regiões tropicais onde prevalecem condições climáticas adversas como evapotranspiração e temperaturas elevadas. Esses problemas são frequentemente associados com manejo inadequado da água e do solo e do uso de águas com elevado teor de sais, o que agrava intensamente o problema da salinização dos solos. Esse quadro é típico das regiões semiáridas, onde a irrigação aparece como uma importante alternativa tecnológica para incrementar a produtividade agrícola. Paradoxalmente, apesar dos enormes prejuízos econômicos e sociais causados pela salinidade na redução na produção agrícola, poucos são os programas de melhoramento genético, em desenvolvimento no Brasil e no mundo, visando a obtenção de variedades resistentes, especialmente genótipos adaptados às regiões semiáridas tropicais. Ainda mais preocupante é o fato de atualmente ainda não se dispor de marcadores moleculares, bioquímicos e fisiológicos (biomoleculares) seguros ou viáveis para incorporação em programas de seleção assistida de melhoramento genético, para uma dada cultura específica, quer seja por meio dos métodos convencionais, quer seja pelas técnicas de engenharia genética. A despeito do enorme progresso ocorrido na biologia vegetal, proporcionado pelo surgimento de ferramentas analíticas modernas e na grande quantidade de pesquisa publicada nas áreas de fisiologia vegetal e outras relacionadas nos últimos anos, ainda é limitada a compreensão dos mecanismos que conferem resistência ao estresse salino numa determinada espécie vegetal. Em parte essa dificuldade está associada com a própria complexidade da interação estresse-planta, que envolve caracteres genéticos poligênicos e interativos com o ambiente. Por outro lado, ainda existe um grande distanciamento entre a pesquisa básica em biologia vegetal e o melhoramento genético de plantas. O melhoramento vegetal tradicional esteve sempre mais focado no aumento da produtividade sob condições favoráveis, sendo o melhoramento para áreas agrícolas marginais – como as áreas salinizadas, deixado em segundo plano. A maior integração entre a bioquímica e técnicas de biologia molecular (fatores biomoleculares) com a genética molecular e melhoramento de plantas deverá, em muito, contribuir para a obtenção de genótipos resistentes ao excesso de sais. Para isso, é necessário, inicialmente, descobrir os elos fracos das diversas vias metabólicas envolvidas com a resistência ao estresse salino, para em seguida eleger genes que possam controlar a resistência. Essa é uma tarefa muito difícil, haja vista que a resistência ao estresse salino é um caráter quantitativo que envolve diversas redes metabólicas, com forte interação com o ambiente. Neste capítulo, iremos descrever, inicialmente, os principais mecanismos biológicos envolvidos com os efeitos do estresse salino assim como os principais tipos de respostas das plantas cultivadas. Serão destacados os processos atualmente mais utilizados nas pesquisas, enfatizando as vias metabólicas, os passos bioquímicos e os genes como maior potencial de controlar a resistência das plantas. Em seguida, será dado destaque especificamente aos seguintes processos: (1) mecanismos biomoleculares de resposta das plantas ao Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas EFEITOS DO ESTRESSE SALINO E PRINCIPAIS MECANISMOS DE RESPOSTAS DAS PLANTAS Efeitos osmóticos e efeitos iônicos A salinidade causa grandes distúrbios no metabolismo das plantas, acarretando restrição de crescimento e perda de produtividade. Diversos são os processos biomoleculares afetados pelo estresse salino, sendo muito difícil estabelecer uma sequência dos eventos que são os “passos limitantes”, uma vez que o metabolismo opera em redes complexas com milhares de reações bioquímicas interconectadas. Na realidade, os primeiros efeitos causados pelo excesso de sais são de natureza biofísica, se destacando os efeitos osmóticos, restringindo o transporte de água. Em seguida, rapidamente é desencadeada uma sequência de reações, moduladas por hormônios, que levam restrição à abertura estomática e assimilação fotossintética do CO2. Esses efeitos predominam na primeira fase do estresse salino (“fase osmótica”), a qual ocorre nos estágios iniciais da exposição das plantas à salinidade ou na presença de níveis moderados de sais em contato com o sistema radicular. Na verdade, comumente, nesse período o que as plantas exibem é na realidade mais uma resposta fisiológica do tipo aclimatativa ao estresse do que mesmo danos sofridos pelo estresse salino per si. Em outras palavras, muitas vezes o que comumente se diagnostica como sintomas de efeitos negativos do estresse salino, são, na realidade, respostas fisiológicas normais das plantas para superar ou se aclimatar àquela situação adversa. À medida que os íons salinos se acumulam em excesso no citosol das células das plantas surgirão problemas de toxicidade (fase tóxica ou iônica) nas plantas expostas à salinidade. Entretanto, as espécies diferem largamente na resistência protoplasmática ou tecidual ao estresse salino. Essa capacidade de resistir está ligada principalmente com a intensidade de compartimentalização dos íons salinos dentro dos vacúolos e com a manutenção de um balanço K+/Na+ favorável no citosol. Atualmente, esse tem sido um dos alvos para a seleção e melhoramento genético de cultivares resistentes de algumas culturas, como será mostrado posteriormente. Na fase de toxicidade iônica da salinidade ocorrem efeitos diretos e indiretos causados pelo excesso de íons no tecido ou mesmo no meio externo radicular. Esses mecanismos ainda não são bem compreendidos, mas acredita-se que concentrações, acima de certo limiar, desencadeiam inicialmente cascatas de reações bioquímicas de percepção e expressão de genes ligados ao fator modulador do estresse (presença de íons, potencial osmótico, mudanças na pressão de turgescência etc). Em seguida, ocorre a resposta da planta, envolvendo expressão gênica, síntese de proteínas e balanço hormonal. Essas respostas desencadearão diversos processos fisiológicos importantes. A Figura 1 apresenta as fases correspondentes aos efeitos osmóticos e iônicos do estresse salino na restrição do crescimento de uma planta. Os processos mais diretamente associados com a toxicidade iônica são a senescência e a morte celular programada, ambas induzidas por salinidade. Esses dois processos são complexos e interligados e são respostas comuns das plantas a estresses bióticos, como aqueles desencadeados por ataque por patógenos. Acredita-se que esses dois processos sejam os responsáveis pela sintomatologia visual da toxicidade iônica tais como clorose foliar (degradação de clorofila) e surgimento de pontos necróticos no limbo foliar (sintomas de apoptose ou morte celular). Portanto, aparentemente, muitos dos Taxa de crescimento estresse salino; (2) ajustamento osmótico e proteção celular com ênfase nos solutos orgânicos prolina e glicina betaina; (3) transporte celular, homeostase iônica e compartimentalização vacuolar; (4) proteção e estresse oxidativo; (5) fotossíntese e (6) uso de marcadores moleculares na seleção e melhoramento genético. 163 NaCl Fase osmótica Fase iônica Figura 1. Esquema hipotético mostrando a restrição de crescimento imposta pela exposição ao estresse salino: uma resposta rápida e de alta intensidade é causada por o aumento da pressão osmótica no meio externo (fase osmótica) que reduz intensamente o crescimento. Uma resposta posterior, devido à acumulação excessiva de íons tóxicos nos tecidos (fase iônica), que em geral levam ao surgimento de sintomas visuais de toxicidade nas folhas (geralmente clorose seguida por surgimento de áreas necróticas). Essas respostas variam intensamente entre genótipos, nível de salinidade, solo e fatores ambientais (Adaptado de Munns & Tester, 2008) 164 Joaquim A. G. Silveira et al. sintomas visuais da salinidade são mais efeitos indiretos do excesso de íons do que efeitos tóxicos diretos na célula. Entretanto, o excesso de íons no citosol, especialmente o Na+, causa grandes alterações sobre a atividade de enzimas e estrutura funcional de proteínas, causando efeitos diretos de toxicidade. Nessas condições, a salinidade pode induzir problemas sérios no transporte de água e de nutrientes minerais, acarretando “seca por salinidade” e desbalanço nutricional, especialmente na relação Na+/K+ no citosol. Em geral, esses efeitos manifestam-se somente na presença de níveis elevados de salinidade (estresse agudo) nas espécies sensíveis. Entretanto, muitas vezes, os sintomas de severidade do estresse não são positivamente associados com as concentrações dos íons salinos nos tecidos das plantas, mas sim com as concentrações no meio radicular externo. A aclimatação à salinidade, que poderá ocorrer na presença de níveis moderados de sais ou nos genótipos mais resistentes, constitui um processo complexo que envolve o surgimento de uma nova homeostase metabólica envolvendo alterações hormonais, no metabolismo celular e na expressão gênica. A consequência mensurável causada pelos efeitos do excesso de sais na primeira fase do estresse é a rápida e intensa redução na taxa de crescimento, principalmente na área foliar. Por muito tempo e ainda presente nos dias de hoje, a explicação geral para essa resposta fisiológica é dada pela modulação no crescimento associada com a diminuição na expansão da parede celular (redução na pressão de turgescência). A Figura 2 ilustra os principais efeitos do estresse salino nas plantas. Mecanismos da inibição do crescimento de plantas pela salinidade No nível bioquímico, ainda não existe, na literatura, um modelo teórico capaz de explicar a rápida modulação exercida pelo excesso de sais (no meio radicular) sobre Figura 2. Esquema simplificado mostrando os principais efeitos do excesso de sais causando os efeitos osmóticos e iônicos do estresse salino o crescimento. É possível que esta resposta envolva uma cadeia de sinalização molecular (moduladores e proteínas), ativação e expressão de genes ligados às proteínas do ciclo celular (ciclinas), modulando a síntese protéica e a divisão celular, com participação de hormônios. Portanto, a modulação no crescimento, exercida pela salinidade moderada, deve-se a uma nova homeostase ditada por menores taxas de crescimento associadas, principalmente, como menor fotossíntese. Nessa fase, as reações bioquímicas funcionam normalmente, porém com menores velocidades. Dessa maneira, afirma-se que os efeitos da salinidade são “silenciosos”, pois as plantas, nessa fase do estresse, frequentemente não exibem sintomas de toxicidade ou de injúrias, nem de desbalanço nutricional ou desidratação visível. Assim, frequentemente, sob condições de baixo nível de salinidade, torna-se difícil, nas condições de campo, diagnosticar os efeitos e os sintomas da salinidade. Um exemplo bastante ilustrativo ocorre com plantas de feijão caupi que reduzem intensamente seu crescimento sem, entretanto, exibirem sintomas de toxicidade iônica nas folhas, conforme mostra a Figura 3. O desenvolvimento das plantas em presença de salinidade na faixa baixa a moderada, que pode ser arbitrariamente definida de 2 a 4 dS m-1 de condutividade na solução do solo, é reduzido significativamente devido a modulação negativa no crescimento. Nessas condições, em geral, as plantas conseguem completar seus ciclos de desenvolvimento, mas pagando o preço de uma menor produtividade. Pode-se dizer que o principal fator restritivo nessa fase é o da utilização de água devido à menor transpiração (maior resistência estomática) e, como consequência indireta, menor fotossíntese. Entretanto, sob certas condições específicas, essa desvantagem (menor uso de água) poderá se tornar em uma vantagem competitiva tendo em vista uma melhor aclimatação às condições de restrição hídrica e fatores climáticos adversos como àquelas predominantes nas regiões semiáridas tropicais. Contudo, é fundamental que aqueles genótipos possuam a capacidade de restringir e compartimentalizar o excesso de íons salinos, evitando a toxicidade, especialmente nas folhas. A fase mais aguda do estresse salino causa intensos distúrbios metabólicos, os quais poderão levar à morte de tecidos e abscisão foliar. Nessas condições, virtualmente todos os processos celulares entram em colapso, dependendo da severidade do estresse e da resistência do genótipo. Um dos estresses secundários decorrentes da salinidade nessas condições é o estresse oxidativo, especialmente nas folhas, decorrente do descontrole metabólico envolvendo processos chaves tais como fotossíntese, respiração, fotorespiração e o metabolismo Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas 10 Controle 165 100 8 80 6 60 C.R.A. (%) -1 T.C.R. -1 (mg MS g MS dia ) 100 mM NaCl 4 40 2 20 0 0 Pérola Pitiúba Pérola Pitiúba Figura 4. Esquema geral mostrando os principais processos envolvidos com a resistência ao estresse salino. O estresse salino induz pelo menos três tipos de estresses: estresse osmótico + estresse iônico + estresse oxidativo. Para cada tipo de estresse, as plantas desenvolvem mecanismos de reparação e proteção, que levarão aos novos estados de homeostase osmótica, homeostase iônica e homeostase oxidativa. Em função da eficácia de cada mecanismo de novo ajustamento poderão ocorrer respostas finais de sobrevivência e crescimento continuado (resistência) ou de parada de crescimento e morte da planta (sensibilidade) Figura 3. Taxa de crescimento relativo (TCR), conteúdo relativo de água (CRA) e aspectos morfológicos de folhas de duas cultivares de feijão-caupi (Pérola e Pitiúba) cultivadas na ausência (0), 100 e 200 mM de NaCl durante 15 dias. A fotografia mostra que apesar dos altos níveis de salinidade as folhas não mostraram sintomas de toxicidade iônica, mas apresentaram forte restrição no crescimento (Extraído de Freitas, 2006; Maia et al., 2009) celular em geral. A despeito das plantas disporem de diversos mecanismos de proteção e reparação celular, o crescimento e a sobrevivência nessas condições irão depender de um complexo balanço envolvendo a base genética (genótipo) e o ambiente. A Figura 4 mostra de forma simplificada, os principais mecanismos que poderão conferir resistência ao estresse salino. MECANISMOS BIOMOLECULARES DA RESISTÊNCIA À SALINIDADE Considerações iniciais Neste item, serão apresentados os principais mecanismos bioquímicos e de expressão gênica envolvidos com a aclimatação e adaptação das plantas ao excesso de sais. Serão destacados alguns dos processos biomoleculares mais importantes, enfatizando os principais alvos moleculares (genes) e bioquímicos com maior potencial de utilização na obtenção de plantas resistentes atualmente. É importante frisar que ao se analisar a resposta de uma espécie ou cultivar ao estresse salino deve-se ter em mente duas situações bem distintas, mas difíceis de separação. Assim, é necessário separar os mecanismos de resposta envolvidos como estratégia de defesa ao estresse salino daqueles que são efeitos danosos da salinidade sobre o metabolismo. Por exemplo, a redução na biossíntese de clorofilas pode ser uma resposta aclimatativa ao estresse no sentido de economia de energia e menor captação de energia luminosa, para evitar estresse foto-oxidativo, e não um efeito danoso em si. Inversamente, o aumento na concentração de prolina, uma substância que favorece muitas espécies no ajustamento osmótico e proteção celular, muitas vezes é simplesmente um efeito de distúrbio metabólico causado pelo estresse. O metabolismo opera em centenas de rede de reações bioquímicas e frequentemente é muito difícil interpretar suas mudanças por efeito de estresses. Além disso, a resistência a estresse salino se dá por diversas mudanças aclimatativas ou adaptativas e raramente por 166 Joaquim A. G. Silveira et al. uma ou algumas isoladamente. De fato, as respostas das plantas ao estresse salino é a consequência final de uma série de eventos bioquímicos e de expressão gênica de análise complexa. A Figura 5 mostra um esquema simplificado envolvendo o paradigma atual da resposta das plantas ao estresse salino e a outros tipos de estresses. invariavelmente mudanças metabólicas e fisiológicas assim como o controle da expressão gênica está ligado com o metabolismo e a fatores ambientais. Atualmente, o grande desafio da biologia vegetal é compreender como esses fatores se interligam. No caso do estresse salino, a questão é saber como as alterações na expressão de genes envolvidos com resistência podem, de fato, contribuir (e de que maneira) com a resistência. A Figura 7 ilustra de modo simplificado, a interação entre fatores de estresse e a resposta gênica no nível celular. Figura 5. Modelo esquemático mostrando o mecanismo geral de resposta biomolecular das plantas à salinidade e a fatores de estresses em geral, ressaltando os eventos celulares e a resposta no nível de planta inteira. (Adaptado de Bray et al., 2000) A Figura 6 mostra um esquema simplificado de diferentes vias envolvidas com as respostas ao estresse salino e as consequências na resistência ou sensibilidade das plantas. Figura 6. Vias potenciais de sinalização ao estresse salino. O estímulo causado pelos efeitos iônicos e osmóticos da salinidade é percebido por receptores que transmitem essa informação para o núcleo celular através de vias moleculares de transdução de sinais. As respostas na expressão gênica, de genes específicos relacionados, podem levar aos mecanismos de homeostase iônica e osmótica, regulação de crescimento e de reparo de danos celulares. Em conjunto, essas respostas podem resultar na tolerância ou sensibilidade da planta ao estresse. (Adaptado de Zhu et al., 2002) Papel da expressão gênica na resistência ao estresse salino Em ultima análise, a expressão de genes faz parte do metabolismo celular, sendo cada parte dependente uma da outra. Assim, alterações na expressão de genes levam Figura 7. Modelo esquemático mostrando os três principais sítios celulares, com respectivos componentes moleculares, que podem ser manipulados geneticamente visando alterar a tolerância a estresses abióticos em plantas. O sítio 1 (BOX 1) está relacionado com as proteínas responsáveis pela resposta metabólica de proteção às alterações induzidas pelo estresse. O sítio 2 (BOX 2) se refere ao controle do processo de transcrição dos genes específicos e potenciais, enquanto o sítio 3 (BOX 3) engloba os componentes envolvidos com os mecanismos de percepção dos estímulos externos, que culmina com a transdução e amplificação do sinal emitido pelo fator de estresse até o núcleo. Após a expressão gênica, ocorrerá a resposta ao fator de estresse (BOX 1). (Adaptado de Grover et al., 1999) Ajustamento osmótico e homeostase hídrica: Aspectos biomoleculares gerais O ajustamento osmótico é caracterizado como o aumento líquido na concentração de solutos na célula, descontando-se os aumentos devido à redução no volume celular. Esses incrementos ocorrem graças ao aumento na síntese de solutos orgânicos, mobilização desses solutos de outros tecidos e aumento na absorção e/ou migração de outros tecidos de solutos inorgânicos, especialmente K+ e principalmente dos próprios íons salinos. Esse mecanismo permite a redução no potencial osmótico e aumento no potencial de turgescência da célula, facilitando a absorção de água e a manutenção do crescimento celular. Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas O ajustamento osmótico é crítico especialmente nos tecidos meristemáticos de raízes e folhas, possibilitando o crescimento continuado. Mais uma vez, as halófitas são os melhores modelos de ajustamento osmótico sob condições de salinidade. Essas espécies são capazes de exibir intenso e eficiente ajustamento mesmo sob condições extremas de excesso de sais, como em ambientes com concentrações próximas da água do mar. Infelizmente, a capacidade de ajustamento osmótico na maioria das espécies cultivadas (glicófitas) é, em geral, muito limitada sob condições de salinidade elevada. Como essas espécies não dispõem de estruturas especiais para acumular concentrações elevadas dos sais em suas folhas – como fazem as halófitas, a utilização dos próprios íons salinos para fins osmóticos torna-se limitada devido à possibilidade de atingirem níveis tóxicos. As glicófitas lidam como uma situação delicada entre absorver mais íons para permitir absorver mais água e ter mais crescimento e não sofrer os efeitos tóxicos dos íons salinos. Essa situação é mais crítica ainda em tecidos meristemáticos – os que mais requerem crescimento, porque as células jovens possuem menor quantidade de vacúolos para armazenar os sais tóxicos. A situação ideal seria regular as taxas de absorção dos íons salinos, com a armazenagem em tecidos mais velhos, síntese de solutos orgânicos osmoticamente compatíveis e incremento na absorção de K+ e outros nutrientes. A Figura 8 representa um esquema simplificado mostrando o ajustamento osmótico favorecendo o balanço hídrico e a manutenção da pressão de turgescência. Os mecanismos de ajustamento osmótico e a acumulação de solutos compatíveis em plantas têm chamado a atenção durante muito anos. Vários trabalhos Ψp = +0,5 MPa Ψs = -2,0 MPa Ψw = -1,5 MPa Ψp = 0 MPa Ψs = -1,2 MPa Ψw = -1,2 MPa Deficit hídrico Com ajustamento osmótico Ψw (solo) = -1,5 MPa Sem ajustamento osmótico Figura 8. Esquema geral mostrando a importância do ajustamento osmótico na absorção de água sob condições de baixo potencial hídrico do solo (Adaptado de Bray et al., 2000) 167 têm discutido a osmoproteção em plantas e sua potencial aplicação na tolerância à salinidade. Tem sido proposto, por diversos autores, que esses compostos beneficiam as células estressadas de duas formas: (1) pela ação como osmólitos citoplasmáticos, desse modo facilitando a absorção de água e (2) e na proteção e estabilização de estruturas e macromoléculas (proteínas, membranas, cloroplastos e lisossomos). A Figura 9 mostra a compartimentalização de solutos inorgânicos e orgânicos em uma célula de folha que apresenta ajustamento osmótico em presença de salinidade. Figura 9. Esquema geral de compartimentalização celular de solutos inorgânicos e orgânicos envolvidos no ajustamento osmótico de folhas submetidas ao estresse salino (Adaptado de Bray et al., 2000) Uma das respostas metabólicas ao estresse salino em algumas espécies é o aumento na síntese de osmólitos compatíveis. Eles auxiliam o ajustamento osmótico, protegem estruturas subcelulares e reduzem os danos oxidativos em resposta à salinidade. Os mais importantes desses compostos osmoticamente ativos são açucares, açúcares-poliois, aminoácidos e compostos quaternários de amônio. Os solutos mais estudados e com maior potencial de beneficiar as plantas com maior resistência ao estresse salino são: o aminoácido prolina, o composto quartenário de amônio glicina betaina, o açúcar-alcool manitol e o açúcar trealose. A Figura 10 mostra a estrutura química dos principais solutos compatíveis. Papel da prolina no ajustamento osmótico e proteção celular de plantas sob estresse salino A salinidade estimula um aumento na concentração de alguns aminoácidos livres, dentre eles a prolina. A observação de que a acumulação de prolina ocorria em tecidos de plantas expostas à deficiência hídrica ocorreu pela primeira vez em 1953, nos Estados Unidos. A partir daí milhares de trabalhos mostraram que esse fenômeno ocorria em diversos organismos e em diferentes tipos de 168 Joaquim A. G. Silveira et al. Figura 10. Estrutura química dos principais solutos compatíveis encontrados em plantas superiores. (Adaptado de Hasegawa et al., 2000) estresses. Criou-se, então, o paradigma de que prolina estaria envolvida com a proteção de plantas contra estresses tais como seca e salinidade. Inicialmente, foi demonstrado em cultivo de células, bactérias e sistemas livres de células (extratos de plantas) que concentrações muito elevadas de prolina (na ordem de 1000 mM) eram capazes de proteger proteínas contra desnaturação (Figura 11). Outros estudos, com genótipos contrastantes demonstraram que os mais resistentes à seca e salinidade apresentavam maior acumulação de prolina. Infelizmente, diversos outros estudos não confirmam àquelas conclusões, ou seja, outros genótipos mais sensíveis também acumulavam mais prolina na condição de estresse. Em seguida, foi claramente demonstrado que a acumulação de prolina geralmente ocorria após o surgimento dos sintomas de injúrias causados após o estresse já ter sido estabelecido (Rocha, 2003). Outros estudos, utilizando plantas transgênicas ou espécies com diferente capacidade para acumulação de prolina nos tecidos sob estresse, mostraram que tais concentrações não eram suficientemente elevadas para provocar uma contribuição significativa no potencial osmótico celular ou mesmo na proteção celular (Silva et al., 2009). Isso tudo levou a uma situação que ainda persiste nos dias atuais: a prolina contribui de fato para a resistência ao estresse salino ou sua acumulação é meramente um sintoma de distúrbio metabólico? Um fato que pesa a favor do papel benéfico da prolina é que algumas espécies halófitas – as plantas mais evoluídas para lidarem com excesso de sais, acumulam efetivamente esse aminoácido em grande quantidade para beneficiar o ajustamento osmótico do citosol e proteção de estruturas celulares. Independente da corrente de pensamento científico, a tentativa de aumentar os níveis de produção de prolina em plantas transgênicas por meio do aumento da expressão de genes codificadoras de enzimas de sua biossíntese tem sido um dos alvos preferidos para a obtenção de plantas resistentes (Silva et al., 2010a). Os genes alvos mais utilizados são os das enzimas P5CS (1-pirroline-5-sintase de carboxilato) e P5CR (1pirroline-5-redutase de carboxilato), consideradas como passos limitantes da via de biossíntese da prolina em plantas (Figura 12). Plantas transgênicas de diversas espécies têm sido transformadas com sucesso e sob condições restritas de laboratório essas plantas têm NADP+ + Pi CH2 HOOC CH2 NADP+ + Pi NADPH NADPH P5CS CH CH2 CH2 CH CH O= COOH NH2 ADP L-ác. glutâmico ATP Espontânea COOH NH2 GSA CH2 CH2 CH CH P5CR Solutos compatíveis (Prolina) Arginina Arginase Uréia Figura 11. Esquema mostrando provável papel protetor de prolina e outros solutos orgânicos compatíveis na proteção de proteínas contra desnaturação causada por excesso de sais. (Adaptado de Bray et al., 2000) N H L- prolina NADPH P2CR CH2 CH2 CH2 CH NH2 NH2 Ornitina NADP+ CH2 CH2 O CH2 COOH CH P2C COOH CH2 CH2 Proteínas nativa COOH P5C NH2 Proteínas desnaturadas CH2 CH COOH N Ornitina – δ – aminotransferase Íons desnaturantes CH2 CH2 CH2 N Espontânea CH COOH Figura 12. Vias de biossíntese da prolina em plantas. A via iniciada pelo ácido glutâmico é considerada a mais importante sob condições de estresse osmótico. As reações consideradas mais importantes o são a primeira, catalisada pela P5CS, que converte o ácido glutâmico em semi-aldeido glutâmico (GSA) e a PSCR que reduz o ( 1-pirroline 5- carboxílico = P5C) até prolina. Entretanto, em algumas espécies, como o cajueiro, a via da OAT – ornitina -aminotrasferase, é importante sob condições de estresse salino (Rocha, 2003) Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas mostrado maior aclimatação às doses elevadas de NaCl. Entretanto, algumas plantas transformadas se mostraram mais resistentes sem porém apresentar níveis desse soluto em quantidade suficiente para contribuir com o ajustamento osmótico ou com proteção de proteínas contra desnaturação causada por excesso de sais. Como prolina pode exercer um papel na proteção contra espécies reativas do oxigênio ou mesmo como sinalizador celular, alguns autores têm mais recentemente postulados esses efeitos benéficos para as células sob condições de estresse salino. Os poucos trabalhos existentes com genética clássica não são suficientes para concluir se de fato prolina é um caráter bioquímico favorável à resistência de plantas ao estresse salino. Portanto, a despeito dos grandes avanços nas técnicas de biologia molecular, ainda não se sabe o efetivo papel protetor exercido por prolina na resistência aos estresses abióticos. Estudos em nosso laboratório com algumas espécies regionais do semiárido têm mostrado que a acumulação de prolina é mais expressiva sob condições de seca do que sob estresse salino, como ocorre com feijão-caupi, cajueiro, pinhão manso e Atriplex nummularia (Santiago, 2006; Silva et al. 2010a; Silveira et al. 2009). É interessante observar que feijão-caupi acumula quantidades expressivas de prolina nas raízes sob estresse hídrico, porém níveis bem mais baixos sob estresse salino. Na realidade, todas aquelas espécies acumulam pouca prolina, mas são as espécies de pinhão manso e erva sal as que possuem níveis endógenos elevados de outro importante soluto orgânico: a glicina betaina (Silva et al., 2009; Silveira et al., 2009). Nesses casos, as quantidades acumuladas nessas espécies são importantes para a proteção e ajustamento osmótico sob estresse salino. Papel de glicina betaina no ajustamento osmótico e proteção celular sob estresse salino Outro soluto sintetizado em algumas espécies em condições de estresse salino é a glicina betaína, um composto quaternário de amônio, cujo papel fisiológico estar relacionado à osmorregulação do citosol e compartimentos celulares, na proteção de proteínas e na estabilização de membranas (Sakamoto & Murata, 2000). Sob salinidade, os níveis desse soluto aumentam intensamente em diversas espécies halófitas da família das Chenopodiaceae. Nessas espécies, esse soluto atinge concentrações elevadas mesmo na ausência de salinidade, evidenciando que talvez ela seja sintetizada constitutivamente a partir de um processo genéticobiomolecular e evolutivo (Silveira et al., 2009). 169 A glicina betaína age como estabilizador osmótico e ajuda na proteção de macromoléculas sob desidratação, sendo considerado um excelente osmoprotetor (Hassine et al, 2008). Em plantas superiores, a via biossíntetica de glicina betaína é curta e direta: colina monoxigenase (CMO) converte colina para betaína aldeído, que por sua vez é convertido em betaína pela desidrogenase de betaína aldeído (BADH) – Figura 13. O aumento da expressão de transcritos de BADH em resposta ao estresse osmótico tem sido amplamente observado. Colina monoxidase CH2OH CH2 O2 2H2O + H3C- N - CH3 CH3 Colina Betaina aldeido desidrogenase CHO CH2 H2O CH2 + 2Fd(red) 2Fd(ox) H3C- N - CH3 NAD+ CH3 Aldeido betaina COO- NADH + H+ H3C- N+- CH3 CH3 Glicina betaina Figura 13. Via de biossíntese da glicina betaina em plantas. (Adaptado de Chen & Murata, 2008) Em geral, as espécies glicófitas cultivadas apresentam baixas concentrações de glicina betaina. Em diversas espécies, em especial o arroz, o gene da BADH tem sido transferido com sucesso gerando plantas transgênicas com produção aumentada de glicina betaina. Algumas dessas espécies transformadas, semelhante ao observado para as transformações com prolina, têm mostrado melhor aclimatação em níveis elevados de NaCl quando comparadas com as plantas não transformadas. Apesar das concentrações desse soluto protetor em plantas transgênicas muitas vezes não ser elevadas, essa área da pesquisa é promissora na obtenção de plantas mais resistentes. Entretanto, da mesma forma do que a prolina, o papel benéfico de glicina betaina em plantas transgênicas ainda não é totalmente claro. Alguns autores têm sugerido que o fato desse soluto se acumular preferencialmente em organelas como o cloroplasto, poderia assim exercer seu papel protetor uma vez que comumente as concentrações determinadas são no tecido ou na célula inteira. Como os cloroplastos representam uma pequena fração do volume celular, as medidas de concentração poderiam estar muito subestimadas. De fato, essa é uma limitação metodológica que é válida para outros solutos assim como para interpretação de outras medidas de biomoléculas envolvidas com compartimentalizaçao celular, tal como atividade enzimática. Outros solutos importantes no ajustamento osmótico sob estresse salino Diversos outros solutos são importantes no ajustamento osmótico de diversas espécies vegetais, destacando-se: açucares solúveis (sacarose e glicose), 170 Joaquim A. G. Silveira et al. manitol e trealose, dentre outros. Além disso, o conjunto dos aminoácidos livres totais e dos açucares solúveis representam quantitativamente os solutos orgânicos mais importantes no ajustamento osmótico ou contribuição para a manutenção do estado hídrico em níveis aceitáveis durante o estresse salino. Além do fator quantitativo, esses solutos se acumulam preferencialmente no citosol e organelas, fazendo o contraponto na homeostase osmótica com os íons salinos que se acumulam preferencialmente nos vacúolos. Outro soluto frequentemente negligenciado na questão do ajustamento osmótico de plantas sob estresse salino é o K+. Este íon é um componente essencial para o ajustamento osmótico celular além de influenciar no estado hídrico por participar da abertura e fechamento estomático. A sua importância no ajustamento osmótico de plantas sob estresse salino deve ser vista pelo menos sob três aspectos: (1) ele atinge concentrações elevadas nas células e se concentra preferencialmente no citosol; (2) não se liga quimicamente a nenhuma biomolécula, portanto, possui alta atividade osmótica; (3) é capaz de causar antagonismo com os íons Na+. Infelizmente, na maioria das espécies, incluindo as halófitas, sob condições de elevadas concentrações Na+ as concentrações de K + são geralmente diminuídas devido ao mecanismo de competição ou antagonismo entre eles. Entretanto, esse processo é bastante dependente do genótipo e por isso tem sido apontado como um alvo potencial na obtenção de genótipos mais resistentes ao estresse salino por meio de índices simples como a relação K+/ Na+ em diferentes órgãos ou tecidos. HOMEOSTASE IÔNICA Considerações iniciais O aumento na concentração de sais na solução externa das raízes induz aumento no fluxo de íons na direção das células da epiderme, acarretando elevação nas concentrações iônicas no apoplasto, nas proximidades da membrana plasmática. Indubitavelmente, essa situação levará ao influxo crescente de íons salinos, quer seja por canais não seletivos, quer seja por meio de canais de íons específicos (ex. canais de K+) ou por meio de proteínas transportadoras de cátions e anions específicas para outros íons nutrientes da planta. Esse processo levará ao aumento progressivo na concentração de sais no citosol e vacúolos até que uma nova homeostase se estabeleça. Nesse processo, proteínas transportadoras e canais de membranas podem ter suas sínteses aumentadas ou diminuídas (expressão gênica) no sentido de compatibilizar um balanço favorável ao metabolismo celular. Essa área do metabolismo celular ligada à resistência das plantas ao estresse salino tem recebido muita atenção da pesquisa nos últimos anos. Neste caso, as plantas do tipo halófitas têm funcionado como modelo devido sua grande compatibilidade para conviver com concentrações extremas de sais. Vias de transporte de Na+ na célula vegetal O influxo de sódio nas células das raízes é um processo predominantemente passivo, sendo mediado por canais iônicos e sistemas de transporte do tipo uniporte. As principais vias envolvidas no influxo de Na+ na celular vegetal são os transportadores de potássio de alta afinidade (HKT), os transportadores de cátions de baixa afinidade (LCT), os canais de cátions insensíveis a voltagem (VICs) e os canais de cátions não seletivos (NSCC) (Apse & Blumwald, 2007). Embora o papel específico de cada um desses sistemas de transporte possa variar em função da espécie e/ou das condições de crescimento, fortes evidências sugerem que esses diferentes tipos de sistemas de transporte podem operar em conjunto durante a absorção de Na+. As proteínas da família HKT representam um sistema de co-transporte tipo simporte Na+/K+, uma via seletiva para o influxo do Na+ na célula. Em arroz (Oryza sativa), a expressão de alguns membros que compõem a família do HKT reforça o seu papel no influxo do Na+. O gene OsHKT2;1 está presente em folhas e raízes de variedades de arroz resistente e sensível ao sal. A expressão do OsHKT2;1 na variedade resistente é reduzida em resposta a salinidade, indicando um mecanismo de redução na absorção de Na+ associado com a tolerância ao estresse salino (Kader et al., 2006). O HKT também atua como simporte Na+/K+ em trigo e a redução de sua expressão na espécie resulta no menor acúmulo de Na+ na raiz, o que está associado com o aumento da resistência ao sal. Embora represente uma importante via para o influxo de Na+ na célula vegetal, as proteínas do tipo HKT não são as principais vias para esse transporte. O transporte por canais iônicos (proteínas mediadoras da passagem de íons) é considerado a via mais importante, em termos quantitativos, para a entrada passiva do Na+ na célula vegetal. Nesse sentido, recentes estudos têm demonstrado que os canais de cátions não seletivos (NSCC) são as principais vias de influxo de Na + nas células sob salinidade elevada (Tester & Davenport, 2003). Apesar de existirem muitos genes candidatos que possam codificar os NSCC, a identidade desses canais (proteínas) permanece pouco clara. Duas famílias desses canais de cátions não seletivos, os CNGCs – canais ativados por ciclonucleotídios, e os GLRs – canais ativados por glultamato têm sido sugeridos como Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas candidatos a canais do tipo NSCC (Tester & Davenport, 2003). A Figura 14 mostra as principais vias de influxo de Na+ nas células vegetais. pH = 5,5 – 5,7 + + K =Na Na+>K+ K+>Na+ K+ Na+ Exterior ∆ψ = -140 mv Citosol NORC VIC AKT1 HKT1 pH = 7,0 – 7,4 Figura 14. Vias de influxo de sódio localizadas na plasmalema de células vegetais. Diferentes carreadores de potássio podem mediar o influxo de Na+ para dentro da célula. Os canais de potássio de baixa afinidade (AKT1) possuem alta seletividade K +/Na+. O canal de potássio de alta afinidade (HKT1) é um simporte K +/ Na+. Os canais de cátions insensíveis a voltagem (VICs) apresentam uma maior seletividade Na+/K+. Os canais retificadores de cátions (NORC) são vias ativadas por Ca++ e não discriminam entre K+ e Na+. (Adaptado de Blumwald et al., 2000) Exclusão e compartimentalização do Na+ celular A homeostase iônica intracelular é fundamental para a fisiologia normal das células vivas. Assim, a estrita regulação do controle dos mecanismos de influxo e efluxo de íons é essencial para a manutenção da concentração de íons tóxicos em níveis baixos e para o acúmulo de íons essenciais (Apse & Blumwald, 2007). As células vegetais empregam o transporte ativo primário, mediado por H + ATPases, associado ao transporte ativo secundário, realizado por canais e carreadores em sistemas de co-transporte, para manter uma elevada relação K +/Na+ no citosol. Essa é uma condição essencial para a manutenção da turgescência celular e manutenção da homeostase metabólica celular. Os mecanismos de transporte presentes nas células vegetais estão relacionados com a tolerância ao excesso de Na+ no meio externo. Essa tolerância é conferida pela exclusão do Na+ celular através da plasmalema ou o seu acúmulo nos vacúolos, através do tonoplasto, evitando acúmulo no citosol (Apse & Blumwald, 2007). Os sistemas de contratransporte Na + /H + , presentes na plasmalema e no tonoplasto, são essenciais para a homeostase dos íons Na+ e K+ na célula. Esses sistemas de transporte representam um custo energético pelo fato 171 das bombas de H+ (H+-ATPase ou ATPases dependentes do fluxo de prótons) fornecerem a força eletromotriz necessária para a exclusão de Na+ a partir do citosol para dentro do vacúolo ou para o meio externo celular (apoplasto), que ocorre sempre contra um gradiente eletroquímico. As bombas de prótons promovem o fluxo de H + através das membranas pelo sistema de transporte ativo primário, utilizando energia química na forma de ATP. Por outro lado, os sistemas de contratransporte Na +/H + realizam o transporte ativo secundário, onde o fluxo do sódio contra o gradiente eletroquímico ocorre sempre acoplado ao fluxo de prótons, previamente bombeados pelas H + ATPases, a favor do seu gradiente de concentração. Duas classes de sistemas de contratransporte Na+/H+, que atuam na exclusão do Na+ citosólico, estão presentes em plantas, os transportadores SOS1 (Salt Overly Sensitive) na plasmalema e os NHX localizados no tonoplasto (Blumwald et al., 2000). As proteínas SOS1 estão localizadas na membrana plasmática e sob condições de excesso de Na+ no citosol podem atuar na sua exclusão pelo contratransporte Na+/ H+ (Blumwald et al., 2000; Shi et al., 2002). Nesse sistema de co-transporte, a maior concentração de H+ no exterior da célula, gerada e mantida pela ação de H + ATPases da plasmalema, gera um gradiente de concentração de H+ entre os lados da plasmalema. Este gradiente de prótons representa a força eletromotriz para impulsionar a ação do contratransporte Na+/H+ realizado pela SOS1, que acopla o influxo de H+ na célula, a favor do seu gradiente de concentração, com o efluxo de Na+ da célula contra seu gradiente de concentração. No sistema radicular, as proteínas SOS1 podem está presentes na plasmalema de células epidérmicas, que podem excluir o Na+ citosólico para o exterior, bem como na plasmalema de células que circundam o estelo ou nas célualas do parênquima adjacentes ao xilema. Quando localizada em torno do xilema da raiz, a exclusão do Na+ realizada por esses transportadores pode levar a deposição desse íon no xilema e consequentemente no fluxo transpiratório, favorecendo transferência do Na + para a parte aérea. Dessa foram, esse sistema de transporte, que corresponde a um mecanismo de exclusão celular do Na+, pode está diretamente envolvido com mecanismos que regulam o transporte e a distribuição desse íon na planta. Além de atuar no contratransporte Na + /H + , as proteínas SOS1 também atuam como sensores de plasmalema responsável pela percepção do excesso de Na+ extracelular. Conforme observado na Figura 15 essa proteína está localizada na plasmalema onde pode servir como um receptor de sinal, podendo desencadear uma 172 Joaquim A. G. Silveira et al. resposta metabólica de sinalização através de proteínas quinases dependentes de Ca 2+ no citosol. Por esse modelo, a presença do Na+ externo leva a um aumento no teor de Ca2+ livre no citosol que modula a atividade de proteínas dependentes desse íon. Por essa via, a percepção e a transdução de sinal do efeito iônico da salinidade podem resultar na modulação da expressão de genes ligados com a atividade de proteínas transportadoras envolvidas com a exclusão de Na + do citosol (Zhu, 2003). Na+Ext Sensor SOS3 Plasmalema Ca2+ Na+ SOS2 AtNHX1 Tonoplasto H+ Vacúolo Na+ SOS1 Plasmalema H+ Figura 15. Esquema geral mostrando o envolvimento de transportadores de Na+ de plasmalema e de tonoplasto na presença de excesso de NaCl. A proteína SOS1 da plasmalema atua na exclusão do excesso de Na+ celular, pelo contratransporte Na+/H+ e na percepção do Na+ extracelular. A SOS1 é ativada pela ação das proteínas quinases dependentes de cálcio SOS2 e SOS3. A via SOS3-SOS2 também ativa a proteína NHX1, outro sistema de contratransportador Na+/H+ do tonoplasto, que realiza a inclusão do Na+ no vacúolo (Adaptado de Zhu, 2003) A exemplo do mecanismo de co-transporte realizado pela SOS1 da plasmalema, a NHX1 realiza um transporte ativo secundário, aproveitando a energia do gradiente eletroquímico gerado pelas H +ATPases do tonoplasto como força eletromotriz. O gene da proteína NHX foi inicialmente identificado em plantas de Arabidopsis thaliana, denominado para essa espécie como AtNHX1 (Gaxiola et al., 1999). A proteína NHX1 está localizada no tonoplasto, onde atua como um contratransportador Na+/H+ acoplando a exclusão do próton, a favor do gradiente de concentração, com a inclusão do Na + no vacúolo, contra um gradiente eletroquímico. A ação da proteína transportadora NHX1 do tonoplasto pode atenuar a toxicidade iônica causada pelo estresse salino nas plantas. Essa proteção é principalmente atribuída a compartimentalização do excesso de Na + citosólico para dentro do vacúolo, evitando danos em estruturas e macromoléculas celulares. Esse mecanismo de tolerância à salinidade tem se mostrado eficiente em plantas transgênicas de Arabidopsis (Apse et al., 1999), fumo (Wu et al., 2004) e algodão (He et al., 2005), apresentando aumento de expressão do gene NHX que codificam para a síntese dessa proteína. Em Arabidopsis, o aumento da expressão do gene AtNHX resultou no significativo aumento da resistência à salinidade das linhagens transformadas, comparadas aquelas do tipo selvagem (Figura 16). Esse aumento de resistência foi correlacionado com o nível de expressão dos transcritos (mRNA) do gene e com o aumento do conteúdo e atividade da proteína NHX (Apse et al., 1999). Em algodão a resistência diferencial de cultivares ao estresse salino está relacionada com a expressão do gene GhNHX (Wu et al., 2004). Quando as cultivares ZM3, resistente a salinidade e as ZMS17 e ZMS12, sensíveis a salinidade, foram expostas 400 mM de NaCl foi observado que o nível de mRNA do GhNHX em folhas do ZM3 foi 3 e 7 vezes maior comparado ao observado nas cultivares ZMS17 e ZMS12, respectivamente. A maior resistência à salinidade conferida pelo GhNXH no algodoeiro foi transferida para plantas de fumo pela inserção do cDNA desse gene. Nas plantas de fumo expressando o gene GhNHX de algodoeiro, foi observado um significativo aumento da resistência ao Figura 16. Plantas de Arabidopsis tipo selvagem (A) e transformada (B) apresentando nível elevado de expressão do gene AtNHX expostas a concentrações crescentes de NaCl durante 16 dias. (A) controle; (B) 50 mM; (C) 100 mM; (D) 150 mM e (E) 200 mM. (Extraido de Apse et al., 1999) Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas estresse salino. As plantas transgênicas, expressando o GhNHX, a diferença do aspecto visual e da produção de massa seca quando expostas a concentrações crescentes de NaCl foi marcante (Figura 17). A maior capacidade de crescimento, baseada na massa seca, foi relacionada com a indução da expressão do gene GhNHX, demonstrando que esse gene é um forte alvo para manipulação genética de plantas visando o aumento de resistência à salinidade. Figura 17. Plantas de fumo do tipo selvagem (WT) e transformadas (T) expressando o gene GhNHX de algodão (Gossypium hirsutum) expostas a concentrações crescentes de NaCl durante 30 dias. As plantas transgênicas foram obtidas pela inserção do cDNA do gene GhNHX no genoma do fumo. (Extraído de Wu et al., 2004) HOMEOSTASE REDOXI E PROTEÇÃO OXIDATIVA Considerações iniciais Mesmo mantendo um equilíbrio favorável na nova homeostase metabólica, envolvendo o balanço iônico e hídrico nas células, na condição de estresse salino a planta necessita ainda desenvolver novos mecanismos de proteção contra estresses secundários. Dentre esses se destaca o estresse oxidativo, que poderá surgir devido a mudanças causadas pela salinidade. Esses efeitos são mais importantes nas folhas expostas a um ambiente desfavorável tais como aqueles que apresentam baixa umidade do ar, temperaturas elevadas e alta radiação solar. Em conjunto, esses fatores podem intensificar os danos oxidativos induzidos pelo estresse salino. Nessas condições, o fechamento estomático, induzido pela salinidade, pode causar profundo desbalanço no processo de fotossíntese, iniciado por um excesso de energia nos sistema de captação de luz, transporte de elétrons e fotossistemas dos cloroplastos. Esse excesso de energia passa a não ser aproveitado eficientemente pelo processo de redução do CO 2 , culminando com um desbalanço entre as reações luminosas e de fixação de 173 carbono. As Figuras 18 e 19 mostram os principais sítios de produção de EROs (Espécies Reativas de Oxigênio) na célula vegetal, e os primeiros eventos envolvendo a planta inteira relacionados com os distúrbios nas trocas gasosas que podem levar a geração excessiva dessas EROs. Fotossíntese, fotorespiração e produção de EROs O excesso de poder redutor na forma de elétrons nos fotossistemas, se não dissipado de maneira eficaz, Figura 18. Esquema mostrando que a restrição estomática causada por estresse salino poder levar a restrição na fixação de CO 2 e conseqüente desbalanço na fotossíntese, resultando no aumento na produção de EROs e danos oxidativos, que poderão causar morte celular. (Adaptado de Bray et al., 2000) Luz PSII Cloroplasto PSI Peroxissomo Glicolato O2•− H2O2 Fixação de CO , Fotorrespiração2 O2 NADP NADPH oxidase H2O2 Glioxilato Ciclo Krebs Glicina H2O2 Glicina SOD •− O2 NADH CTE NADH Mitocôndria Serina NADP O2•− Plasmalema H2O2 Peroxidases H2O + O2 Figura 19. Principais sítios de produção de EROs na célula vegetal em tecidos fotossintetizantes. Os principais sítios celulares, responsáveis pela produção de EROs, são o cloroplasto, peroxissomo e a mitocôndria. Além desses, pode ocorrer a geração de EROs no espaço apoplasto, pela ação da enzima NADPH oxidase localizada na plasmalema (Adaptado de Œlesak et al., 2007) 174 Joaquim A. G. Silveira et al. poderá reduzir o O2 convertendo-o em diferentes tipos de EROs, principalmente o oxigênio singleto (1O2), radicais superóxido (O 2•”), peróxido de hidrogênio (H 2O 2) e radical hidroxil ( • OH). Além disso, sob condições adversas, o processo de fotorespiração pode ser intensificado, aumentando a produção de peróxido de hidrogênio nas folhas, através de reação nos peroxisomos. Em relação à capacidade de produção de EROs em tecidos fotossintéticos, os cloroplastos são considerados as principais organelas geradoras, seguidos pelos peroxissomos e mitocôndrias (Foyer & Noctor, 2003). Nos cloroplasto a geração de EROs pode ocorrer pela fotorredução direta do oxigênio molecular, gerando o radical superóxido, seguido da produção de peróxido de hidrogênio oriundo da ação da dismutase do superóxido, localiza nessa organela. Nessa sequência de reações, o radical superóxido (O2•”) é formado no fotossistema I (PSI) pela transferência de elétrons da água para o O2, via o sistema de transporte da ferredoxina, processo denominado reação de Mehler. O O 2•” gerado é em seguida dismutado para H 2 O 2 pela ação de uma isoforma da enzima dismutase do superóxido (Fe-SOD), localizada nos cloroplastos. O peróxido de hidrogênio produzido é reduzido a H 2O e O2 pela peroxidase do ascorbato cloroplástica, evitando assim dano oxidativo. Embora a formação de EROs nos cloroplastos seja uma condição natural da fotossíntese, diversos estímulos ambientais podem causar distúrbios no metabolismo do cloroplasto e intensificar essa produção, causando dano oxidativo. O fechamento estomático, induzido pela salinidade, causa desequilíbrio entre as fases fotoquímicas e de redução do carbono (Silva et al., 2010b). Como consequência, ocorre um aumento na relação NADPH/NADP+ no estroma devido à redução de funcionamento do Ciclo de Calvin, que consome o NADPH, acarretando diminuição no conteúdo de NADP+, o principal aceptor de elétrons do PSI. Sob condições de alta luminosidade esse distúrbio é exacerbado em função do excesso de elétrons nos sistemas de transporte dos tilacóides e dos fotossistemas, os quais se tornam sítios potenciais para fotorredução do O2 e produção de EROs. Um dos principais distúrbios metabólicos relacionados com a eficiência do processo fotossintético é a ocorrência e a intensificação do processo fotorrespiratório (Silva et al., 2010c). A fotorrespiração é uma rota metabólica que descreve a absorção de luz dependente de O2 associada à liberação de CO2. A reação inicial da fotorrespiração é a oxigenação da ribulose 1,5-bisfosfato (RuBP) pela Rubisco, formando 3-fosfoglicarato e 2-fosfoglicolato. Aproximadamente 75% do carbono que entra como 2fosfoglicolato é reciclado para 3-fosfoglicerato por uma série complexa de reações envolvendo enzimas localizadas nos cloroplastos, peroxissomos e mitocôndrias. Este conjunto de reações que representa o maior destino metabólico do carbono glicolato, constitui a via fotorrespiratória. Em adição às enzimas diretamente envolvidas na reciclagem do carbono, outras enzimas possuem importantes papéis ligados aos processos como a assimilação de nitrogênio. O processo fotorrespiratório provavelmente demanda mais energia que a fixação de CO 2 . Entretanto, a oxigenação da RuBP aumenta significativamente a energia requerida por molécula de CO2 fixado. Na realidade, os processos iniciados pela oxigenação podem ser considerados em termos metabólicos, ser um ciclo fútil que usa ATP e poder redutor para evitar densidades de energia de excitação potencialmente deletérias para o aparato fotossintético. Um efeito da via fotorrespiratória, entretanto, é prevenir danos aos centros de reação quando a energia luminosa está em excesso. Na sequência de reações para regeneração do 3fosfoglicerato a partir do 2-fosfoglicerato ocorre a produção de H 2O 2 nos peroxissomos. No cloroplasto o 2fosfoglicerato é desfosforilado à glicolato, pela ação da fosfatase do fosfoglicolato e em seguida, o glicolato é convertido à glioxilato no peroxissomo, pela oxidase do glicolato. Nessa reação, ocorre a geração simultânea de H2O2 que faz do peroxissomo uma das principais organelas produtoras de EROs da célula vegetal. Devido à meia vida relativamente longa e sua permeabilidade as membranas, o H 2O 2 produzido pode causar dano oxidativo no peroxissomo bem como em outros sítios celulares. Sob condições ambientais que favoreçam a atividade de oxigenase da Rubisco, como a restrição estomática imposta pela salinidade, o processo fotorrespiratorio pode ser intensificado. Nessas condições a produção do H2O2 nessa organela é significantemente aumentada e os danos oxidativos podem se tornar bastante acentuados, caso os sistema de proteção presentes na célula não eliminem o excesso de H 2 O 2 produzido. Dentre os mecanismos de proteção a enzima catalase (CAT) presente no peroxissomo é essencial para a remoção do excesso de H 2O 2 produzido sob tais condições, por realizar a proteção da própria organela, além de evitar o vazamento do H 2 O 2 para outros locais da célula, conforme mostra a Figura 20. Mecanismos de proteção oxidativa A produção em excesso de EROs no tecido vegetal poderá levar a uma situação metabólica extrema no ambiente celular, em que às espécies reativas irão se Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas Figura 20. Esquema mostrando a integração metabólica entre citosol, cloroplasto, mitocôndria e peroxissomos com destaque para a produção de EROs durante a via fotorrespiratória e o papel protetor das catalases (CAT) na eliminação do H2O2 produzido no peroxissomo. (Adaptado de Foyer & Noctor, 2000) acumular progressivamente e acarretar danos por meio da peroxidação de lipídeos de membrana, proteínas e ácidos nucléicos, podendo levar à morte celular. Para lidar com esses distúrbios metabólicos as plantas dispõem de um complexo sistema de proteção oxidativa, representado por pigmentos, antioxidantes de baixa massa molecular e enzimas catalisadoras de reações de eliminação (desintoxicação) de EROs. Todo esse arsenal bioquímico é constituído por uma fração constitutiva (já existente na célula antes do estresse) e por uma fração induzível, que é expressa em resposta ao surgimento do estresse. Sob condições salinas, o balanço entre a produção das EROs e a capacidade de remoção pela célula vegetal, poderá levar, ou não, a um certo grau de aclimatação da espécie ou genótipo ao estresse oxidativo causado pela salinidade. De fato, pesquisas nos últimos anos têm mostrado evidências de que a resistência ao estresse salino pode estar ligada como a capacidade de proteção oxidativa, atribuída a componentes de proteção enzimática e não enzimática. A produção de EROs ocorre naturalmente associado ao metabolismo respiratório e fotossintético, representando uma condição metabólica normal das células vegetais. Em função dessa condição, a célula vegetal possui uma complexa rede de sistemas antioxidativos constituída por componentes de natureza enzimática e não enzimática que atua continuamente na proteção oxidativa. No entanto, em plantas sob salinidade pode ocorrer um aumento na produção de EROs devido ao desbalanço metabólico entre os sistemas de produção de EROs e de proteção oxidativa celular, podendo resultar em danos oxidativos severos. 175 Nessas condições os mecanismos de proteção oxidativa, representados principalmente pelos antioxidantes não enzimáticos ascorbato e glutationa, estão estritamente relacionados com a resistência ao estresse oxidativo em diferentes espécies. Além desses, a maior proteção oxidativa frente ao estresse salino é dependente também das principais enzimas oxidativas, como a dismutase do superóxido (SOD), a catalase (CAT), a peroxidase do ascorbato (APX), a redutase de glutationa (GR), a redutase do ácido monodeidroascórbico (MDHAR) e a redutase do ácido deidroascórbico (DHAR). A biossíntese do ascorbato (ácido ascórbico) pode ocorrer em tecidos fotossintetizantes e não fotossintetizantes, indicando que sua produção não depende diretamente do processo fotossintético. No entanto, a localização exata da biossíntese do ascorbato na célula vegetal não está muito clara, embora estudos indiquem que possa ocorrer no citosol e mitocôndrias (Shao et al. 2008), ou nos cloroplastos, organela que possui altas concentrações de ascorbato. No vacúolo celular a concentração do ascorbato está próxima de 0,6 mM, enquanto que em alguns compartimentos dos cloroplastos e do citosol pode atingir concentrações entre 20 e 50 mM. O ascorbato reduzido (ASA) é considerado o mais importante substrato para redução do H2O2 em água e oxigênio molecular na célula vegetal. A APX utiliza duas moléculas de ascorbato como doadoras de elétrons para reduzir uma molécula de H 2O 2 a H 2O e O 2, com a formação de duas moléculas do ácido monodeidroascórbico (MDHA). O MDHA é um radical instável e pode ser rapidamente desprotonado, de forma espontânea, para produzir ascorbato e ácido deidroascórbico (DHA). Além de ocorrer de forma espontânea, à redução do MDHA para ascorbato pode também utilizar doadores de elétrons específicos como o citocromo tipo b, a ferredoxina reduzida ou o NADPH. Na célula vegetal, o ascorbato pode atuar como antioxidante secundário, doando elétrons para a redução do H 2 O 2 na reação catalisada pela APX, ou primariamente, pela interação direta com diferentes EROs, como o H2O2, O2˙¯ , HO˙, 1O2 e hidroperóxidos de lipídios. O ascorbato pode ainda atuar na manutenção do estado reduzido do α–tocoferol, um importante antioxidante não enzimático na fase aquosa, pela redução da sua forma oxidada. O tocoferol (vitamina E) é um antioxidante solúvel em lipídio e capaz de interagir com as EROs e impedir as reações finais que causam peroxidação de lipídios no interior dos diferentes sistemas de membranas da célula vegetal (Ślesak et al., 2007). 176 Joaquim A. G. Silveira et al. A glutationa reduzida (GSH) é um tripeptídeo que ocorre na célula simultaneamente com a forma oxidada GSSG, formando o par redox GSH/GSSG. A glutationa pode ser sintetizada no citosol e/ou nos cloroplastos, onde estão localizadas as enzimas sintetase da γglutamilcisteina e sintetase da glutationa, duas enzimas que compõem a via biossintética desse tripeptídeo. A glutationa reduzida é a forma predominante de grupos SH não protéico, da célula, e está relacionada à regulação da absorção de enxofre no tecido radicular, além de atuar como antioxidante, no tamponamento redox e na expressão de genes de defesa. Nas reações envolvendo a GSH, o grupo SH do resíduo de cisteína é oxidado para produzir GSSG, enquanto que a reação reversa é catalisada pela GR, utilizando NADPH. Na célula um pool de GSH em estado altamente reduzido, mantido pela atividade constante da GR, é necessário para a manutenção da atividade de muitas enzimas e para evitar a formação de pontes dissulfeto entre proteínas, impedindo a agregação e inativação enzimática. Em plantas, os tecidos metabolicamente ativos possuem concentrações relativamente altas de GSH, em torno de 4,5 mM nos cloroplastos. GSH podem atuar no tamponamento redoxi, formando barreiras entre os grupos SH dos resíduos de cisteína das proteínas e as espécies reativas de oxigênio, produzidas durante o metabolismo normal ou quando aumentadas sob condições de estresse. Na célula, as enzimas oxidativas dismutases do superóxido (SODs) são responsáveis pela dismutação do O2•- para H2O2 e O2, sendo elas consideradas a primeira linha de defesa antioxidativa enzimática. A produção do radical superóxido (O2•-) pode ocorrer em qualquer sítio celular que possui cadeia de transporte de elétrons e oxigênio disponível, como as mitocôndrias e os cloroplastos, além daqueles onde ocorrem reação redox, como os microssomos, glioxissomos, peroxissomos, apoplasto e citosol. Em plantas, as SODs podem ser encontradas em todos os compartimentos da célula capazes de produzir EROs, particularmente em cloroplastos, mitocôndria e peroxissomos, os principais sítios de produção de EROs na célula vegetal. As SODs constituem uma família de metalo-proteínas que está subdividida em três grupos distintos, dependendo do co-fator enzimático: Fe-SOD, Mn-SOD e Cu/ZnSOD, localizadas em diferentes sítios celulares. As isoformas Fe-SOD estão localizadas nos cloroplastos, enquanto as Mn-SOD podem ser encontradas nas mitocôndrias e peroxissomos. As isoformas Cu/Zn-SOD podem ser encontradas simultaneamente nos cloroplastos, citosol e no espaço extracelular (Alscher et al., 2002). Como resultado da ação das SODs na proteção oxidativa ocorre a produção imediata do H2O2, outro tipo de EROs que é removido da célula pela ação de diferentes peroxidases. As peroxidases mais importantes na proteção oxidativa do tecido vegetal são as APXs e as CATs. As diferentes isoformas da APX estão amplamente distribuídas dentro da célula vegetal, enquanto a CAT está localizada exclusivamente dentro dos peroxissomos. As CATs são enzimas tetraméricas, com quatro subunidades idênticas de 60 kDa, contendo um grupo heme que catalisam a redução do H2O2 para H2O e O2, protegendo a célula dos danos oxidativos oriundos da acumulação excessiva do H 2O 2. Essas enzimas que estão presentes nos peroxissomos, glioxissomos e organelas relacionadas, onde enzimas produtoras de peróxido de hidrogênio, como a glicolato oxidase, estão localizadas. Comparadas com as APXs, as catalases possuem baixa afinidade pelo substrato (H2O2), porém apresentam alta atividade catalítica. Essa diferença de propriedade cinética é atribuída à necessidade da ligação simultânea de duas moléculas de peróxido de hidrogênio ao sítio catalítico das CATs, para que ocorra a reação. Apesar disso, o papel das CATs na proteção oxidativa é extremamente importante, por essas enzimas estarem localizadas em pontos estratégicos da célula, em que há produção localizada de H2O2. Durante a fotorrespiração a catalase é essencial para a remoção do H2O2 gerado no peroxissomo. Em plantas existem três isoformas de CATs, CAT1, CAT2 e CAT3, classificadas em três classes distintas. Na classe I estão as catalases SU2, do algodão, CAT1, de Nicotiana plumbaginifolia, CAT 2, de A. thaliana e CAT-2 do milho. Essas enzimas estão envolvidas com a remoção do H 2 O 2 durante a fotorespiração e são dependentes de luz. A classe II inclui a CAT 2, do feijão (Suzuki et al., 1994), CAT 3, de milho e tomate, CAT 2 da batata, e CAT 1 de A. thaliana, encontradas principalmente no tecido vascular. A classe III inclui a SU1 do algodão, CAT 3 de N. plumbaginifolia, CAT 1 de feijão e CAT 3 de A. thaliana, localizadas nos glioxissomos de sementes. A Figura 21 mostra as principais organelas e sítios celulares onde atuam os principais antioxidantes enzimáticos. As enzimas APXs compõem uma família de isoenzimas com características bastante distintas, localizadas em diversos sítios celulares, como citosol, cloroplastos, mitocôndrias, peroxissomos e glioxissomos (Shigeoka et al, 2002). As APXs cloroplásticas estão localizadas no estroma (sAPX) e nos tilacóides (tAPX). As isoformas citosólicas (cAPX) estão solúveis no citosol, enquanto aquelas presentes nos microcorpos e Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas nas mitocôndrias (mAPX/mitAPX) estão associadas às membranas dessas organelas. As APXs cloroplásticas são monômeros com massa molecular de 37,2 kDa, as de mitocôndria e dos microcorpos possuem 31 kDa, e a citosólica é um homodímero com subunidades de 28 kDa. 177 produção da sua forma oxidada GSSG. A regeneração da GSH ocorre pela ação da GR, que utiliza o NADPH como poder redutor. Apoplasto Cadeia de transporte de elétrons Mitocôndria Citosol Estroma Cloroplasto Membrana do tilacóide Lúmem do tilacóide Sinalização β-oxidação fotorrespiração Microcorpos Figura 21. Esquema mostrando as principais organelas e sítios celulares, bem como os componentes metabólicos envolvidos com os processos de produção e de remoção de EROs na célula vegetal. AsA (ascorbato reduzido); MDAsA (ascorbato oxidado). (Adaptado de Shigeoka et al., 2002) Apesar dessas diferenças, todas as APXs utilizam o ascorbato reduzido (AsA) como doador específico de elétrons para reduzir o H2O2 para H2O e O2. No geral, a enzima APX utiliza dois elétrons intermediários, localizados no átomo de Fe +3 e em um resíduo de triptofano, para catalisar a redução do H2O2. O ciclo de reação inicia-se pela transferência dos elétrons do Fe +3 e do resíduo de triptofano do complexo reduzido APXFe(III)-R para o H2O2, resultando no complexo oxidado APX-Fe(IV)-R+. Em seguida, ocorre a regeneração do estado redox do grupo R, pelo consumo de uma molécula de ASA, seguido da regeneração do complexo APXFe(III), pelo consumo da segunda molécula de ASA. Ao final da reação para cada duas moléculas de ASA oxidada (MDHA) uma de H2O2 é reduzida. O papel da APX na proteção oxidativa ocorre associado com a ação das enzimas GR, MDHAR e DHAR, que compõem a ciclo do ascorbato-glutationa (Figura 22). Esse ciclo é uma rota metabólica essencial na proteção oxidativa e ocorre na mitocôndria, nos cloroplastos e nos peroxissomos. Nessa via a utilização do ascorbato leva a formação da sua forma oxidada, o monodeidroascorbato (MDHA). O MDHA é reduzido para ASA pela enzima redutase do monodeidroascorbato (MDHAR), utilizando NADPH, enquanto que o DHA é reduzido pela redutase de deidroascorbato (DHAR), utilizando glutationa reduzida (GSH). A redução do DHA para regenerar o ascorbato consome GSH, levando a Figura 22. Ciclo ascorbato-glutationa na célula vegetal. APX – Peroxidases de ascorbato; MDHA – Redutase de monodehidroascorbato; DHAR – Redutase de dehidroascorbato; GR – Redutase de glutationa. (Adaptado de Foyer e Noctor, 2000) SELEÇÃO ASSISTIDA COM MARCADORES MOLECULARES A seleção assistida com marcadores moleculares (SAM) consiste em integrar a genética molecular com a seleção fenotípica, através da procura de alelos desejáveis, indiretamente, por meio do uso de marcadores ligados. Quanto mais próximo o marcador molecular estiver do gene ou do conjunto dos genes ligados com o processo fisiológico de resistência à salinidade, mais eficiente será o processo. Uma das técnicas de SAM mais utilizadas com sucesso em algumas culturas é mapeamento de locos controladores de caracteres quantitativos – QTLs (“quantitative Trait Loci”). A vantagem do uso da técnica de QTLs na seleção para resistência ao estresse salino é que os caracteres analisados possuem distribuição contínua e frequentemente são controlados por muitos genes, os quais são altamente influenciados pelo ambiente. Portanto, espera-se que essa técnica possa cobrir a lacuna deixada pela técnica de plantas transgênicas modificadas com um ou pouco genes, a qual tem se mostrado muito limitada na obtenção de plantas mais resistentes nas condições de campo. O uso dos QTLs permitirá a incorporação de um maior número de alelos desejáveis nos indivíduos, portanto, acelerando o melhoramento genético (Flowers, 2004). Alguns trabalhos com tomateiro mostraram que a produtividade sob salinidade foi associada com a participação de QTLs e que as características desses marcadores foram diferentes entre as plantas cultivadas na presença ou na ausência da salinidade. Outros trabalhos têm demonstrado que os QTLs associados com 178 Joaquim A. G. Silveira et al. tolerância variam com o estágio de desenvolvimento da planta. Por outro lado, em outras espécies tem sido demonstrado que os QTLs associados com diferentes tipos de resposta ao estresse salino (germinação, transporte iônico, tipo de fruto) são diferentes entre si, e sofrem influencia do ambiente (Flowers, 2004). A utilização de QTLs para a obtenção de plantas resistentes à salinidade abre uma boa perspectiva porque essa técnica permite a identificação e futuramente a transferência de vários genes ligados com a resistência. Alguns poucos QTLs ligados à tolerância têm sido identificados dentro de alguns genomas, sugerindo que os caracteres possam ser determinados por um limitado numero de locais ou que genes associados com caracteres fisiológicos possam estar agrupados nos cromossomos. De cinco QTLs associados com efeitos da salinidade sobre o crescimento de arabidopsis, dois estavam localizados próximos de dois genes envolvidos com resposta ao estresse salino. Devido à complexidade genética da resistência ao estresse salino, a identificação e transferência de vários genes ligados com os mecanismos de resistência, poderão contribuir no futuro para o melhoramento das culturas. No entanto, o fato de um QTL poder representar muitos, talvez centenas de genes, ainda constitui um desafio no sentido da identificação de locos chaves dentro de um determinado QTL. Outro desafio será descobrir a natureza dos QTLs, por exemplo, se eles são genes reguladores, para no futuro fazer melhoramento vegetal assistido com marcadores de DNA. CONCLUSOES E PESPECTIVAS Centenas de reações bioquímicas e de ação de promotores e expressão de genes deverão estar, de alguma maneira, envolvidas com a resistência ao estresse salino. Essa previsão é baseada não somente a partir da natureza poligênica da resistência à salinidade, mas também no fato de que o metabolismo opera em redes com milhares de reações estreitamente interligadas entre si. Assim, dificilmente genes únicos ou alguns marcadores moleculares serão capazes de controlar a resistência ao estresse salino porque outras reações, outros genes e mudanças ambientais afetam a resposta de genes e moléculas. Outros fatores que fazem aumentar a complexidade para o conhecimento dos mecanismos biomoleculares que controlam a resistência é a própria complexidade das interações planta-estresse e planta-ambiente. A despeito dos enormes avanços da biologia moderna, com o surgimento de um arsenal poderoso de ferramentas representadas pelo conjunto das “ômicas” (genômica, proteômica, metabolômica etc), muito ainda deverá ser feito na pesquisa. A biologia vegetal (bioquímica, biologia molecular, fisiologia vegetal, genética, genética molecular) deverá, primeiramente, descobrir o que faz uma cultivar ser mais resistente à salinidade do que outra. Paradoxalmente, ainda não sabemos por que uma cultivar é mais resistente do que outra! Em seguida, é necessário descobrir como alguns genes podem de fato interferir nos mecanismos biomoleculares de resistência das plantas. Somente após uma compreensão clara de como agem os genes e seus produtos (proteínas e outras biomoléculas), será possível identificar os mecanismos e os marcadores moleculares para serem utilizados de maneira eficaz em programas de melhoramento genético para obtenção de cultivares resistentes à salinidade. Em outras palavras, primeiro deveremos abrir as caixas pretas para depois gerar técnicas e tecnologias seguras, como a transgenia. Na verdade, a biologia vegetal dispõe hoje de uma quantidade imensa de potenciais mecanismos bioquímicos e genes envolvidos com os processos que podem controlar a resistência ao estresse salino. A grande dificuldade parece ser canalizar esforços para que avanços reais de longo prazo não sejam fragmentados ao longo do caminho. Para isso, parece essencial a formação de redes interdisciplinares na grande área de biologia vegetal no sentido da elaboração de programas de longo prazo, tendo como meta a obtenção de produtos finais: a geração de cultivares resistentes à salinidade. Após a seleção dos processos biomoleculares mais limitantes para a resistência ao estresse numa especifica cultura, parece ser essencial a operacionalização desses caracteres selecionados em programas de melhoramento genético. Para isso, a seleção assistida com marcadores moleculares por meio do uso de QTLs parece ser a mais promissora por envolver diversos genes e o ambiente. Em paralelo, programas de melhoramento convencionais com técnicas de cruzamentos intraespecíficos e interespecíficos, com auxilio de marcadores bioquímicos, moleculares e fisiológicos, também devem ser estimulados. Por outro lado, a técnica da transgenia com plantas transformadas com um ou pouco genes parece ter seu potencial maior como ferramenta para estudos de mecanismos biomoleculares envolvidos a resistência ao estresse salino. O conjunto dos resultados obtidos nos últimos anos com essa abordagem tem mostrado sua limitação na produção de cultivares com atributos favoráveis para resistência ao estresse salino em cultivos comerciais. Mecanismos biomoleculares envolvidos com a resistência ao estresse salino em plantas REFERÊNCIAS Alscher, R. G.; Erturk, N.; Heath, L. S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. Journal of Experimental Botany, v.53, p.1331-1341, 2002. Apse, M. P.; Aharon, G. S.; Snedden, W. A.; Blumwald, E. Salt Tolerance Conferred by Overexpression of a Vacuolar Na+/ H+ Antiport in Arabidopsis. Science, v.285, p.1256-1258, 1999. Apse, M. P.; Blumwald, E. Na + transport in plants. FEBS Letters, v.581, p.2247-2254, 2007. Blumwald, E.; Aharon, G. S.; Apse, M. P. Sodium transport in plant cells. Biochimica e Biophysica Acta v.1465, p.140151, 2000. Bray, E. A.; Bailey-Serres, J.; Weretilinik, E. Responses to abiotic stresses. In: Buchanan, B. B., Gruissem, W., Jones, R. L. Biochemistry and Molecular Biology of Plants. Rockville: American Society of Plant Physiologists, 2000. Chen, T. H. H.; Murata, N. Glycinebetaine: an effective protectant against abiotic stress in plants: review, Trends in Plant Science, v.13, p.499-505, 2008. Flowers, T. J. Improving crop salt tolerance. Journal of Experimental Botany, v.55, p.307-319, 2004. Foyer, C. H.; Noctor, G. Tansley Review No. 112 Oxygen processing in photosynthesis: regulation and signaling. New Phytologist, v.146, p.359-388, 2000. Foyer, C. H.; Noctor, G. Redox sensing and signalling associated with reactive oxygen in chloroplasts, peroxisomes and mitochondria. Physiologia Plantarum, v.119, p.355-364, 2003. Freitas, J. B. S. Respostas fisiológicas ao estresse salino de duas cultivares de feijão caupi. Fortaleza: UFC, 2006. 113p. Tese Doutorado Gaxiola, R. A.; Rao, R.; Sherman, A.; Grisafi, P.; Alper, S. L.; Fink, G. R. The Arabidopsis thaliana proton transporters, AtNhx1 and Avp1, can function in cation detoxification in yeast. Proc. Nat Acad. Sci., v.96, p.1480-1485, 1999. Grover, A.; Sahi, C.; Sanan, N.; Grover, A. Taming abiotic stresses in plants through genetic engineering: current strategies and perspective. Plant Science, v.143, p.101-111, 1999. Hasegawa, P. M.; Bressan, R. A. Plant Cellular and molecular responses to high salinity. Annual Review of Plant Physiology and Plant Molecular Biology, v.51, p.463-499, 2000. Hassine, A. B.; Ghanem, M. E.; Bouzid, S.; Lutts, S. An inland and a coastal population of the Mediterranean xerohalophyte species Atriplex halimus L. differ in their ability to accumulate proline and glycinebetaine in response to salinity and water stress. Journal of Experimental Botany. v.59, p.1315-1326, 2008. He, C.; Yan, J.; Shen, G.; Fu, L.; Holaday, A. S.; Auld, D.; Blumwald, E.; Zhang, H. Expression of an Arabidopsis Vacuolar Sodium/Proton Antiporter Gene in Cotton Improves Photosynthetic Performance Under Salt Conditions and Increases Fiber Yield in the Field. Plant Cell Physiology, v.46, p. 1848-1854, 2005. 179 Kader, M. A.; Seidel, T.; Golldack, D.; Lindberg, S. Expressions of OsHKT1, OsHKT2 and OsVHA are differently regulated under NaCl stress in salt sensitive and salt-tolerant rice (Oryza sativa L.) cultivars. Journal of Experimental Botany, v.57, p.4257–4268, 2006. Maia, J. M.; Macedo, C. E. C.; Voigt, E. L.; Freitas, J. B. S.; Silveira, J. A. G. Antioxidative enzymatic protection in leaves of two constrasting cowpea cultivars under salinity. Biologia Plantarum, v.54, p.159-163, 2010. Munns, R.; Tester, M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, v.59, p.651-681, 2008 Rocha, I. M. A. Regulação metabólica da acumulação de prolina em folhas de cajueiro expostas ao estresse salino. Fortaleza: UFC, 2003. 104p. Tese Doutorado Sakamoto, A.; Murata, N. Genetic engineering of glicyne betaine synthesis in plants: current status and implication for enhancement of stress tolerance. Journal of Experimental Botany, v.51, p.81-88, 2000. Shao, H. B.; Chu, L. Y.; Lu, Z. H.; Kang, C. M. Primary antioxidant free radical scavenging and redox signaling pathways in higher plant cells. International Journal of Biological Sciences, v.4, p.8-14. 2008. Shi, H.; Quintero, F. J.; Pardo, J. M.; Zhu, J. K. The Putative Plasma Membrane Na+/H+ Antiporter SOS1 Controls LongDistance Na+ Transport in Plants. The Plant Cell, v.14, p.465-477, 2002. Shigeoka, S.; Ishikawa, T.; Tamoi, M.; Miyagawa, Y.; Takeda, T.; Yabuta, Y.; Yoshimura, Y. Regulation and function of ascorbate peroxidase isoenzymes. Journal of Experimental Botany, v.53, p.1305-1319, 2002. Silva, E. N.; Ferreira-Silva, S. L.; Fontenele, A. V.; Viégas, R. A.; Silveira, J. A. G. Photosynthetic changes and protective mechanisms against oxidative damage subjected to isolated and combined drought and heat stresses in Jatropha curcas plants. Journal of Plant Physiology, 2010c doi 10.1016/j.jplph.2010.03.005. Silva, E. N.; Ferreira-Silva, S. L.; Viégas, R. A.; Silveira, J. A. G. The role of organic and inorganic solutes in the osmotic adjustment of drought-stressed Jatropha curcas plants. Environmental and Experimental Botany, 2010a doi 10.1016/ j.envexpbot.2010.05.001. Silva, E. N.; Ribeiro, R. V.; Ferreira-Silva, S. L.; Viégas, R. A.; Silveira, J. A. G. Comparative effects of salinity and water stress on photosynthesis, water relations and growth of Jatropha curcas plants, Journal of Arid Environments, 2010b doi:10.1016/j.jaridenv.2010.05.036 Silva, E. N.; Silveira, J. A. G.; Rodrigues, C. R. F.; Lima, C. S.; Viégas, R. A. Contribution of organic and inorganic solutes to osmotic adjustment of physic nut under salinity. Pesquisa Agropecuária Brasileira, v.44, p.437-445, 2009. Silveira, J. A. G.; Araújo, S. A. M.; Lima, J. P. M. S.; Viégas, R. A. Roots and leaves display contrasting osmotic adjustment mechanisms in response to NaCl-salinity in Atriplex numularia. Environmental and Experimental Botany, v.66, p.1-8, 2009. 180 Joaquim A. G. Silveira et al. Slesak, I.; Libik, M.; Karpinska, B.; Karpinski, S.; Miszalski, Z. The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses. Acta Biochimica Polonica, v.54, p.39-50, 2007. Suzuki, M.; Ario, T.; Hattori, T.; Nakamura, K.; Asahi, T. Isolation and characterization of two tightly linked catalase genes from castor bean that are differentially regulated. Plant Mo1 Biol, v.25, p.507-516, 1994. Tester, M.; Davenport, R. Na+ Tolerance and Na+ Transport in Higer Plants. (2003). Annals of Botany, v.91, p.503-527, 2003. Wu, C. A.; Yang, G. D.; Meng, Q. W.; Zheng, C. C. The Cotton GhNHX1 Gene Encoding a Novel Putative Tonoplast Na+/ H+ Antiporter Plays an Important Role in Salt Stress. Plant Cell Physiology, v.45, p.600-607, 2004. Zhu, J. K. Regulation of ion homeostasis under salt stress. Current Opinion in Plant Biology, v.6, p.441-445, 2003. 12 Biossalinidade e produção agrícola Pedro D. Fernandes1, Hans R. Gheyi2, Alberício P. de Andrade1 & Salomão de S. Medeiros1 1 2 Instituto Nacional do Semi-Árido Universidade Federal do Recôncavo da Bahia Introdução Halofitismo Ecofisiologia das halófitas Ecofisiologia da adaptação ao estresse salino Escape, tolerância ou resistência Adaptações morfológicas e anatômicas Germinação - Propagação via vegetativa Absorção, transporte e acumulação de íons - Metabólitos orgânicos e ajustamento osmótico Eficiência de uso da água e fotossíntese Outros fatores considerados na ecofisiologia das halófitas Salinidade x Produção Espécies para a agricultura salina Cultivos biossalinos Água do mar na agricultura biossalina Aspectos técnicos e econômicos Sustentabilidade Exemplos de agricultura irrigada com água do mar Referências Manejo da salinidade na agricultura: Estudos básicos e aplicados ISBN 978-85-7563-489-9 Fortaleza - CE 2010 182 Pedro D. Fernandes et al. Biossalinidade e produção agrícola INTRODUÇÃO Em nível global, a cada ano vem declinando a taxa de aumento populacional, o que poderia ser alvissareiro, considerando a necessidade de produzir alimentos e suprir as demandas de tanta gente. Entretanto, tal declínio em nada diminui as perspectivas sombrias para o futuro, exigindo maior responsabilidade de governos e, principalmente, maior compromisso dos organismos de CT&I, em gerar novos conhecimentos para aumentar a produção de alimentos. Mesmo com a queda de prolificidade, a cada ano a população do planeta aumenta cerca de 80 milhões de pessoas, sendo projetados pelas Nações Unidas mais de 9 bilhões em 2050; aproximadamente, 95% desse aumento ocorrerá em países do Terceiro Mundo, onde justamente se concentram os menos desenvolvidos, com deficiências de água e alimento. A população mundial, em 01/01/2010, era estimada em 6.793.593.686 habitantes (USCENSUS, 2010). Em várias regiões do planeta, está aumentando a dificuldade para se conseguir água, em termos quantitativos e qualitativos, para satisfazer a demanda sempre crescente da população; o problema é mais sério na Ásia Ocidental e no Norte da África. Segundo Ozturk et al. (2006), a crise por água é o maior desafio a ser enfrentado pela humanidade; desde o início do século passado, a demanda pelo precioso líquido tem aumentado duas vezes mais que o crescimento da população. Altas temperaturas, resultantes do aquecimento global, e escassez de precipitações pluviais e de águas de superfície têm provocado desertificação à medida que os aquíferos e as águas subterrâneas se tornam mais salinos, como resultado de bombeamento crescente e da incorporação de sais. Em muitas áreas, a salinidade de aquíferos do interior está aumentando, atingindo taxas superiores a 16 g L-1 (20 dS m-1), chegando a 20 g L-1 (25 dS m-1) em zonas costeiras (FIDA, 2004). Aliás, extensas áreas do planeta são, naturalmente, salinas ou têm sido salinizadas por ações antrópicas, geralmente como consequência de práticas equivocadas de irrigação (Pereira et al., 2002). Naturalmente, ocorrem solos salinos ao longo da costa de continentes, em estuários e em áreas salinas internas (‘Great Salt Lakes’ nos Estados Unidos, Mar Morto em Israel, ‘Neusiedlersee’ na Áustria, dentre outros). À ação do homem é atribuída a salinização de áreas em regiões áridas e semi-áridas, manejando, inadequadamente, a água em projetos de irrigação; civilizações antigas desapareceram na Mesopotâmia (Tigris e Eufrates), na China e na América pré-Colombiana; áreas foram salinizadas, posteriormente no Norte da África, no rio Indus - Paquistão, rio Ganges na Índia e no Vale de São Joaquim - Califórnia (Choukr-Allah et al., 1996; Ozturk et al., 2006). A lição desastrosa da salinização parece não ter sido apreendida totalmente pela humanidade, considerando a continuidade de ocorrência do processo nos tempos contemporâneos (Abdelly et al., 2008). Segundo estimativas do Programa das Nações Unidas para o Meio Ambiente, contidas em Jaradat et al. (2004), 20% das terras agricultáveis e 50% das atualmente cultivadas estão afetadas por sais. Um dos problemas mais urgentes da sociedade atual é encontrar suficiente água e terra para dar suporte à necessidade de alimentos do mundo. A FAO (2005) estima em 200 milhões de hectares a área adicional necessária a produção de alimentos, até 2025, para alimentar tanta gente. As terras de boa qualidade, passíveis de serem cultivadas, agricolamente, cerca de 93 milhões de ha, estão hoje cobertas por florestas, sendo difícil visualizar a Biossalinidade e produção agrícola sua devastação para atender à demanda de alimentos. Em contraste, água do mar é abundante, mares e oceanos contêm, aproximadamente, 97% das águas; em muitos locais, por características de solo e clima, as águas superficiais e de poços rasos são, também, salinos. Igualmente, solos salinos ocorrem em todo o globo, 43% das terras do planeta são áridas ou semi-áridas, com cerca de 15% (130 milhões de hectares), em áreas costeiras ou de interior que poderiam ser cultivadas com água do mar para produção de alimentos, preservando-se florestas e destinando-se águas de boa qualidade para fins de uso direto pelas populações (Glenn et al., 1998a, 1998b; Ozturk et al., 2006). Claramente, fica patente a necessidade de serem incorporadas à agricultura terras marginais, como as naturalmente salinas, as encharcadas, as areias de desertos e as áreas costeiras arenosas. Desde o início da década de 60, século passado, muitos cientistas vêm se dedicando a estudos de reabilitação e funcionamento de ecossistemas salinos, com a preocupação constante de monitorar a acumulação de sais e mantê-los produtivos. O conhecimento científico será, absolutamente, essencial ao desenvolvimento de práticas adequadas ao manejo da agricultura biossalina (Mohammad & Scanes, 2004; Shahid & Hasbini, 2007; Toderich et al., 2008a ) . Como agricultura biossalina entende-se o uso de águas salinas, geralmente em solos salinos ou salinizados, para o cultivo de espécies tolerantes ao estresse salino, quando água e solos de boa qualidade se tornam escassos. Na agricultura biossalina tem predominado o uso de halófitas, espécies naturalmente adaptadas a crescer e produzir em condições com alta concentração de sais, tema a ter uma melhor abordagem em outros subitens deste trabalho. Caberá à agricultura biossalina um papel relevante na produção de alimentos de origem vegetal ou animal. Tal necessidade é mais patente quando se constata estar a água doce se tornando escassa; segundo Hendricks & Bushnell (2009) e Khan et al. (2009), os usos doméstico, industrial e agrícola de água fresca estão aumentando tão rapidamente que haverá escassez em todo o mundo. Outro fator agravante foi detectado nas últimas décadas, com a constatação de estarem se tornando progressivamente salinas as águas superficiais e subterrâneas, em muitas áreas agrícolas (Wilt & Oosten, 2000; Miranowski, 2004). 183 Rozema, 1996). Posteriormente, vários pesquisadores constataram não ser verdadeira tal interpretação, ao verificarem que as halófitas não têm exigência por concentrações altas de sais, mas vegetam em uma faixa de concentração salina, específica para cada genótipo, sem causar alterações em sua fisiologia e sem reduzir, significativamente, seu crescimento (Orcutt & Nilsen, 2000; Ashraf et al., 2006). Com a evolução das pesquisas, conhece-se, atualmente, a importância do sódio na fisiologia das halófitas, considerando prevalecer na maioria de suas espécies, o mecanismo de fixação de CO2 do tipo C4, em que o substrato orgânico básico do ciclo inicial de carboxilação é o fosfoenolpiruvato, envolvendo a enzima PEP-carboxilase. Epstein & Bloom (2006) citam ser Na um micronutriente essencial para as plantas C4 e CAM, por estar envolvido, diretamente, na reconstituição do fosfoenolpiruvato. Com esse novo conhecimento, entende-se a importância do sódio para as halófitas, mas na concentração de um micronutriente, o que é muito menor do que o conteúdo do elemento em águas e solos salinos, onde ocorrem. Portanto, não há relação direta entre concentrações altas de sais e sua exigência pelas halófitas, mas o Na deve estar presente em seu habitat/ nicho ecológico. Visando a um melhor entendimento da importância de Na para as halófitas, apresentamos na Figura 1 os ciclos de carboxilação, típicos das plantas C4, com explicações. HALOFITISMO Durante muito tempo, acreditou-se que a ocorrência de halófitas em solos salinos tinha relação com uma possível exigência dessas plantas por concentrações altas de sais, particularmente sódio e cloreto, para seu crescimento e desenvolvimento (Flowers et al., 1986; Figura 1. Ciclos de carboxilação das plantas C4, em que se enquadra a maioria das halófitas, ocorrendo o primeiro nas células do mesófilo e o segundo - Ciclo de Calvin - em células da bainha vascular Pedro D. Fernandes et al. Halofitismo ocorre em cerca de 1/3 das angiospermas (classe mais importante para agricultura biossalina que as gimnospermas) e cerca de 50% dos gêneros tolerantes a sais pertencem a 20 famílias; entre as angiospermas dicotiledôneas, a família Chenopodiaceae abrange a maior parte das halófitas (20% delas), distribuídas, também, em Aizoaceae, Caryophyllaceae, Cruciferae (Brassicaceae), Compositae (Asteraceae), Leguminoseae e Plumbaginaceae (O’Leary & Glenn, 1994; Abdelly et al., 2008). ECOFISIOLOGIA DAS HALÓFITAS Em ecologia, o termo ‘nicho ecológico’ representa a soma das características que determinam a posição e função de uma espécie em um determinado ecossistema; deve-se distinguir ‘nicho ecológico’ de ‘habitat’, sendo este o local onde evolui a espécie, enquanto o ‘nicho’ é a função desempenhada pelos indivíduos da espécie no ecossistema. Entre as características determinantes, estão fatores químicos e físicos, além de sua distribuição espacial e temporal, todos eles requeridos para a ocorrência e sobrevivência da espécie em um determinado habitat, condicionando seu crescimento (Larcher, 2000; Hans-Werner et al., 2008). No habitat das halófitas, determinante para caracterizar o seu nicho ecológico, são encontradas altas concentrações de sais no solo e na água (Flowers et al., 1986; Rozema, 1996; Orcutt & Nilsen, 2000). No Norte da Holanda, por exemplo, o valor médio de concentração de sais para ocorrência de Glaux maritima é de 8880 mg de NaCl L-1 (Rozema, 1978), considerado o ‘ótimo ecológico’ em relação à característica de salinidade do nicho dessa halófita; através de estudos hidropônicos esse autor verificou não ser afetada a acumulação de biomassa daquela espécie, até esse nível de NaCl, significando que 0 – 8880 mg de NaCl L-1 é a faixa de salinidade favorável, fisiologicamente, para ocorrência de Glaux marítima; pelos novos conhecimentos sobre a essencialidade de Na, como micronutriente, para essa classe de plantas, esse elemento deve ter estado presente no meio de estudos para suprir suas necessidades fisiológicas. Entretanto, a interpretação não é tão simples assim, devendo ser, ainda, considerada a competição por espaço com outras espécies. Na Figura 2 está esquematizada a relação entre concentração de sais e crescimento de plantas da espécie Glaux maritima, em que no eixo “y” está representado o incremento de biomassa ou a probabilidade de ocorrer uma determinada espécie numa área, em função da concentração de sais no meio (eixo “x”) (Rozema, 1996); o ‘ótimo ecológico’ corresponde à concentração máxima de sais em que ocorre o máximo de incremento de biomassa da espécie ou, em termos de probabilidade, à concentração de sais no meio a partir da qual é menos provável a sua ocorrência. Sob tais condições de salinidade, dificilmente uma glicófita teria condições de vegetar, o que explica ser considerado ‘ótimo’ para a halófita, por não ter que competir com outras espécies. Incremento de biomassa ou probabilidade de ocorrência de uma espécie 184 Faixa favorável fisiologicamente para espécie Concentração de sais no meio Ótimo ecológico Figura 2. Relações entre incremento de biomassa ou probabilidade de ocorrência de uma espécie (eixo “y”) e aumento da concentração de sais no meio (Fonte: Adaptado de Rozema, 1996) Ecofisiologia da adaptação ao estresse salino São variadas as adaptações das plantas ao meio salino, razão de estudos da ecofisiologia, abrangendo desde mecanismos de ordem fenológica, morfológica e fisiológica, passando, também, por eficiência de uso de água, aspectos bioquímicos, biomoleculares e genéticos (Arzani, 2008). As halófitas desenvolveram mecanismos diversos para se adaptar a ambientes com altas concentrações de sais. Algarie et al. (2007) destacam três adaptações principais: acumulação de osmólitos, controle do fluxo de água no interior da planta e a manutenção da homeostase iônica. Em algumas halófitas, enzimas exercem, também, importante função, fazendo com que sejam menos sensíveis ao estresse salino (Ghosh et al., 2006) Conhecimentos sobre alguns desses itens serão abordados em outros capítulos deste livro. No caso presente, pretende-se tecer considerações sobre tais aspectos, quando diretamente relacionados ao meio de ocorrência de espécies vegetais (ecofisiologia), ou seja, nos casos de uso de água com altas concentrações de sais na agricultura biossalina. Escape, tolerância ou resistência Hans-Werner et al. (2008) usam os termos escape (‘fuga’) e tolerância para aspectos específicos de Biossalinidade e produção agrícola respostas das plantas ao estresse. Como exemplos de escape têm-se os casos de plantas anuais que completam o seu ciclo no curto tempo de condições climáticas favoráveis, evitando as estações mais secas, e os casos de plantas com raízes profundas (Prosopis e Tamarix, por exemplo), capazes de absorver água do subsolo, onde, geralmente, são mais baixos os teores de sais. O termo escape ou ‘fuga’ se aplica, também, aos casos em que o vegetal protege os seus tecidos do efeito do estresse; em algumas halófitas, é o caso de prevenir a entrada de sal nos tecidos da planta, conhecido como exclusão de íons. A resistência é mais abrangente, decorrente da combinação de vários mecanismos de escape e de tolerância. O escape (evitar) contrasta com o termo tolerância, por se relacionar este último à presença do fator antiestressante dentro da planta; no caso de estresse hídrico, ocorre tolerância à dessecação dos tecidos e, no estresse salino, há tolerância à alta concentração de sais nos tecidos das halófitas. Bem conhecido de todos os estudiosos, as plantas variam muito a sua tolerância à salinidade, com diferenças entre espécies, dentro de genótipos de uma mesma espécie e, até mesmo, entre estádios de desenvolvimento de um mesmo genótipo (Tester & Davenport, 2003; Hendricks & Bushnell, 2009). Em outras palavras, a sensibilidade ao estresse salino tem sido identificada como um fenômeno específico a um estádio de desenvolvimento da planta, podendo variar em outros estádios (Orcutt & Nilsen, 2000; Ashraf et al., 2006; Ahmed et al., 2008). Ainda mais, em cada estádio de desenvolvimento, a tolerância à salinidade é controlada por mais de um gene e altamente influenciada por fatores ambientais (Flowers, 2004; Flowers & Flowers, 2005; Munns, 2005; Ozturk et al., 2008). Entre as adaptações ao estresse salino, relacionadas a aspectos de ecofisiologia, já foram identificados vários mecanismos, com destaque para os de natureza morfológica e anatômica, abscisão (descarte) de tecidos e órgãos, ajustamento osmótico e metabólitos orgânicos, suculência e germinação/multiplicação via vegetativa. Adaptações morfológicas e anatômicas As adaptações das halófitas podem variar em natureza, grau ou eficácia, dependendo da espécie e, também, do habitat. Há certo grau de plasticidade no efeito da salinidade sobre as plantas, em diferentes condições ambientais, dependendo da severidade do estresse (Batanouny, 1996; Khan & Weber, 2006) Uma das adaptações de ordem morfológica é a redução de área foliar, quer pela formação de um menor número de folhas, quer pela redução de seu tamanho ou por abscisão foliar (Khan & Weber, 2006; Taiz & Zeiger, 185 2008). Algumas halófitas descartam as folhas mais velhas quando estão repletas de sais; o excesso de sais vai sendo acumulado nas folhas mais velhas, ao mesmo tempo em que contribui para tornar mais negativo o potencial osmótico das células e consequente aumento na retenção de água nos tecidos; enquanto compartimentaliza os sais nas folhas mais velhas, novas folhas são formadas sem problemas de aumento na concentração de sais e suprem a planta de fotoassimilados, por sua atividade fotossintética maior, até passarem a servir de estoque de sais, quando novas folhas passam a desempenhar aquela importante função (Gorham, 1996; Yensen, 2006). A acumulação de sódio nas folhas mais velhas é uma consequência, também, da saída de potássio dos seus tecidos (agindo como fonte), translocando-se para as folhas novas em formação (dreno). Glândulas de sal - Em diversas espécies, a adaptação consiste na formação de glândulas de sal nas folhas, através das quais excretam sais, uma forma de controlar o seu excesso no interior das células. As glândulas são formações frouxas de células, com espaço intercelular mais aberto do que geralmente ocorre nos outros tecidos (Mohr & Schopfer, 1995); a solução flui para o espaço entre as células e daí para uma abertura na cutícula, onde se evapora a água, cristalizando-se os sais na superfície da folha, sendo lavados pelas chuvas ou pela irrigação. A estrutura da glândula de sal é similar dentro de uma mesma espécie e, com raras exceções, também nas espécies de uma mesma família, mas com variações entre famílias. O tipo mais simples é encontrado nas Poáceas (gramíneas) e os mais complexos - glândulas multicelulares - foram identificados nos gêneros Limonium, Limoniastrum e Distichlis (Figura 3) e na espécie Cressa cetica. O número e localização das glândulas de sal também variam: em Limoniastrum monopetalum, Batanouny & Sitta (1979) encontraram 1955 glândulas por cm2 na face adaxial e 2315 cm-2 na abaxial das folhas; na espécie Limonium delicatulum os autores Batanouny et al. (1992) registraram 2022 e 2930, respectivamente. A secreção de sais contribui para a adaptação da planta à salinidade de forma quantitativa e qualitativa; quantitativamente, quando o status de sal na folha alcança um limite máximo tolerável, sendo a excreção de sais fundamental para a sobrevivência da planta; qualitativamente, por contribuir para o balanço iônico das folhas, quando fica alterada a relação entre íons essenciais e tóxicos, secretando o que estiver em excesso (Hans-Werner et al., 2008). A taxa de secreção de sais é afetada por inúmeros fatores, com destaques para concentração e natureza de 186 Pedro D. Fernandes et al. Figura 3. Extrusão de sais de glândulas de sal, localizadas no caule de Distichlis palmieri. Fonte: MBARI (2005) íons no meio, luz, temperatura, balanço hídrico na planta, umidade relativa e presença de metabólitos inibidores, dentre outros. A eficácia da excreção através de glândulas depende de condições que impeçam a sua reabsorção pela cutícula. Na Tabela 1 consta uma relação de espécies em que é comum a excreção de sais através de glândulas salinas nas folhas. Pelos vesiculares - Além de glândulas, os sais podem ser acumulados em formações especiais, tipo tricomas, que se desenvolvem na epiderme de caules e folhas, denominadas de células vesiculares ou pelos vesiculares, comuns em alguns gêneros de Chenopodiaceae, especialmente em espécies de Atriplex (Mohr & Schopfer, 1995; Hans-Werner et al., 2008; Ahmed et al., 2008) e espécies de Salsola, Chenopodium, Obione, Halimione e em Mesembryanthemum crystallinum (Figura 4) (Luttge et al., 1978; MBARI, 2005; Agrarie et al., 2007). As vesículas se caracterizam por um grande vacúolo central, em que podem se acumular componentes inorgânicos (sódio, cloreto) e orgânicos, como flavonoides e betacianinas (Steudle et al., 1977; Vogt et al., 1999); açúcares compatíveis com álcoois, pinitol e seus precursores inositol e ononitol (Bohnert et al., 1995; Nelson et al., 1998). As vesículas, além de participarem na regulação do sequestro de íons e regulação das relações hídricas nas células, atuam, também, no controle dos níveis de malato em células do mesófilo de plantas CAM (Rygol et al., 1989; Agarie et al., 2007). As vesículas podem se romper ou se destacar das folhas, reduzindo o conteúdo salino da planta. Comparadas com as glândulas salinas, as células vesiculares têm uma ação comparativamente menor, mas são particularmente efetivas em proteger folhas jovens, em expansão. A descarga de sais em vacúolos de células vesiculares pode, efetivamente, reduzir o fluxo de sais para tecidos fotossintetizantes ativos, em plantas se desenvolvendo em meio de alta salinidade. Batanouny (1996) se refere Tabela 1. Plantas que excretam sais através de glândulas salinas encontradas em folhas Fonte: Gorham (1996) Biossalinidade e produção agrícola A B Figura 4. Planta florida de Mesembryanthemum crystallinum (A) com pelos vesiculares no caule (B). Fonte: MBARI (2005) à concentração de sais 60 vezes superior em pelos vesiculares de Helimione portulacoides, em relação às células do mesófilo circundante; conforme o autor, uma poderosa bomba de sais deve operar entre as células vesiculares e as do mesófilo, para garantir a alta diferença de gradiente entre ambos os tecidos. Suberização de cutículas e formação de cera - Outro fator que limita a entrada de sais com o fluxo da transpiração é a prevenção à perda de água, através da suberização de cutículas e da formação de cera na superfície foliar, comuns em halófitas (Flowers et al., 1986; Yensen, 2006), isto é, reduzindo-se a transpiração, menos sais entrarão pelas raízes. Tais formações têm importante função, também, em prevenir a reabsorção de sais de glândulas salinas ou de vesículas. Abscisão de órgãos e tecidos – A abscisão (descarte) de órgãos e tecidos é, também, um dos importantes mecanismos de adaptação das plantas ao meio salino, fato 187 comum em Juncus spp e em folhas suculentas de Suaeda spp. As folhas, quando estão lotadas com íons indesejáveis, são descartadas (‘shedding’), contribuindo, também, para a redução da área foliar, resultando em menor perda de água através da transpiração, importante nas estações de déficit hídrico (Yensen, 2006). Além do descarte de folhas, em Atriplex podem ocorrer seca de ramos e do córtex do caule que, após morte das células, se desprendem da planta (Batanouny, 1996); em ambos os casos, os tecidos são carregados de íons, contribuindo para o seu descarte, diminuindo a concentração de sais no vegetal. Suculência – A exposição das espécies halófitas ao ambiente salino resulta em numerosas mudanças estruturais nas plantas, destacando-se, dentre elas, a suculência, caracterizando-se por: maior espessura das folhas, células maiores, especialmente as do parênquima esponjoso, menor espaço intercelular, maior elasticidade da parede celular, desenvolvimento de tecidos estocadores de água, menor relação entre superfície/ volume, baixo conteúdo de clorofila e menor número e menores estômatos por unidade de área (Batanouny, 1993; Ahmed et al., 2008; Hans-Werner et al., 2008). Suculência tem o efeito de diluição dos íons dentro das células, o que possibilita que as halófitas convivam com altas concentrações de sais em parte de seus tecidos. Dois tipos de suculência têm sido distinguidos em halófitas: suculência mesomórfica e suculência xeromórfica. Na mesomórfica, típico das hidrohalófitas, todas as células das folhas, inclusive as da epiderme, são suculentas e é baixo o número de estômatos por unidade de área; as plantas do tipo xeromórfico, usualmente, vegetam em condições de alto estresse hídrico e são caracterizadas por terem mesófilo com células grandes e suculentas, grande número de estômatos e um sistema vascular altamente lignificado (Batanouny, 1993). A seiva orgânica das suculentas xeromórficas, geralmente, contém mais ácidos orgânicos que a seiva das mesomórficas, em que predominam íons inorgânicos. O cloreto de sódio tem sido considerado o sal mais eficiente em promover suculência. Decréscimo em suculência, associado ao aumento de características xeromórficas, foram observados em plantas expostas a sulfato de sódio. Chapman (1974) cita haver uma relação entre concentração de Cl -, SO42- e o grau de suculência, em halófitas suculentas típicas, com prevalência mais favorável do cloreto. Germinação - Propagação via vegetativa As sementes das halófitas sobrevivem em solos altamente salinos (Rozema, 1996; Atia et al., 2006), mas só germinam em condições de maior diluição dos sais, 188 Pedro D. Fernandes et al. em épocas coincidentes com precipitações pluviais; fatores diversos, como vento e animais, dentre outros, podem dispersá-las em áreas diversas, propiciando a germinação das que forem depositadas em solo com menor concentração de sais. As fases de germinação e de crescimento das plântulas, em geral, são as mais sensíveis ao estresse salino (Tester & Davenport, 2003; Atia et al., 2006; Liu et al., 2006). Estabelecidas, após condições favoráveis para germinar, as halófitas são favorecidas por baixa competição com outras espécies, devido aos fatores do ambiente em que poucos genótipos sobrevivem; caso não fosse salino o meio, as halófitas não teriam como competir com glicófitas, na fase inicial de estabelecimento. Esta interpretação é útil para se compreender melhor o conceito ‘ótimo ecológico’, abordado nas relações entre incremento de biomassa e aumento de concentração de sais no meio, apresentado na Figura 2. Fato comum a muitas espécies não domesticadas, nas halófitas a germinação das sementes se distribui no tempo, em um mesmo habitat, e é afetada pelo conteúdo de cloreto na casca que as envolve, bem como pelo seu grau de polimorfismo. Muitas espécies de Atriplex contam com unidades de dispersão polimórficas; como exemplo, Atriplex hortensis tem quatro tipos de flores, cada uma resultando em frutos de cores e formas diferentes; as sementes de Atriplex dimorphostegia diferem em tamanho e variam na germinação (Liu et al., 2006; Ahmed et al., 2008). Digno de atenção, também, são os resultados divulgados por Batanouny (1993), sobre a importância da origem das sementes para a germinação de Limonium pruinosum, Alhagi maurorum, Prosopis farcta e Phragmites australis; nessas espécies, taxas mais altas de germinação foram obtidas quando as sementes eram provenientes de plantas sob condições de halofitismo (desenvolvendo-se em altas concentrações de sais), em comparação com a germinação obtida de sementes originadas das mesmas espécies, produzidas em plantas vegetando sem estresse salino; contudo, o autor cita que tal conhecimento não é válido para todas as espécies vegetais. Em mangues, as condições não são favoráveis à germinação de sementes, desenvolvendo algumas espécies mecanismos especiais de propagação. Foi constatado em espécies de Rhizofora, Bruguiera e Avicennia o fenômeno de viviparidade, isto é, a semente germina ainda na planta e o seedling, enquanto ainda está ligado à planta mãe, desenvolve um longo hipocótilo, garantindo-lhe a ancoragem no solo, para depois se desprender da planta (Batanouny, 1996). Em relação à propagação vegetativa, esta é a principal via de multiplicação de muitas halófitas, especialmente, Limonium vulgare, Limonium humile e Tamarix aphylla; uma característica vantajosa é a formação de raízes adventícias, fundamental para a formação dos novos indivíduos (Hans-Werner et al., 2008). Nas espécies de halófitas, Aeluropus littoralis, Prosopis farcta e Tamarix aphylla, a multiplicação vegetativa é de grande importância, por se desenvolverem rebentos (‘runners’), ligados à planta mãe, formando raízes à medida que vão se afastando do ponto inicial de sua emissão; essas raízes são dependentes da planta mãe, na absorção de água e de íons, até atingirem uma camada do solo com menor concentração de sais, onde se tornam independentes, originando novas plantas (Pollak & Waisel, 1972); isso ajuda as novas plantas, formadas via vegetativa, a aprofundar suas raízes, atravessando os horizontes de concentração mais alta de sais, enquanto estão dependentes da planta matriz. Toda essa gama de variações é importante, ecologicamente, para a adaptação das espécies à salinidade. Absorção, transporte e acumulação de íons Metabólitos orgânicos e ajustamento osmótico Embora seja motivo de controvérsias, o efeito maior da salinidade sobre o crescimento vegetal deve-se mais à toxicidade dos sais acumulados nas células que ao efeito osmótico. Há, contudo, diferenças consideráveis entre espécies, entre genótipos de uma mesma espécie, bem como, entre estádios de desenvolvimento e, também, entre órgãos e células de uma mesma planta, quanto aos níveis de concentração interna de sais capazes de causar toxidez (Hans-Werner et al., 2008; Hendricks & Bushnell, 2009). Outra questão é sobre qual o mais tóxico, se sódio ou cloreto, quando em excesso; em glicófitas, as evidências são para o sódio, principalmente em trigo, segundo resultados obtidos por Kingsbury & Epstein (1986); em halófitas, o crescimento das suculentas pode ser inibido pelo excesso de potássio na ausência de sódio e a maioria das halófitas tolerantes à salinidade acumula altas concentrações de sódio e cloreto em seus tecidos (Fricke & Peters, 2002; Ahmed et al., 2008). Vários autores citam que regular a absorção de sais é uma das características mais importantes para a tolerância à salinidade das plantas (Tester & Davenport, 2003, Abdelly et al., 2006; Izzo et al., 2008). Os sais chegando à parte aérea, através do fluxo de seiva inorgânica, não são distribuídos uniformemente entre as folhas e não seguem, obrigatoriamente, o fluxo Biossalinidade e produção agrícola da transpiração (Izzo et al., 2008). Um dos mecanismos de tolerância à salinidade consiste na redistribuição dos sais, em toda a planta, de modo a evitar a sua concentração em folhas novas e naquelas com altas taxas de fotossíntese e, também, nos frutos em início de formação (Khan et al., 2000; Zhang & Blumwald, 2001). Para melhor entendimento desse processo, foi fundamental a evolução do conhecimento, quando se observou haver fluxo de íons entre xilema e floema (Taiz & Zeiger, 2008). Em folhas de Puccinellia peisonis foi constatada a formação de um tipo de endoderme, com suberização de células, acumulando-se o sódio em vacúolos da bainha vascular, sem chegar, portanto, às células do mesófilo (Gorham, 1996; Blumwald et al., 2000). A acumulação de sais em vacúolos é, particularmente, evidente em dicotiledôneas halófitas do gênero Salicornia e Suaeda, plantas com folhas suculentas, compostas por células grandes, nas quais o vacúolo ocupa a maior parte de seu volume. Nessas plantas, a concentração de sódio nas folhas (mais particularmente nos vacúolos) pode exceder 1.000 mol m-3, enquanto a concentração de potássio fica em torno de 40 mol m-3. Tal comportamento raramente é visto em gramíneas e outras monocotiledôneas que tenham células menores e mais rígidas (menos expansíveis), com exceção de Triglochin maritimum (NRCS/USDA, 2005). Aliás, como já abordado em um dos parágrafos anteriores, a suculência é um dos mecanismos de adaptação ao estresse salino, uma forma de diluir os sais no citossol; o volume da célula aumenta, diminuindo a concentração dos íons no protoplasto (Larcher, 2000; Hans-Werner et al., 2008). Espécies das famílias Chenopodiaceae e Mesembryanthemaceae ajustam o potencial osmótico das raízes por grande acumulação de íons sódio e cloreto, compartimentalizados em vacúolos (Albert & Popp, 1977; Agrarie et al., 2007). Em outras espécies, o ajustamento osmótico ocorre através da síntese de compostos orgânicos de baixo peso molecular, denominados de solutos compatíveis (Hasegawa et al., 2000; Hans-Werner et al., 2008; Izzo et al., 2008). Em geral, plantas crescendo sob condições de salinidade mantêm altas concentrações de substâncias osmoticamente ativas nas células, uma forma de garantir a absorção de água do meio em que vegetam, no qual é muito negativo o potencial hídrico da solução do solo, decorrente do componente osmótico; o ajustamento se dá por metabólitos, com destaque para ácidos orgânicos e açúcares, além de íons, principalmente Na + e Cl – , conforme Hasegawa et al. (2000), Hans-Werner et al. (2008). 189 Foi elemento chave, para se entender a tolerância das plantas superiores à salinidade, a descoberta de serem muitas enzimas inibidas por altas concentrações de sais (Greenway & Osmond, 1972; Blumwald et al., 2000; Ashraf & Foolad, 2007). Em halófitas, as enzimas citoplasmáticas são protegidas de concentrações salinas altas, através do sequestro do excesso de sais no vacúolo, livrando organelas vitais do protoplasma desse contato direto (Munns et al., 2002). A pressão osmótica (e o volume) do citoplasma é garantida pela acumulação de metabólitos, compatíveis com as atividades enzimáticas (osmólitos compatíveis); citam-se, dentre eles, os carboidratos (trealose, frutose, sacarose, frutanos), polióis (glicerol pinitol, sorbitol, manitol, ornitol), compostos de amônio quaternários ou derivados de aminoácidos (prolina, glicina, glicina-betaína) e o potássio (K+) (Hasegawa et al., 2000; Arzani, 2008); o tipo de soluto produzido depende do genótipo, mas em geral, uma espécie produz no máximo dois ou três deles. Segundo Ashraf & Harris (2004), as vias enzimáticas adotadas pela planta para adaptação ao estresse podem ser mais importantes que a acumulação do metabólito, em si. Com relação à prolina, no início foi considerada um importante metabólito para o processo de ajustamento osmótico, especialmente nas plantas que não acumulavam íons inorgânicos. Com a evolução das pesquisas, ficou constatado, entretanto, que a quantidade de prolina acumulada não poderia ser considerada como um bom fator para diagnóstico de tolerância à salinidade, em todos os grupos de plantas; além do fator genético, a quantidade de prolina varia durante o dia, por sua estreita relação com as condições hídricas dos órgãos transpirantes (Khan & Weber, 2006; Yensen, 2006; HansWerner et al., 2008). Por exemplo, Batanouny et al. (1985) encontraram valores de prolina, em Sporobolus virginicus, variando de 20 μ moles g-1 às 6 horas da manhã a 45,2 μ moles g-1 às 17 h. Em alguns genótipos, a concentração dos solutos no citoplasma é muito superior à real necessidade da célula, uma clara evidencia de protegerem as enzimas dos efeitos das altas concentrações de sais (Hans-Werner et al., 2008; Taiz & Zeiger, 2008). Segundo Munns (2005), quando presentes em concentrações ligeiramente superiores às necessidades da célula, os metabólitos têm função protetora e quando em concentrações muito altas, a função é de osmorregulação. Segundo Tester & Davenport (2003) e Mansour & Salama (2004), na produção de solutos orgânicos, para se adaptarem ao estresse salino, as plantas gastam energia, com consequências na redução da fitomassa produzida e esse dispêndio energético é maior que o do ajustamento 190 Pedro D. Fernandes et al. osmótico, através da compartimentalizaçao de íons; na produção dos solutos, grande proporção do carbono assimilado é desviada, representando cerca de 10% do peso total da planta, segundo Hans-Werner et al. (2008) e Ashraf & Foolad (2008). Outro fator fisiológico, a considerar na tolerância de uma planta ao estresse salino, refere-se à velocidade com que os sais que chegam às folhas são incorporados às células, uma vez que as enzimas de genótipos tolerantes ao estresse salino têm a mesma sensibilidade à presença de sais que as de espécies glicófitas; caso haja demora na incorporação, os sais ficarão durante um tempo mais longo no apoplasto (parede celular e espaços intercelulares), com sérios problemas osmóticos ao tecido foliar, resultando em plasmólise das células (Muhling & Lauchli, 2002; Fricke & Peters, 2002; Izzo et al., 2008). Na célula, por sua vez, a concentração de sais no citossol não poderá ultrapassar 100 mM, sob pena de injúrias a diversas organelas, desnaturação de proteínas e de serem inibidas muitas enzimas (Munns, 2002); o caminho é a compartimentalização dos sais em vacúolos ou sua extrusão através de glândulas ou vesículas celulares (Figuras 3 e 4). A compartimentalização de íons nos vacúolos deve ser considerada, também, como um mecanismo de acumulação de sais em partes da planta, como súber do caule e partes mais externas de frutos (evitando prejuízos ao embrião). Em frutos de coqueiro irrigado com águas salinas de até 15 dS m–1, Ferreira Neto et al. (2002; 2007b) encontraram maior concentração de Na em cascas do coco que no endosperma líquido. Pode ocorrer, também, exclusão de íons diretamente de tecidos da planta, através de substâncias voláteis, principalmente na forma de clorometano, bromometano ou iodometano (Wuosmaa & Hager, 1990). Eficiência de uso da água e fotossíntese Vale tecer considerações sobre ‘eficiência de uso da água’, considerando-se a relação entre a quantidade de água transpirada e a quantidade de CO 2 fixada na fotossíntese, resultando em aumento da fitomassa. Como o fluxo de sais para a parte aérea é função da taxa transpiratória, um aumento na eficiência de uso da água pode retardar a acumulação de sais nas folhas, segundo Gorham (1996), já detectado em algumas espécies da família Mesembryanthemaceae; a fixação do CO2 por essas plantas à noite, favorece uma maior eficiência de uso da água, decorrente de queda na taxa transpiratória. Da mesma forma, o metabolismo de plantas C 4 se reflete em menor transpiração e menor bombeamento de sais para o interior das folhas, por sua própria natureza de maior eficiência de uso da água (Mohr & Schopfer, 1995; Mahmoudi, et al., 2008; Taiz & Zeiger, 2008). O metabolismo de fixação do CO2 na fotossíntese de plantas tolerantes a sais é variável, com predominância do ciclo comum às plantas C4, sendo exemplo típico as espécies de Atriplex. Entretanto, têm sido observadas, em plantas tolerantes a sais da família Mesembryanthemaceae, alterações no metabolismo do CO 2 , variando de C3 ao metabolismo ácido das crassuláceas (CAM), uma adaptação fotossintética dependendo das condições do meio (Flowers et al., 1986; Ungar, 1991; Winter & Holtum, 2005). A salinidade diminui a fixação de CO2, por afetar a abertura dos estômatos e a eficiência do aparato fotossintético (Hans-Werner et al., 2008; Taiz & Zeiger, 2008), decorrente da quebra da homeostase hídrica e iônica, em nível celular e em toda a planta (Zhu, 2001; Izzo et al., 2008); como consequência, reduz-se a expansão celular e a área foliar disponível para a fotossíntese. Nas halófitas, mecanismos de proteção são desenvolvidos pelas plantas, para contornar tais problemas. Agarie et al. (2007), por exemplo, estudando a importância da formação de pelos (tricomas) na epiderme de Mesembryanthemum crystallinum, verificaram que os mesmos contribuem para a suculência das plantas, como reservatórios de água, e para a tolerância à salinidade, pelo sequestro de íons e manutenção de homeostase nos tecidos fotossinteticamente ativos. Outros fatores considerados na ecofisiologia das halófitas Em seu nicho, as halófitas enfrentam, além do estresse salino, outros fatores decorrentes das características do habitat: hipoxia, associada à toxicidade de sulfetos e desarranjos nutricionais; períodos de inundação e de deposição de solos ou areia; períodos de estresse hídrico, dentre outros (Khan & Weber, 2006). Entre as mais promissoras halófitas estão árvores e arbustos tropicais, coletivamente denominados de mangroves (plantas de mangues), algumas das quais sobrevivem, diariamente, a flutuações de alguns metros do nível da água do mar; no outro extremo, plantas das várias espécies de Atriplex sobrevivem em áreas desérticas à alta salinidade e a secas prolongadas (Glenn, 1998a, 1998b). Em zonas áridas e semi-áridas, o estresse salino é agravado pela falta de água, na maior parte do ano; quando ocorrem chuvas, os níveis de salinidade variarão diária, mensal ou sazonalmente, dependendo da quantidade e frequência das precipitações. Como consequência, a salinidade raramente é uniforme em um terreno, variando no perfil do solo, geralmente com Biossalinidade e produção agrícola valores mais altos de CE nas camadas superiores, devido à evaporação da água (Levy et al., 2003). A salinidade varia, também, espacialmente, podendo ocorrer em uma área, circundando solos com valores de CE relativamente baixos (Souza et al., 2008; Shahid et al., 2009). SALINIDADE X PRODUÇÃO A pressão por água de boa qualidade vem forçando o uso das consideradas marginais, requerendo o desenvolvimento de tecnologias, visando à dessedentação de pessoas e de animais e produção de alimentos, condições indispensáveis à garantia de vida. Para alimentar a população mundial que cresce a cada segundo, deverão ser desenvolvidas tecnologias que garantam a produção sustentável de alimentos de origem vegetal e animal. Os cientistas terão a missão de explorar os recursos naturais, garantindo a sustentabilidade, sem agredir o meio ambiente, e deverão incorporar ao processo produtivo as áreas naturalmente salinas e as salinizadas pelo homem, ao longo da história. A possibilidade de utilização de águas de qualidade marginal liberará água doce para beber e a identificação e obtenção de genótipos tolerantes a sais abrirão perspectivas para produção de alimentos, para consumo direto da população e para alimentação animal, gerando proteínas para uso humano, além da produção de outros bens de origem vegetal. A utilização de água salina para produção de alimentos requererá estudos de novos ‘designs’ e de manejos mais apropriados de sistemas de irrigação. No tocante a plantas, há uma divisão entre as que toleram a salinidade do solo e da água, denominadas de halófitas, e as que são sensíveis ao estresse salino, as glicófitas (Taiz & Zeiger, 2008), já mencionadas em itens anteriores. Com base em abordagens contidas na literatura especializada (Rozema, 1996; Yensen, 2006; Hamed et al., 2008; Hans-Werner et. al., 2008), dividimos as halófitas em dois grupos: (i) espécies halófitas de origem, as que evoluíram sob condições permanentes de alta salinidade, e (ii) halófitas facultativas, abrangendo espécies evoluídas em ambientes sujeitos a variações na concentração de sais, durante parte das estações de crescimento/desenvolvimento. Em função da salinidade da água, podem ser distinguidos quatro níveis de agricultura salina (ULPGC, 2005): a - agricultura em baixa salinidade (concentração de sais < 1,5 g L-1); b - agricultura em média salinidade (1,5 a 15 g L-1); c - agricultura em salinidade alta (15 a 25 g L-1); d - agricultura com uso de água do mar (> 25 g L-1). 191 É importantíssimo o estabelecimento inicial da planta, coincidindo com período de chuvas, por serem, em geral, críticas as fases de germinação e início de formação do sistema radicular; se a planta sobrevive na fase inicial, aumentam as chances de sobrevivência nas estações seguintes (Tester & Davenport, 2003; Atia et al., 2006; Liu et al., 2006). Além do efeito favorável de chuvas, lixiviando sais, outras práticas, altamente recomendáveis na agricultura salina, são: cobertura morta para conservar a umidade e diminuir a evaporação; semeio e plantio em camalhões; irrigações com lâminas pequenas, mas frequentes; rotação de culturas, explorando as diferenças nutricionais entre genótipos. Drenagem e lixiviação são as principais providências para manter a produtividade do solo em agricultura salina irrigada. Mesmo nos níveis de salinidade mais alta, objetiva-se obter um benefício mínimo que compense o balanço de energia e os custos e cuja atividade tenha sustentabilidade, sem causar impactos adicionais ao meio ambiente. Como benefícios, podem ser consideradas utilidades as mais diversas, a começar por produção de alimentos, forragens, óleos, ceras, bioprodutos para a farmacologia e uso industrial, flores (inclusive secas) e folhagens ornamentais, bioenergia e paisagismo, além de recuperação de áreas degradadas e sequestro de carbono. Espécies para a agricultura salina É limitado o conhecimento desenvolvido em agricultura salina. Um paradoxo, pois a literatura sobre halófitas é extensiva, mas a utilização desse conhecimento é mínima. Um exemplo disso está no fato de os programas de desenvolvimento da agricultura convencional terem, em geral, como foco o uso de boa terra, culturas especializadas glicófitas e manejo de irrigação com água de boa qualidade, sem incluir o uso de halófitas sob condições salinas. São muitas as espécies adaptadas à salinidade, com graus variados de tolerância, dependendo dos habitats e nichos em que evoluíram. Na Tabela 2 constam informações sobre tolerância à salinidade, registradas em trabalhos conduzidos pelo NIAB (Nuclear Institute for Agriculture and Biology) do Paquistão. Antes, porém, destacamos alguns genótipos, com maiores potencialidades econômicas, indicados por autores diversos: Atriplex spp (erva sal – há 36 espécies de Atriplex – Huxley, 1992) Distichlis palmeri (capim sal), Salicornia spp (‘glasswort’), Suaeda spp (‘sea blithe’) e Batis spp (DaSilva, 2002; Yensen, 2006; Khan & Weber, 2006); Suaeda fruticosa (Khan et al., 2000); Kochia scoparia (Kafi & Jami-Al-Ahmad, 2008); Batis 192 Pedro D. Fernandes et al. marítima e Crithmum maritimum (Hamed et al., 2008); Atriplex lentiformis (Al-Attar, 2002); Atriplex nummularia (Glenn et al., 1998b); Atriplex halimus (Ahmed et al., 2008); Kosteletzia virginica (Ruan, 2008); Panicum turgidum (Khan et al., 2009); Distichlis palmieri, Distichlis spicata, Sporobulus virginicus e Sporobulus airoides (Huxley, 1992; Al-Attar, 2002); Cakile marítima (Debez et al., 2006); Salicornia bigelovi (Al-Attar, 2002). Tabela 2. Tolerância de diferentes genótipos à salinidade, com os níveis de CEes (Condutividade elétrica do extrato de saturação) em que há redução de 50% de produção da matéria verde, em trabalhos conduzidos no Paquistão. muito utilizada em estudos de fisiologia vegetal e é uma das indicadas para trabalhos de recuperação de áreas salinizadas (Kholodova et al., 2002). Uma curiosidade é haver genótipo de arroz, classificado como halófita; Dastidar et al. (2006), por exemplo, identificaram uma espécie de arroz selvagem, classificada como Porteresia coarctata (Roxb.) Tateoka, espécie halofítica, isolando e caracterizando, por meio de estudos bioquímicos, aminoácidos relacionados à tolerância ao estresse salino. Como complemento, estão listadas na Tabela 3 informações sobre a tolerância à salinidade, ao encharcamento e à seca de diversas espécies de diferentes portes (arbóreas, arbustivas e gramíneas), muito úteis para as atividades relacionadas à agricultura biossalina. Em síntese, são muitos os exemplos de cultivos apropriados para condições de salinidade, a depender do nível de concentração de sais. Considerando-se glicófitas, quando a concentração de sais na água de irrigação está abaixo de 15 g L -1 , as espécies recomendadas são: arroz, fava (Vicia faba) trigo, aveia, sorgo, colza, cana, espinafre, beterraba açucareira (Beta vulgaris ssp vulgaris), figo, uva e algodão; para níveis mais altos de salinidade, podem ser cultivadas tamareira, coco, capins, cereja selvagem, sena, beterraba de praia (Beta vulgaris ssp maritima). Plantas diversas de mangues e halófitas em geral, são capazes de suportar condições hostis, principalmente quando a única fonte de água é de má qualidade (Ashraf et al., 2006; Daoud et al., 2008). CULTIVOS BIOSSALINOS Fonte: Adaptação de Ahmad (1988) Vale ser ressaltado que tais potencialidades apenas são indicativos de terem sido mais estudadas as espécies. Tomando Mesembryanthemum crystallinum (Figura 4), como exemplo de planta pouco citada entre as de maior potencialidade, destacamos, a seguir, algumas de suas utilidades, uma evidência de haver, ainda, muito a ser pesquisado e difundido sobre as halófitas. Utilidades de M.crystallinum: folhas e sementes são comestíveis; podem ser utilizadas as folhas para preparar sopa, inclusive com propriedades medicinais; esta espécie é Em todos os casos de uso de águas salinas na agricultura, devem-se manejar, adequadamente, solo, água e plantas, visando a controlar e minimizar a acumulação de sais e/ou de sódio na superfície do solo e na zona radicular das plantas; algumas técnicas e práticas já foram desenvolvidas e são, hoje, consagradas para esse fim. Objetiva-se com tais práticas: reduzir e controlar a concentração excessiva de sais na zona radicular; reduzir problemas de formação de crosta, impermeabilização ou desestruturação em solos sódicos; promover condições para o desenvolvimento desejável de plantas e utilizar o excesso de água, quando existente na zona radicular, geralmente salina. Os cuidados se aplicam em todos os casos onde a concentração ou toxicidade de sais limita o crescimento das plantas cultivadas ou quando o excesso de Na pode criar crosta e problemas de permeabilidade. O conhecimento sobre tais temas será objeto de outros capítulos deste livro, Biossalinidade e produção agrícola 193 Tabela 3. Tolerância à salinidade e sodicidade, ao encharcamento e à seca de diferentes espécies arbóreas, arbustivas e gramíneas Fonte: Ahmad (1988) com ênfase para manejo de irrigação, drenagem, biodrenagem, recuperação de solos salinos, sódicos e salinos sódicos, dentre outros, razão por que nos ateremos, diretamente, ao manejo da agricultura biossalina. Segundo Wilt & Oosten (2000), com o cultivo de halófitas em sistemas irrigados com águas marginais, é possível se ter benefícios os mais diversos, já comprovados, destacando-se, dentre eles: alimento para 194 Pedro D. Fernandes et al. consumo humano e animal; óleo comestível de excelente qualidade; produtos de química fina; obtenção de biomassa a baixo custo para produção de energia renovável; biofiltração de efluentes urbanos, efluentes de criação de peixes/camarões e de indústrias; produtos bioativos; materiais de construção; produção de papel; recuperação de áreas degradadas, com benefícios ecológicos importantes; proteção e desenvolvimento de áreas costeiras; estabilização de solos e de dunas; melhoria do clima; drenagem de terrenos alagados e salinos; quebra-ventos; enriquecimento paisagístico; recreação e campos de golf; sequestro de CO2 – todos de máxima importância no contexto internacional. Vale ser destacado, ainda, o benefício de contribuir para a contenção do processo de desertificação, possibilidade de converter desertos localizados na orla marítima em áreas produtivas, mudando a paisagem, com grande significado ambiental, ecológico e social. Tomando, como exemplo, espécies de Salicornia, capazes de crescer e produzir em condições de alta salinidade, muitas utilidades já foram identificadas, com destaque para o uso de brotos em saladas; as sementes são fonte de proteína e de óleo comestível fino e de boa qualidade para consumo humano; ramos e folhas são fontes de forragens para animais e a madeira tem, também, utilidades diversas (Abdelly et al., 2006; Toderich et al., 2008b). São muitos os exemplos de sucesso no cultivo de halófitas. Fazendas de Salicornia e de Atriplex foram implantadas no Egito, México, Paquistão, Emirados Árabes, na Índia e na Arábia Saudita (Glenn et al., 1998b). Segundo DaSilva (2002), na China são cultivados 300 mil hectares de terras costeiras com halófitas, nas províncias de Hainan, Hebei, Guandog e Shandong; aquele autor relaciona, ainda, os seguintes casos: no Egito halófitas são cultivadas para alimentação animal e como elemento paisagístico; em Marrocos, há cultivo de halófitas como plantas ornamentais; na Tunísia e na Arábia Saudita, em gramados de golfe, irrigados com água do mar; no Chile, também com água do mar é cultivada a leguminosa Tamarugo (Prosopis tamarugo) no deserto de Atacama (Habit et al., 1981; Asatudillo et al., 2000). Algumas espécies têm sido utilizadas em trabalhos agroflorestais, em solos com altos teores de sais e/ou de sódio, com destaques para Prosopis juliflora, Acacia nilotica, Tamarix articulata e Casuarina equisetifolia (Islam, 2009); algumas dessas espécies voltarão a ser mencionadas no capítulo sobre biodrenagem, pela importância de seu cultivo em solos encharcados ou com lençol freático próximo à superfície. Uma glicófita que se destaca é a cevada (Hordeum vulgare L.), tolerante à salinidade, com genótipos que germinam com uso da água do mar, cerca de 47 dS m-1 (Mano & Takeda, 1997) e com níveis satisfatórios de produtividade a 20 dS m-1, com redução de apenas 7,9%, em relação ao tratamento testemunha (Jaradat et al., 2004). Segundo Maas (1990), os maiores valores de salinidade limiar em glicófitas foram observados em: centeio (Secale cereale: 11,4 dS m-1); guar (Cyamopsis tetragonoloba: 8,8 dS m-1); trigo (Triticum aestivum: 8,6 dS m-1); cevada (Hordeum vulgare: 8,0 dS m-1); algodão (Gossypium hirsutum: 7,7 dS m -1); beterraba (Beta vulgaris: 7,0 dS m-1). Coqueiro (Cocos nucifera) é outra glicófita tolerante à salinidade. Em trabalhos conduzidos em casa-devegetação e em condições de campo, pesquisadores da Unidade Acadêmica de Engenharia Agrícola/CTRN/ UFCG estudaram os efeitos da aplicação de água salina em várias fases fenológicas da cultura de coco ‘Anão Verde’. Nas fases de germinação e crescimento inicial de plântulas, foram testados cinco níveis de salinidade da água de irrigação (CEa = 2,2, 5, 10, 15 e 20 dS m-1), até 120 dias após semeadura; as águas salinas foram preparadas com adição de NaCl comercial. O incremento da CEa não influenciou, significativamente, a germinação que variou de 80 a 97,5%, porém afetou a velocidade de germinação e o crescimento das plântulas. O tempo necessário para as sementes germinarem aumentou de 0,63 dia por incremento unitário da CEa, acima de 2,2 dS m-1; a fitomassa total das plântulas foi afetada a partir de 5,4 dS m-1, sendo o sistema radicular mais sensível que a parte aérea (Marinho et al., 2005a; Marinho et al., 2005b). Numa segunda etapa desse trabalho, após repicagem para o viveiro, as plantas provenientes dos vários tratamentos se recuperaram do estresse salino, após passarem a ser irrigadas com água de CEa = 2,2 dS m-1, durante 120 dias, crescendo no mesmo ritmo daquelas germinadas em baixos níveis de salinidade (Marinho et al., 2005a). Em condições de campo, na Estação Experimental de Jiqui, em Parnamirim, RN, pertencente à Empresa de Pesquisa Agropecuária do Rio Grande do Norte EMPARN, a mesma equipe de pesquisadores estudou, durante dois anos, a viabilidade de utilização de águas de elevada salinidade (CEa = 0,1, 5,0, 10,0 e 15 dS m -1 a 25º C) na irrigação do coqueiro, cv. Anão Verde, em fase inicial de produção, com 3,5 anos de cultivo (Marinho et al., 2005a; Marinho et al., 2006). Constatou-se tendência de aumento do número de flores femininas por inflorescência, com o uso de águas Biossalinidade e produção agrícola 195 salinas. Aumentou, também, o efeito da salinidade da água (p < 0,01) sobre a relação flor / fruto colhido (FL/ FC), entre o 10° e o 19° cachos, com acréscimo linear de 11,1% por incremento unitário da CEa, em relação ao controle; ou seja, houve formação de 1,23 flor a mais por fruto colhido para cada unidade de acréscimo da CEa, relativamente ao nível mais baixo de salinidade, o que corresponde a 11,12 flores para cada fruto colhido (Figura 5). Apesar de a salinidade ter aumentado o número de flores femininas, conforme abordado, anteriormente, elas não resultaram em maior produção de frutos, havendo, portanto, maior percentual de abortamento de flores femininas nas plantas expostas ao estresse salino. Figura 5. Relação flor/fruto colhido (FL/FC) entre o 10º e 19º cacho de coco, cv. Anão Verde, em função do nível de salinidade da água (CEa) aplicada na irrigação (Fonte: Ferreira Neto et al., 2007a) Quanto à produção (Figura 6), no período compreendido entre a 8 a e a 13 a colheita (época de chuvas), foi crescente o número de frutos colhidos (NFC), até o nível de 10 dS m-1 e, mesmo no nível mais alto de salinidade (15 dS m-1), a produção foi maior que no tratamento controle; ressalte-se ter este período coincidido com período de chuvas, em que a irrigação com água salina complementava a exigência hídrica das plantas, quando era negativo o balanço hídrico. Por outro lado, na época de estiagem ou seca, coincidindo com o período entre a 14ª e a 19ª colheitas, a média mensal de NFC decresceu linearmente (p < 0,01), com taxa de 3,4% por incremento unitário da CEa, em relação ao nível mais baixo de salinidade. As perdas do número de frutos colhidos nesse período, em relação a N1, foram de 16,4, 33,1 e 49,8% em N 2 , N 3 e N 4 , respectivamente (Ferreira Neto, 2007a). Com base, ainda, nos dados de produção, obtidos pelos pesquisadores da UAEAg/CTRN/UFCG, concluise que é preferível irrigar coqueiro ‘Anão Verde’ com águas de 15 dS m-1, do que deixar a cultura em condições de sequeiro, com base em registros de produção comercial nessas condições de cultivo. A salinidade da água reduz o número e o peso de frutos de coqueiro da Figura 6. Valores médios mensais do número de frutos colhidos (NFC) do coqueiro ‘Anão Verde`, entre a 8ª e a 13ª (A) e entre a 14ª e a 19ª colheitas (B), em função do nível de salinidade da água (CEa) aplicada na irrigação (Fonte: Ferreira Neto et al., 2007a) cv. Anão Verde, sendo os decréscimos, respectivamente, de 2 e 3,4%, por aumento unitário da condutividade elétrica da água de irrigação. Durante a fase produtiva, o coqueiro da cv. Anão Verde pode ser classificado como uma cultura tolerante à salinidade. ÁGUA DO MAR NA AGRICULTURA BIOSSALINA O ser humano depende, basicamente, de vegetais, produzidos em larga escala sob irrigação, com uso de água de boa qualidade. As cinco espécies mais utilizadas na alimentação humana – trigo, milho, arroz, batata e soja – morrerão se expostas à água do mar. Mas a natureza é repleta de vegetais, desenvolvendo-se em condições de alta salinidade e diretamente em contato com a água de mares, oceanos e lagos salgados. Da mesma forma como os cientistas souberam domesticar e melhorar as espécies, tradicionalmente cultivadas, saberão fazer o mesmo com essas plantas adaptadas a condições adversas de salinidade. A agricultura com água do mar é uma idéia antiga, posta em prática após a II Guerra Mundial. Em 1949, o ecologista Hugo Boyko e a horticultora Elisabeth Boyko (Tromp, 1971; Glenn et al., 1998a), durante a formação do Estado de Israel, foram para a cidade de Eilat, próxima ao Mar Vermelho, com o objetivo de 196 Pedro D. Fernandes et al. alterar a paisagem, de modo a permitir a sua habitação e instalação de colônias. Na falta de água doce, os Boykos usaram água salgada de poços e água bombeada diretamente do mar. Os frutos desse trabalho difundiram a idéia para áreas semelhantes em todo o globo. Novos ecossistemas foram criados, em países como Índia, México, países do Golfo Árabe, China, dentre outros, onde áreas estão sendo cultivadas, utilizando água salgada, diretamente ou através de diluição com águas residuárias. No deserto Negev, em Israel, por exemplo, Tamarix aphylla cv. Erecta está sendo irrigada por gotejamento, com sucesso, para produção de madeira. No Golfo Árabe, pesquisadores da University of Arizona estão produzindo, experimentalmente, óleo de Salicornia e de Arthrocnemum, irrigadas com água do mar (Aronson & Floc’h, 1996). Segundo Glenn et al. (1998a), a utilização de águas salgadas de oceanos e mares precisa atender a duas condições: a - os cultivos devem ser úteis, com rendimento suficiente para justificar os custos de bombeamento da água do mar; b - devem ser desenvolvidas tecnologias para o cultivo de forma sustentável, sem agressão adicional ao meio ambiente. No desenvolvimento da agricultura com água do mar, os pesquisadores têm buscado duas alternativas: (a) tentam melhorar geneticamente as culturas tradicionais, como aveia e trigo, para tolerância a sais, ou (b) buscam domesticar plantas selvagens tolerantes a sais. Em 1979, por exemplo, a equipe de Emanuel Epstein registrou, com uso de água do mar, produção de pequena quantidade de grãos de aveia, em linhagens previamente propagadas por gerações em ambiente com baixos níveis de sal (Epstein, 1980). São limitados os resultados dos trabalhos de melhoramento, visando à seleção de genótipos tolerantes à salinidade, com base em métodos convencionais. A falta de sucesso se deve, em parte, à metodologia utilizada pelos melhoristas, na avaliação à tolerância ao estresse salino dos materiais genéticos. Segundo Yamaguchi & Blumwald (2005), as melhores perspectivas estão nos estudos de biologia molecular e de transgenia; esforços recentes de especialistas da engenharia genética visam incorporar genes de tolerância a sais em culturas tradicionais, sem divulgação de resultados, até então (Glenn et al., 1998a; Arzani, 2008). Considerando-se a dificuldade de alterar a fisiologia de uma espécie, tradicionalmente sensível à salinidade, outros pesquisadores têm investido seu trabalho em domesticar plantas selvagens tolerantes a sais, as halófitas, para uso alimentar, forragem e produção de sementes ricas em óleo. Esta linha de trabalho tem como garantia de sua viabilidade, o fato de povos antigos, habitantes do golfo do Rio Colorado, terem se alimentado de grãos de capim-sal (Distichlis palmieri) (Dregne, 1991). Vale, ainda, ressaltar que as culturas tradicionais tiveram origem em formas selvagens. De grande valia pode ser a observação de plantas vegetando em áreas costeiras e em mangues, em contato direto com a água salgada, uma indicação de sua tolerância a altas concentrações de sais, a serem utilizadas em pesquisas para melhor avaliação da tolerância à salinidade. Na Figura 7 estão detalhes de uma planta de Terminalia cattapa (sombreiro), em praia de Maragogi, Alagoas, com produção abundante de frutos, onde diariamente a maré banha as raízes da planta, expostas ao ar, devido à ruptura do quebra mar. Essa espécie é comum em arborização de cidades, sendo a polpa dos frutos utilizada como alimento de crianças e jovens famintos; a maior riqueza, entretanto, está na amêndoa, rica em proteínas, que, por desconhecimento, geralmente é desprezada. Portanto, a Terminalia cattapa pode ter grande potencial para cultivo em áreas costeiras, com irrigação com água do Figura 7. Vista de uma planta de Terminalia cattapa à beira mar em Maragogi, AL, com detalhes de frutos e folhas (no alto), sem sinais de injúrias, mesmo com o sistema radicular exposto ao ar e em contato direto com a água salgada, devido à ruptura do quebra mar (Foto: P.D.Fernandes, 15/11/2005) Biossalinidade e produção agrícola 197 mar, objetivando a produção de frutos, madeira (prestase à fabricação de embalagens, por sua baixa densidade) ou, simplesmente, visando ao sequestro de carbono. No litoral de Maragogi, Al, foi encontrada outra espécie, não classificada pelos autores, ocorrendo à beira mar (Figura 8), com aspectos muito semelhantes a outras espécies, com potencialidades econômicas já comprovadas, ilustradas nas Figuras 9 e 10. Figura 10. Atriplex em habitat natural e detalhe de ramos na fase reprodutiva. Fonte: Ogle & St John (2003) Figura 8. Espécie de folhas suculentas, não identificada, ocorrendo naturalmente à beira mar do litoral, em Maragogi, Alagoas, com detalhes de ramos com flores. Foto: P.D.Fernandes (17/01/2006) Figura 9. Salicornia bigelovii em habitat natural e desenho de detalhes de uma planta. Fonte: Ogle & St John (2003) Aspectos técnicos e econômicos Normalmente, as culturas são irrigadas quando a umidade do solo baixa a 60-50% da capacidade de campo (Bernardo et al., 2008); além disso, com água doce os irrigantes aplicam apenas a lâmina necessária para repor a quantidade evapotranspirada pela cultura. Com água do mar, a irrigação precisa ser diária e em quantidade maior que a utilizada pelas plantas, para prevenir a acumulação de sais na zona radicular. Como o cultivo se dá em solo arenoso, com alta facilidade de drenagem, tal manejo é facilitado, lavando os sais que se depositam na superfície do terreno; outro aspecto a considerar, é a necessidade de ser mantida a umidade do solo em altos potenciais, tornando menos críticas a pressão osmótica e a absorção de água pelas plantas. O maior custo da agricultura irrigada, geralmente, é com o acesso à água, sendo proporcional à quantidade necessária e à profundidade de bombeamento. Na agricultura com água do mar, comumente esse custo é baixo, devido ao nível do mar, ao contrário do bombeamento de água na agricultura irrigada convencional, em que, muitas vezes, é de poços profundos. Uma vez bombeada a água, a irrigação com água do mar não requer equipamentos especiais de distribuição, por ser muito utilizado o sistema de distribuição superficial em bacias. Quando é utilizado pivô central ou aspersão por linha móvel, é imprescindível o revestimento interno com tubos plásticos para a água do mar não ter contato direto com a tubulação de metal (Glenn et al., 1998a). O cultivo de halófitas deve ser rentável, economicamente, avaliando-se se podem substituir culturas convencionais para uso específico. Como um dos maiores desafios, em terras áridas e semi-áridas, é alimentar animais, geralmente visa-se produzir forragem para bois, carneiros, cabras e aves. Além das utilidades já abordadas, muitas halófitas são fontes, também, de produtos químicos especiais, utilizados como fármacos. Como exemplos, folhas de Excoecaria agalloca tem sido utilizadas no tratamento de epilepsia e as cinzas da madeira no tratamento de lepra; efusão de cascas e de raízes de Acanthus ilicifolius é 198 Pedro D. Fernandes et al. recomendada para tratamento de alergias e doenças de pele (Albert & Popp, 1977). Sustentabilidade A maior exigência para uso de águas salgadas do mar deve ser a sustentabilidade da agricultura salina, preservando-se a possibilidade de produção por tempo longo. Contudo, este não é um problema apenas da agricultura irrigada com água do mar, pois muitos projetos de irrigação convencional não obedeceram a esse critério, com sérios impactos sobre o meio ambiente. Em regiões áridas, a irrigação com água de boa qualidade é praticada, geralmente, em terras do interior, com restrições de drenagem, resultando na elevação do teor de sais e do lençol freático. Quando o problema se agrava, os agricultores precisam instalar sistemas caros de drenagem subterrânea; a água coletada dos drenos passa a ser um outro problema, a exemplo dos grandes projetos no Vale São Joaquim na Califórnia, cuja água de drenagem contém alto teor de selênio, elemento presente em muitos solos do oeste americano; a acumulação de selênio tem causado morte e deformações de animais da fauna local, além de riscos à saúde humana (EPA, 1998; Hamon, 2004). O cultivo de halófitas é uma solução para esse caso de selênio, pelo fato de as plantas absorverem quantidades não muito altas do elemento, sem atingir níveis tóxicos, considerando que na quantidade retida pelo vegetal não há riscos para alimentação animal (National Research Council, 1990). Pode ser, também, solução para as extensas fazendas de criação de camarão localizadas em zonas costeiras; a descarga de efluentes dos tanques de criação têm causado proliferação de algas e de doenças em rios e baías, onde são despejados, pela riqueza em nutrientes. Nesses casos, o cultivo de halófitas pode ser uma solução, reciclando os efluentes na irrigação, em vez de descarregá-los em rios; no México há exemplos dessa associação (Glenn et al., 1991). A agricultura irrigada com água do mar não está isenta de tais problemas, mas tem algumas vantagens (Glenn et al., 1998a, 1998b): a - existe drenagem livre em terras costeiras, retornando a água drenada para o mar; em áreas cultivadas por mais de 10 anos não houve elevação dos teores de sais; b - aquíferos na costa e em áreas desérticas geralmente contém concentrações elevadas de sais, sem problemas de serem agravadas com uso de água do mar; c - geralmente, os solos nessas condições são estéreis ou quase estéreis, de modo que o cultivo com água do mar causa menos impacto no ecossistema que o da agricultura tradicional. Exemplos de agricultura irrigada com água do mar Produção de forragem: Glenn et al. (1998a) relatam experiências conduzidas em Puerto Peñasco, no Golfo da Califórnia, com uso de águas salinas (40.000 ppm de sais) para irrigar halófitas, sendo obtidas produções de biomassa seca de até 2 kg m-2, aproximadamente igual à produção de alfafa irrigada com água doce. As espécies mais produtivas foram dos gêneros Salicornia (‘glasswort’ – Figura 9), Atriplex (erva-sal – Figura 10) e Suaeda (‘sea blite’ – Figura 11), todos da família Chenopodiaceae que abrange cerca de 20% das espécies halófitas. Foram, também, altamente produtivos o capim Distichlis spp (família Poaceae) e a espécie Batis spp (família Batidaceae – Figura 12). Figura 11. Detalhes de uma planta da espécie Suaeda linearis. Fonte: Ogle & St John (2003) Figura 12. Batis marítima em seu habitat natural e detalhes de ramos com flores. Fonte: Ogle & St John (2003) Muitas halófitas são ricas em proteínas e carboidratos digestíveis. Infelizmente, essas plantas contêm, também, grandes quantidades de sais; acumular sais é uma das maneiras de ajustamento osmótico para as plantas se adaptarem aos ambientes salinos, conforme já abordado anteriormente. Como os sais não têm valor calórico, ao ocuparem espaço nas células, diluem o valor nutricional das plantas. Outro problema é a limitação da quantidade de Biossalinidade e produção agrícola forragem rica em sais que deve ser fornecida aos animais. A solução é limitar a 30-50% a substituição de feno convencional por forrageiras halófitas. No trabalho relatado por Glenn et al. (1998a, 1998b), os animais alimentados com forragem de Salicornia, Suaeda e Atriplex ganharam peso correspondente aos alimentados apenas com feno, sem ser afetada a qualidade da carne; eles foram atraídos pelo gosto dos sais e beberam mais água. Fazendas produtoras de óleo: Segundo Glenn et al. (1991; 1998a), a mais promissora halófita é a Salicornia bigelovii, uma planta anual suculenta, presente em mangues, com produção de grande quantidade de sementes, ricas em óleo (30%) e em proteínas (35%); o óleo é rico em poli-insaturados, similar ao de girassol na composição de ácidos graxos; é comestível, com sabor e aroma agradáveis, similar ao óleo de oliva e pode ser refinado em equipamentos da indústria convencional. Na Figura 9 está uma foto e o desenho de uma planta dessa espécie. A torta, após extração do óleo, é rica em proteína, mas contém uma saponina amarga, que restringe o volume ingerido pelos animais; entretanto, na quantidade possível de ingestão, atende às necessidades da criação de frangos. Felizmente, a saponina não contamina o óleo. Há áreas cultivadas com Salicornia bigelovii no México, Emirados Árabes, na Arábia Saudita e Índia. No México, durante 6 anos de cultivo, a média de produção é de 1,7 kg m-2 de biomassa total, correspondendo a 0,2 kg de óleo m-2, produção esta superior à produção de óleo de soja irrigada com água doce. Um dos problemas é a irrigação da cultura, por causar a água salgada corrosão dos equipamentos de irrigação, passível, entretanto, de ser solucionado. Em testes de lisimetria, foi verificado que essa espécie de Salicornia pode sobreviver com uso de água de até 100.000 ppm (cerca de 3 vezes à do mar). Para altas produções de biomassa há necessidade de uma lamina de água do mar 35% maior do que se fosse na agricultura convencional, devido à seletividade da espécie na absorção de água, concentrando demasiadamente os sais no solo; o excesso de água contribuirá para a lixiviação do excesso de sais da área cultivada. Para altas produções, o período de 100 dias anteriores ao florescimento da Salicornia precisa coincidir com temperaturas baixas, restringindo-se, portanto, o seu cultivo em regiões sub-tropicais; não é possível cultivála na maioria das áreas costeiras desérticas do planeta, situadas nos trópicos quentes. Portanto, é viável e promissor o uso de água do mar para irrigar halófitas, dependendo da necessidade de produção de alimentos e da demanda de água de boa qualidade para outros fins. 199 REFERÊNCIAS Abdelly, C.; Barhoumi, Z.; Ghnaya, T.; Debez, A.; Hamed, K. B.; Ksouri, R. Potential utilization of halophytes for the rehabilitation and valorization of salt-affected areas in Tunisia. In: Ozturk, M.; Waisel, Y.; Khan, M. A.; Gork, G. (ed.). Biosaline agriculture and salinity tolerance in plants. Berlin: Birkhauser Verlag, 2006. p.163-172. Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.). Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. 367p. Agarie, S.; Shimoda, T.; Shimizu, Y.; Baumann, K.; Sunagawa, H.; Kondo, A.; Ueno, O.; Nakahara, T.; Nose, A.; Cushman J.C. Salt tolerance, salt accumulation, and ionic homeostasis in an epidermal bladder-cell-less mutant of the common ice plant Mesembryanthemum crystallinum. Journal of Experimental Botany, v.58, n.8, p.1957-1967, 2007. Ahmad, C. N. Coordinated research programme on saline agriculture. Islamabad, Pakistan: PARC, 1988, 115p. Final Report Ahmed, H. D.; Ammar, D. B.; Zid, E. Physiology of salt tolerance in Atriplex halimus L. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.107114. Al-Attar, M. Role of biosaline agriculture in managing freshwater shortages and improving water security. Dubai: International Center for Biosaline Agriculture (ICBA), World Food Prize, No.24-25. 2002. 10p. Albert, R.; Popp, M. Chemical composition of halophytes from the Neusiedler lake region in Áustria. Oecologia, v.27, n.1, p.157-170, 1977. Aronson, J.; Floc’h, E. L. Restoration ecology of salt-affected, arid and semi-arid lands. In: Choukr-Allah, R.; Malcolm, C. V.; Hamdy, A. (ed.). Halophytes and biosaline agriculture. New York: Marcel Dekker Inc. 1996, p.55-71. Arzani, A. Improving salinity tolerance in crop plants: A biotechnological view. Vitro Cell Developmental Biology Plant, v.44, n.5, p.373-383, 2008. Ashraf, M. Y.; Foolad, M. R. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Environmental and Experimental Botany, v.59, p.206-216, 2007. Ashraf, M. Y.; Harris, P. J. C. Potential biochemical indicators of salinity tolerance in plants. Plant Science, v.166, p.3-16, 2004. Ashraf, M. Y.; Sarwar, G.; Hussain, F.; Wahed, R. A.; Igbal, M. M. Growth performance and nutritional value of salt tolerant plants growing under saline environments. In: Ozturk, M.; Waisel, Y.; Khan, M. A.; Gork, G. (ed.). Biosaline agriculture and salinity tolerance in plants. Berlin: Birkhauser Verlag, 2006. p.35-44. Atia, A.; Hamed, K. B.; Devez, A.; Abdelly, C. Salt and seawater effects on the germination of Crithmum maritimum. In: Ozturk, M.; Waisel, Y.; Khan, M. A.; Gork, G. (ed.). Biosaline agriculture and salinity tolerance in plants. Berlin: Birkhauser Verlag, 2006. p.29-34. 200 Pedro D. Fernandes et al. Batanouny, K. H. Adaptation of plants to saline conditions in arid regions. In: Lieth, H.; Al Masoom, A. (ed.) Towards the rational use of high salinity tolerant plant. The Netherlands: Kluwer Academic Publication, 1993. p.387401. Batanouny, K. H. Ecophysiology of halophytes and their traditional use in Arab World. In: Choukr-Allah, R.; Malcolm, C. V.; Hamdy, A. (ed.) Halophytes and biosaline agriculture. New York: Marcel Dekker, Inc. 1996. 401p. Batanouny, K. H.; Hassan, A. A.; Fahmy, G. M. Ecophysiological studies on the halophytes in the arid and semi-arid zones. I. The salt-secreting Limonium delicatulum (Gir.) Ktze. Flora, v.186, p.105-116, 1992. Batanouny, K. H.; Hassan, A. A.; Zayed, K. M. Proline accumulation in plants of different ecological groups as a response to water deficit. Qatar University Science Bulletin, v.5, p.131-143, 1985. Batanouny, K. H.; Sitta, Y. M. A. Eco-physiological studies on the halophytes in the arid and semi-arid zones. I. Autecology of the salt secreting halophyte Limoniastrum monopetalum (L.) Boss. Acta Bot. Acad. Sci. Hungarian, v.23, p.13-43, 1979. Bernardo, S.; Soares, A. A.; Mantovani, E. C. Manual de irrigação. Viçosa: Editora Universitária da UFV, 2008, 625p. Blumwald, E.; Aharon, G. S.; Apse, M. P. Sodium transport in plant cells. Biochemica et Biophysica Acta, v.1465, n.1, p.140-151, 2000. Bohnert, H. J.; Nelson, D. E.; Jensen, R. G. Adaptations to environmental stresses. The Plant Cell, v.7, p.1099-1111, 1995. Chapman, V. J. Salt marshes and salt deserts of the world. New York: Edn Lehre, 1974, 355p. Choukr-Allah, R.; Malcolm, C. V.; Hamdy, A. Halophytes and biosaline agriculture. New York: Marcel Dakker, Inc., 1996. 355p. Daoud, M.; Harrouni, A.; Huchzermeyer, B.; Koyro, H. W. Comparison of salinity tolerance of two related subspecies of Beta vulgaris: The sea beet (Beta vulgaris ssp. maritima) and the sugar beet (Beta vulgaris ssp. vulgaris). In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.). Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. 367p. DaSilva, E. J.; Baydoun, E.; Badran, A. Biotechnology and the developing world. Electronic Journal of Biotechnology, v.5, n.1, p.64-92, 2002. Dastidar, K. G.; Maitra, S.; Goswami, L.; Roy, D.; Kali Pada, K. D.; Majumder, A. L. An Insight into the molecular basis of salt tolerance of L-myo-Inositol 1-P Synthase (PcINO1) from Porteresia coarctata (Roxb.) Tateoka, a halophytic wild rice. Plant Physiology, v.140, p.1279-1296, 2006. Debez, A.; Taamalli, W.; Saadaoui, D.; Ouerghi, D.; Zarrouk, M.; Huchzermeyerm, B.; Abdelly, C. Salt effect on growth, photosynthesis, seed yield and oil composition of the potential crop halophyte Cakile maritima. In: Ozturk, M.; Waisel, Y.; Khan, M. A.; Gork, G. (ed.). Biosaline agriculture and salinity tolerance in plants. Berlin: Birkhauser Verlag, 2006. p.55-65. Dregne, H. E. Desertification costs: Land damage and rehabilitation. Texas: Texas Tech University, 1991. 75p. EPA - Environmental Protection Agency. Report on the Peer Consultation Workshop on selenium aquatic toxicity and bioaccumulation. Washington: U.S. Environmental Protection Agency, 1998. 57p. Epstein, E. Saline culture of crops: A genetic approach. Science, v.210, n.2, p.399-404, 1980. Epstein, E.; Bloom, A. J. Nutrição mineral de plantas: Princípios e perspectivas. Londrina: Editora Planta, 2006. 403p. FAO. http://faostat.fao.org. 2005 (Acesso em 15/10/05). Ferreira Neto, M.; Gheyi, H. R.; Fernandes, P. D.; Holanda, J. S.; Medeiros, J. F. Qualidade do fruto verde de coqueiro em função da irrigação com água salina. Revista Brasileira de Engenharia Agrícola e Ambiental, v.6, n.1, p.69-75, 2002. Ferreira Neto, M.; Gheyi, H. R.; Fernandes, P. D.; Holanda, J. S.; Blanco, F. F. Emissão foliar, relações iônicas e produção do coqueiro irrigado com água salina. Ciência Rural, v.37, p.1675-1681, 2007a. Ferreira Neto, M.; Holanda, J. S.; Folegatti, M. V.; Gheyi, H. R.; Pereira, W. E.; Pereira, W. C.; Cavalcante, L. F. Quality of green fruits of ‘Anão verde’ coconut in relation to doses of nitrogen and potassium via fertirrigation. Revista Brasileira de Engenharia Agrícola e Ambiental, v.11, p.453458, 2007b. FIDA-Fondo Internacional de Desarrollo Agrícola. Programa de ahorro de recursos de água dulce mediante la producción de forrajes resistentes a la salinidad en las zonas marginales de la región de Asia Occidental y África Del Norte. Rome: Fondo Internacional de Desarrollo Agrícola, 2004, 6p. Flowers, T. J. Improving salt tolerance. Journal of Experimental Botany, v.55, n.2, p.307-319, 2004. Flowers, T. J.; Flowers, S. A. Why does salinity pose such a difficult problem for plant breeders? Agricultural Water Management, v.78, n.1, p.15-24, 2005. Flowers, T. J.; Hajibagheri, M. A.; Clipson, N. J. W. Halophytes. The Quarterly Review of Biology, v.61, n.2, p.313-337, 1986. Flowers, T. J.; White, P. J.; Broadley, M. R. Improving crop salt tolerance. Journal of Experimental Botany, v.55, n.2, p.307319, 2004. Fricke, W.; Peters, W. S. The biophysics of leaf growth in saltstressed barley. A study at the cell level. Plant Physiology, v.129, n.2, p.374-388, 2002. Ghosh Dastidar K, Maitra S, Goswami L, Roy D, Das KP, Majumder AL. An insight into the molecular basis of salttolerance of L-myo-inositol 1-phosphate synthase (PcINO1) from Porteresia coarctata (Roxb.) Tateoka, a halophytic wild rice. Plant Physiology, v.140, p.1279–1296, 2006. Glenn, E. P.; Brown, J. J.; O‘Leary, J. W. Irrigating crops with seawater. Scientific American, v.279, n.2, p.76-81, 1998a. Glenn, E. P.; O‘Leary, J. W; Watson, M. C.; Thompson, T. L.; Kuehl, R. O. Salicornia bigelovii Torr.: An oilseed halophyte for seawater irrigation. Science, v.251, p.10651067, 1991. Biossalinidade e produção agrícola Glenn, E. P.; Tanner, R.; Miyamoto, M.; Fitzsimmons, K.; Boyer, J. Water use productivity and forage quality of the halophyte Atriplex nummularia grown on saline waste water in a desert environment. Journal of Arid Environment, v.38, p.45-62, 1998b. Gorham, J. Mechanisms of tolerance of halophytes. In: ChoukrAllah, R.; Malcolm, C. V.; Hamdy, A. (ed.). Halophytes and biosaline agriculture. New York: Marcel Dekker Inc. 1996, p.31-53. Greenway, H; Osmond, C. B. Salt responses of enzymes from species differing in salt tolerance. Plant Physiology, v.49, n.2, p.256-259, 1972. Habit, M. A., Contreras, T. D., and Gonzalez, R. H. Prosopis tamarugo: fodder tree for arid zones. Rome: FAO - Plant Protection Paper 25. 1981. 285p. Hamed, K. B.; Messedi, D.; Ranieri, A.; Abdelly, C. Diversity in the response of two potential halophytes (Batis maritimum and Crithmum maritimum) to salt stress. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.) Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.71-80. Hamon, C. Similarities between solving agricultural drainage problems in the San Joaquin Valley and ecosystem restoration of the Salton Sea. Los Angeles: 2004. www.saltonsea.water.ca.gov/calendar/ac/04.27.2004/ SJAgDrainageBriefing.pdf. (Acesso em 15/10/05). Hans-Werner, K.; Geibler, N.; Hussin, S.; Huchzermeyer, B. Survival at extreme locations: Life strategies of halophytes – the long way from system ecology, whole plant physiology, cell biochemistry and molecular aspects back to sustainable utilization at field sites. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.) Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.1-20. Hasegawa, P. M.; Bressan, R. A.; Zhu, J. K.; Bohnert, H. J. Plant cellular and molecular responses to high salinity. Annual Review of Plant Physiology and Plant Mollecular Biology, v.51, n.3, p.463-499, 2000. Hendricks, R. C.; Bushnell, D. M. Halophytes, algae and bacteria food and fuel feedstocks. National Aeronautics and Space Administration / NASA: Washington, TM215294, 2009, 45p. Huxley, A. The New RHS Dictionary of Gardening. New York: MacMillan Press. 1992. 333p. ICBA - International Center of Biosaline Agriculture. Stratetic plan. Dubai: International Center of Biosaline Agriculture, 2005. www.biosaline.org/program.htm. Acesso em 14/10/05 Islam, T. Mechanisms of salt tolerance in crop plants and salinity management. Mymensingh: Bangladesh Institute of Nuclear Agriculture. 2009. 25p. Izzo, R.; Incerti, A.; Bertolla, C. Sea water irrigation: effects on growth and nutrient uptake of sunflower plants. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.). Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.61-70. Jaradat, A. A.; Shahid, M.; Al-Maskri, A. Genetic diversity in the Batini Barley Landrace from Oman: II. Response to salinity stress. Crop Science, v.44, n.3, p.997-1007, 2004. 201 Kafi, M.; Jami-Al-Ahmadi, M. Study of kochia (Kochia scoparia) as a forage crop. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.177198. Khan, M. A.; Ansari, R.; Ali, H.; Gul, B.; Nielsen, B. L. Panicum turgidum, a potentially sustainable cattle feed alternative to maize for saline areas. Agriculture, Ecosystems and Environment, v.129, n.4, p.542-546, 2009. Khan, M. A.; Ungar, I. A.; Showalter, A. M. The effect of salinity on the growth, water status, and ion content of a leaf succulent perennial halophyte, Suaeda fruticosa. Journal of Arid Environment, v.45, p.73-84, 2000. Khan, M. A.; Weber, D. J. Ecophysiology of high salinity tolerant plants. Amsterdan: Springer, 2006. 325p. Kholodova, V. P.; Neto, D. S.; Meshcheryakov, A. B.; Borisova, N. N.; Aleksandrova, S.N.; Kuznetsov, V. V. Can stressinduced CAM provide for performing the developmental program in Mesembryanthemum crystallinum plants under long-term salinity? Russian Journal of Plant Physiology v.49, p.336-343, 2002. Kingsbury, R. W.; Epstein, E. Salt sensitivity in wheat. A case for specific íon toxicity. Plant Physiology, v.80, n.3, p.651654, 1986. Larcher, W. Ecofisiologia vegetal. São Carlos: Rima, 2000, 531p. Levy, G. J.; Mamedov, A. I.; Goldstein, D. Sodicity and water quality effects on slaking of aggregates from semi-arid soils. Soil Science, v.168, n.8, p.552-562, 2003. Liu, X.; Qiao, H. L.; Tadano¸T.; Khan, M. A. Comparative effect of NaCl and seawater on seed germination of Suaeda salsa and Atriplex centralasiatica. In: Ozturk, M.; Waisel, Y.; Khan, M. A.; Gork, G. (ed.). Biosaline agriculture and salinity tolerance in plants. Berlin: Birkhauser Verlag, 2006. p.45-54. Luttge, U.; Fischer, E.; Steudle, E. Membrane potentials and salt distribution in epidermal bladders and photosynthetic tissues of Mesembryanthemum crystallinum L. Plant, Cell and Environment, v.1, n.1, p.121-129, 1978. Maas, E. V. Crop salt tolerance. In: Tanji, K. K. (ed.). Agricultural salinity assessment and management. New York: American Society of Civil Engineers, p.262-304, 1990. Mahmoudi, H.; Attia, H.; Tarchouni, I.; Ouerghi, Z.; Lachaal, M. Physiological responses of two Arabidopsis thaliana isolates, N1438 and Col, to different salts. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.). Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.99-106. Mano, Y.; Takeda K. Mapping quantitative trait loci for salt tolerance at germination and the seedling stage in barley (Hordeum vulgare L.). Euphytica, v.94, p.263-272, 1997. Mansour, M. M. F.; Salama, K. H. A. Cellular basis of salinity tolerance in plants. Environment and Experimental Botany, v.52, p.113-122, 2004. Marinho, F. J. L.; Ferreira Neto, M.; Gheyi, H. R.; Fernandes, P. D.; Viana, S. B. A. Uso de água salina na irrigação do coqueiro (Cocus nucifera L.). Revista Brasileira de Engenharia Agrícola e Ambiental, v.9, Suplemento, p.359364, 2005a. 202 Pedro D. Fernandes et al. Marinho, F. J. L.; Gheyi, H. R.; Fernandes, P. D. Germinação e formação de mudas de coqueiro irrigadas com águas salinas. Revista Brasileira de Engenharia Agrícola e Ambiental, v.9, n.3, p.334-340, 2005b. Marinho, F. J. L.; Gheyi, H. R.; Fernandes, P. D.; Holanda, J. S.; Ferreira Neto, M. Cultivo de coco Anão Verde irrigado com águas salinas. Pesquisa Agropecuária Brasileira, v.41, n.8, p.1277-1284, 2006. MBARI. Monterey Bay Aquarium Institute. Marine Botany Salinity and morphology. Washington: USDA, 2005. 328p. Miranowski, A. A. The role of biosaline agriculture in managing freshwater shortages and improving water security. In: Mohammad, A. A.; Scanes, C. G. Perspectives in world food and agriculture. Ames: Iowa State Press, 2004. p.271-282. Mohammad, A. A.; Scanes, C. G. Perspectives in world food and agriculture. Ames: Iowa State Press, 2004. 382p. Mohr , H.; Schopfer, P. Plant physiology. Berlin: SpringerVerlag, 1995. 629p. Muhling, K. H.; Lauchli, A. Effect of salt stress on growth and compartimentation in leaves of two plant species differing in salt tolerance. Journal of Plant Physiology, v.159, n.1, p.137-146, 2002. Munns, R. Comparative physiology of salt and water stress. Plant Cell and Environment, v.159, n.1, p.137-146, 2002. Munns, R. Genes and salt tolerance: bring them together. New Phytologist, v.143, n.3, p.645-663, 2005. Munns, R.; Husain, S.; Rivelli, A. R.; James, R. A.; Condon, A. G. T.; Lindsay, M. P.; Lagudah, E. S.; Schchtman, D. P.; Hare, R. A. Avenues for increasing salt tolerance of crops, and the role of physiologically based selection traits. Plant and Soil, v.247, n.1, p.93-105, 2002. National Research Council. Saline agriculture: Salt tolerant plants for developing countries. Washington: National Academy Press, 1990. 75p. Nelson, D. E.; Rammesmayer, G.; Bohnert, H. J. Regulation of cell-specific inositol metabolism and transport in plant salinity tolerance. The Plant Cell, v.10, p.753-764, 1998. NRCS/USDA. Plants profile: Triglochin maritimum L. Washington: Natural Resources Conservation Service, USDA, http://plants.usda.gov. 2005 (Acesso em 18/10/05). Ogle, D. G.; St John, L. Fourwing Saltbush Plant Guide. Boise, Idaho: USDA-NRCS. 2003. 41p. O’Leary, J. W.; Glenn, E. P. Global distribution and potential for halophytes. In: Squires, V. R.; Ayoub, A. T. (ed.) Halophytes as a resource for livestock and rehabilitation of degraded lands. Dordrecht: Kluwer Acad. Publ., p.7-17, 1994. Orcutt, D. M.; Nilsen, E. T. Physiology of plants under stress. New York: John Willey & Sons, 2000. 225p. Ozturk, M.; Guvensen, A.; Sakçalt, S.; Gork, G. Halophyte plant diversity in the Irano-Turanian phytogeographical region of Turkey. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.) Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008. p.141-156. Ozturk, M.; Waisel, Y.; Khan, M. A.; Gork, G. (ed.). Biosaline agriculture and salinity tolerance in plants. Berlin: Birkhauser Verlag, 2006. 215p. Pereira, L. S.; Oweis, T.; Zairi, A. Irrigation management under water scarcity. Agricultural Water Management, v.57, n.3, p.175-206, 2002. Pollak, G.; Waisel, Y. Germination and vegetative reproduction of Aeluropus littoralis (Willd.) Parl. Ann. Arid Zone Research. 1972. 188p. Rozema, J. On the ecology of some halophytes from a beach plain in the Netherlands. Amsterdam: Vrije Universiteit. 1978, 191p. PhD Thesis Rozema, J. Biology of halophytes. In: Choukr-Allah, R.; Malcolm, C. V.; Hamdy, A. (ed.). Halophytes and biosaline agriculture. New York: Marcel Dekker Inc. 1996, p.17-30. Rygol, J.; Zimmermann, U.; Balling, A. Water relations of individual leaf cells of Mesembryanthemum crystallinum plants grown at low and high salinity. Journal of Membrane Biology, v.107, p.203-212, 1989. Shahid, S. A.; Dakhell, A. H.; Mufti, K. A.; Shabbir, G. Automated in-situ soil salinity logging in irrigated agriculture. European Journal of Scientific Research, v.36, n.2, p.288-297, 2009. Shahid, S. A.; Hasbini, B. Optimization of modern irrigation for biosaline agriculture. Arab Gulf Journal of Scientific Research, v.25, n.1-2, p.59-66, 2007. Souza, E. R.; Montenegro, A. A. A.; Montenegro, S. M. G. L.; Santos, T. E. M.; Andrade, T.S.; Pedrosa, R. R. Variabilidade espacial das frações granulométricas e da salinidade em um Neossolo Flúvico do semi-árido. Ciência Rural, v.38, n.2, p.698-704, 2008. Steudle, E.; Zimmermann, U.; Lüttge, U. Effect of turgor pressure and cell size on the wall elasticity of plant cells. Plant Physiology, v.59, p.285-289, 1977. Taiz, L.; Zeiger, E. Fisiologia vegetal. Porto Alegre: Artmed Editora. 2008. 820p. Tester, M.; Davenport, R. Na+ tolerance and Na+ transport in higher plants. Annals of Botany, v.91, p.503-527, 2003. Toderich, K. N.; Ismail, S.; Juylova, E. A.; Rabbimov, A. A.; Berchanov, B. B.; Shyuskaya, E. V. New approaches for biosaline agriculture development, management and conservation of sandy desert ecosystems. In: Abdelly, C.; Ozturk, M.; Ashraf, M.; Grignon, C. (ed.) Biosaline agriculture and high salinity tolerance. Berlin: Birkhauser Verlag, 2008a. p.247-264. Toderich, K.; Tsukatani, T.; Shoaib, I.; Massino, I.; Wilhelm, M.; Yusupov, S.; Kuliev, T.; Ruziev, S. Extent of salt affected land in central Asia: Biosaline agriculture and utilization of the salt-affected resources. Kyoto: Kyoto Institute of Economic Research, Discussion Paper No. 648. 2008b. 34p. Tromp, S. W. In memoriam doctor Hugo Boyko. International Journal of Biotechnology, v.15, n.1, p.1-2, 1971. ULPGC - Universidad de Las Palmas de Gran Canária. Agricultura salina – Centro de Biotecnologia Marina. www.cbm.ulpgc.es/AM%20intro-aplicaciones. 2005. (Acesso em 14/10/2005). Ungar, I. A. Ecophysiology of vascular halophytes. Boca Raton: CRC Press, 1991, 209p. Biossalinidade e produção agrícola USCENSUS. United States Census Bureau. 2010. http:// www.census.gov/. Acesso em 01/01/2010. Vogt, T.; Ibdah, M.; Schmidt, J.; Wray, V.; Nimtz, M.; Strack, D. Light-induced betacyanin and flavonol accumulation in bladder cells of Mesembryanthemum crystallinum. Phytochemistry, v.52, p.583-592, 1999. Wilt, J. G.; van Oosten, H. J. Bio-production and ecosystem development in saline conditions. Knowledge and innovation challenges. Hague: National Council for Agricultural Research (NRLO) 10E, 2000, 6p. Winter, K.; Holtum, J. A. M. The effects of salinity, crassulacean acid metabolism and plant age on the carbon isotope composition of Mesembryanthemum crystallinum L. A halophytic C3-CAM species. Planta, v.222, p.201–209, 2005. 203 Wuosmaa, A. M.; Hager, L. P. Methyl chloride transferase: carbonation route for biosynthesis of halometabolites. Science, v.249, n.1, p.160-162, 1990. Yamaguchi, T.; Blumwald, E. Developing salt-tolerant crop plants: Challenges and opportunities. Trends in Plant Science, v.10, n.2, p.615-620, 2005. Yensen, N. P. Halophytes uses for the twenty-first century. Tasks for vegetation science. v.40, p.367-396, 2006. Zhang, H. X.; Blumwald, E. Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit. Nature Biotechnology, v.19, p.765-768, 2001. Zhu, J. K. Plant salt tolerance. Trends in Plant Science, v.6, n.1, p.66-71, 2001. Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade 13 Nand K. Fageria1, Walter dos S. Soares Filho2 & Hans R. Gheyi3 1 2 Empresa Brasileira de Pesquisa Agropecuária Arroz e Feijão Empresa Brasileira de Pesquisa Agropecuária Mandioca e Fruticultura 3 Universidade Federal do Recôncavo da Bahia Introdução Salinidade e rendimento das culturas Considerações sobre a metodologia de avaliação para tolerância à salinidade Aspectos gerais Análise e interpretação de dados Caracteres morfológicos Características fisiológicas Melhoramento genético vegetal para tolerância à salinidade Variação em germoplasma Plantas nativas e exóticas como fontes de tolerância à salinidade Estratégias relacionadas ao melhoramento genético Introdução de cultivares tolerantes à salinidade Espécies de plantas adaptadas ao cultivo sob consições salinas Perspectivas futuras Conclusões Referências Manejo da salinidade na agricultura: Estudos básicos e aplicados ISBN 978-85-7563-489-9 Fortaleza - CE 2010 206 Nand K. Fageria et al. Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade INTRODUÇÃO A salinidade é um dos principais fatores que reduzem a produtividade das culturas. Em nível mundial, estimase que 20% da área cultivada e 33% da área irrigada sejam afetados por excesso de sais, boa parte dos quais situados no continente asiático (Heuer, 2003; Rains & Goyal, 2003; Sharma & Goyal, 2003; Ashraf & Foolad, 2005; Rengasamy, 2006; Ashraf & Foolad, 2007; Kant et al. 2008), abrangendo uma área total em torno de 900 milhões de hectares. De acordo com Pessarakli & Szabolcs (1999), todos os continentes, à exceção da Antártica, apresentam problemas de salinização do solo. Ainda em termos globais, a salinização dos solos está aumentando a uma taxa anual de 10% (Szabolcs, 1994). Além desses dados alarmantes, há que se acrescentar: i) a população mundial vai aumentar de 6,5 bilhões de indivíduos em 2009 para cerca de 10 bilhões em 2050 (Evans, 1998; Epstein & Bloom, 2005), ii) a urbanização e industrialização vão aumentar a competição por água de alta qualidade (Evans, 1998; Rains & Goyal, 2003) e iii) o manejo inadequado do solo e da água aumentará a dimensão do problema da salinidade (Hillel, 1994; National Academy of Sciences, 1999). Solos afetados por sais são definidos como aqueles que têm sido adversamente modificados para o crescimento da maioria das plantas pela presença, na zona radicular, de sais solúveis, sódio trocável, ou ambos (Soil Science Society of America, 1997). A salinidade reduz o crescimento das plantas em razão do acúmulo de quantidades tóxicas de vários íons e em virtude do aumento da tensão osmótica da solução, que restringe a absorção de água pelas plantas (Munns, 1993; Saqib et al., 2004, 2005, 2006, 2008; Ribeiro et al., 2009). A toxicidade de Na+ é o mais notável efeito da salinidade no crescimento das plantas (Saqib et al., 2008). Com o aumento dos teores de Na + e de Cl - ocorre uma diminuição dos teores de K + e de Ca 2+ na planta (Mansour et al., 2005; Kumar et al., 2008). Com a acumulação de altos teores de Na e Cl diminui a absorção de cátions e anions, ocasionando desequilíbrios nutricionais na planta, diminuindo seu rendimento agronômico (Romero et al., 1994; Maathuis, 2006; Kumar et al., 2008). Portanto, é altamente interessante a seleção de plantas tolerantes à salinidade, que excluem o Na+ no processo de absorção e tentam manter elevada a concentração de K na parte aérea (Munns et al., 2000; Tester & Davenport, 2003; Davenport et al., 2005; Saqib et al., 2004, 2005). Alta relação K/Na nos tecidos das plantas é considerada um bom indicador de tolerância à salinidade (Gorham, 1990; Wei et al., 2003). O excesso de sais reduz o processo fotossintético nas plantas, aumenta a respiração e diminui o crescimento (Saíram et al., 2002; Bayuello-Jimenez et al., 2003; Khadari et al., 2006). Os sais solúveis consistem, normalmente, de várias proporções dos cátions Ca 2+, Mg2+ e Na+, dos ânions Cl-, SO42- e HCO3- e, às vezes, de K+, CO32- e NO3-. Devido à alta concentração de sais solúveis, solos salinos são caracterizados por uma alta condutividade elétrica. A Tabela 1 mostra o efeito da condutividade elétrica na produção das culturas. O pH de solos salinos normalmente encontra-se na faixa de 7 a 8,5 (Mengel et al., 2001). Solos cuja porcentagem de sódio trocável (PST = Na trocável/CTC X 100) mostre-se superior a 15% são denominados salino-sódicos. A ocorrência de solos salinos e sódicos é comum em regiões áridas e semiáridas, devido à baixa precipitação e à alta taxa de evaporação, fazendo com que os sais, não lixiviados, acumulem-se em quantidades prejudiciais ao crescimento normal das plantas. A salinização também Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade Tabela 1. Resposta das culturas à condutividade elétrica da saturação do solo 207 SALINIDADE E RENDIMENTO DAS CULTURAS A salinidade afeta o crescimento e consequentemente a produção das culturas (Pardo et al., 2006). Seus efeitos no crescimento das plantas são discutidos detalhadamente no Capítulo 9. Relativamente a culturas anuais, a Tabela 2 traz informações sobre valor de salinidade limiar, decréscimo no rendimento das principais culturas com o aumento unitário da salinidade acima desse limiar e classificação de várias culturas quanto à tolerância à salinidade. Fonte: Adaptada de Mengel et al. (2001). ocorre em regiões litorâneas, em consequência da inundação do solo pela água salgada de mares ou oceanos. Em nível global, a cada ano verifica-se um aumento das áreas afetadas por sais, especialmente onde a irrigação é praticada sem um manejo adequado da água e do solo. A maior parte dos solos afetados por sais localiza-se em países em desenvolvimento, onde a densidade populacional é alta e, consequentemente, há necessidade de mais alimentos. No Brasil, além da região Nordeste, são encontrados solos salinos no Rio Grande do Sul e no Pantanal Mato-grossense (Ribeiro et al., 2009). Segundo Ribeiro et al. (2003), com base no mapa de solos do Brasil, os solos afetados por sais ocupam cerca de 160.000 km2 (16 milhões hectares) ou 2% do território nacional. A maior parte desses solos encontrase no Estado da Bahia (44% do total), seguido pelo Ceará, que compreende 25,5% da área total de solos afetados por sais do País. Conforme já mencionado, prevê-se que em 2050 a população mundial chegue a aproximadamente 10 bilhões de indivíduos, estando a maior parte desse aumento populacional projetada nos países em desenvolvimento, onde a demanda de alimentos será maior. Neste contexto, a incorporação de áreas afetadas por sais no processo produtivo de alimentos, no futuro, terá papel fundamental do ponto de vista socioeconômico. A literatura indica que, além de recuperar o solo, o uso de cultivares tolerantes à salinidade pode ser uma ação complementar para a produção de alimentos em solos salinos (François, 1994; Shalhevet, 1995; François, 1996; Khadri et al., 2006; Gama et al., 2009). Assim, este capítulo objetiva discutir o melhoramento genético e a metodologia de avaliação de genótipos relacionados a culturas anuais no tocante à tolerância à salinidade. CONSIDERAÇÕES SOBRE A METODOLOGIA DE AVALIAÇÃO PARA TOLERÂNCIA À SALINIDADE Aspectos gerais Existem inúmeros trabalhos na literatura que relatam a avaliação de espécies ou de genótipos de uma mesma espécie relativamente à sua tolerância à salinidade em condições de campo e em condições controladas (Fageria, 1985a e b; François, 1994; Akhtar et al., 2003; Murtaza et al., 2009). A escolha de metodologia apropriada de avaliação é a primeira etapa para o sucesso do processo de desenvolvimento de cultivares tolerantes à salinidade. Não existe uma regra geral para avaliação de material genético quanto à tolerância à salinidade. A metodologia pode variar de acordo com as condições climáticas da região, tipo de solo, grau de salinidade do solo e disponibilidade de recursos físicos, humanos e financeiros. Desse modo, a metodologia deve ser desenvolvida e adaptada para cada condição. Para tanto, é necessário conduzir experimentos em campo e em casa de vegetação no sentido de alcançar resultados satisfatórios. Indubitavelmente, porém, em todas as situações, alguns princípios de avaliação óptica devem ser levados em conta no processo de avaliação do material genético, a saber: 01. Substrato de crescimento uniforme. 02. Genótipos com ciclos de desenvolvimento iguais no mesmo experimento. 03. Metodologia de validação de resultados deve ser simples e permitir avaliar grande número de genótipos com razoável precisão. 04. Parâmetros de avaliação bem definidos. 05. Se o experimento é conduzido em campo, deve-se determinar o nível de salinidade antes de instalar o ensaio. É necessária uma clara definição, na área experimental, do problema de salinidade para o qual se espera que a planta possa responder. 208 Nand K. Fageria et al. Tabela 2. Limiar de salinidade, decréscimo no rendimento e tolerância de várias culturas à salinidade Cultura Cereais, Fibrosas e Culturas especiais Algodão (Gossypium hirsutum L.) Amendoim (Arachis hypogaea L.) Arroz (Oryza sativa L.) Aveia (Avena L.) Beterraba (Beta vulgaris L.) Cana-de-açúcar (Saccharum oficinarum L.) Caupi (Vigna unguiculata (L.) Walp.) Centeio (Secale cereale L.) Cevada (Hordeum vulgare L.) Feijão (Phaseolus vulgaris L.) Girassol (Helianthus annuus L.) Guar (Cyamopsis tetragonoloba (L.) Taub.) Linho (Linum spp.) Milheto (Pennisetum glaucum (L.) R. Br.) Milho (Zea mays L.) Soja (Glycine max (L.) Merr.) Sorgo (Sorghum bicolor (L.) Moench) Trigo (Triticum aestivum L.) Triticale (Triticum aestivum x Secale cereale) Forrageiras Alfafa (Medicago sativa L.) Capim Bermuda (Cynodon dactylon (L.) Pers.) Capim Sudão (Sorghum sudanense (Piper) Stapf) Fetusca Alta (Festuca arundinacea Schreb.) Sesbânia (Sesbania grandiflora (L.) Pers.) Trevo Ladino (Trifolium repens L.) Trevo Vermelho (Trifolium repens L.) Hortaliças e Fruteiras Alface (Lactuca sativa L.) Aspargo (Asparagus officinalis L.) Batata (Solanum tuberosum L.) Batata-doce (Ipomoea batatas (L.) Lam.) Berinjela (Solanum melongena L.) Brócolis (Brassica oleracea L. var. italica Plenck) Cebola (Allium cepa L.) Cenoura (Daucus carota L.) Couve-flor (Brassica oleracea L. var. botrytis L.) Ervilha (Pisum sativum L.) Espinafre (Spinacia oleracea L.) Melancia (Citrullus lanatus (Thunb.) Matsum. & Nakai) Morango (Fragaria x ananassa Duch.) Nabo (Brassica rapa L.) Pepino (Cucumis sativus L.) Rabanete (Raphanus sativus L.) Repolho (Brassica oleracea L. var. capitata L.) Tomate (Solanum lycopersicum L. var. lycopersicum) 1 S = sensível; MS = muito sensível; T = tolerante; MT = muito tolerante. Fonte: Maas (1986). Condutividade Elétrica de Extrato de Saturação Decréscimo no rendimento Limiar (% por dS m-1 acima limiar) (dS m-1) Classificação1 7,7 3,2 3,0 7,0 1,7 4,9 8,0 1,0 1,7 1,7 5,0 6,8 6,0 - 5,2 29,0 12,0 5,9 5,9 12,0 5,0 19,0 12,0 12,0 20,0 16,0 7,1 - T MS S MT T MS MT MT T S MS MT MS MS MS MT MT MT T 2,0 6,9 2,8 3,9 2,3 1,5 1,5 7,3 6,4 4,3 5,3 7,0 12,0 12,0 MS T MT MT MS MS MS 1,3 4,1 1,7 1,5 2,8 1,2 1,0 2,0 1,0 0,9 2,5 1,2 1,8 2,5 13,0 2,0 12,0 11,0 9,2 16,0 14,0 7,6 33,0 9,0 13,0 13,0 9,7 9,9 MS T MS MS MS MS S S MS S MS MS S MS MS MS MS MS Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade 209 06. Determinação do nível de salinidade em que a produção de uma dada espécie de planta começa a decrescer. 07. Na avaliação de genótipos para tolerância à salinidade é necessário que todos os nutrientes essenciais sejam aplicados em quantidades adequadas. 08. Os ensaios de avaliação devem ser acompanhados de práticas culturais adequadas, como época e densidade de plantio convenientes, controle de doenças, pragas e invasoras e colheita na época apropriada. 09. Na avaliação deve-se incluir uma cultivar tolerante e uma suscetível para se estabelecer comparações. 10. A tolerância das culturas à salinidade varia com o estádio de crescimento. A parte aérea é mais sensível à toxidez de salinidade do que o sistema radicular, tanto em experimentos de longa como de curta duração (Tabela 3, Figura 1). Portanto, em experimentos em casa de vegetação, a parte aérea pode ser usada como elemento indireto de avaliação das raízes. A Figura 1 mostra a resposta da parte aérea e das raízes de cultivares de arroz (Oryza sativa L.) à salinidade. O peso da matéria seca da parte aérea foi reduzido mais do que o das raízes. Isto significa que a parte aérea é mais sensível à salinidade do que as raízes e, também, que o peso da matéria seca da parte aérea é um parâmetro mais adequado para a classificação de cultivares de cereais tolerantes à salinidade do que o peso da matéria seca das raízes. Na avaliação do efeito da salinidade em condições de campo, a produção de grãos é o melhor parâmetro a ser considerado no caso de culturas graníferas anuais. Figura 1. Influência da salinidade no peso da matéria seca das raízes e da parte aérea de cultivares de arroz (Oryza sativa L.) (Adaptada de Fageria, 1992) enchimento de grãos (Figura 2). Nessas culturas, portanto, a seleção para tolerância à salinidade deve ser feita no estádio mais sensível. É interessante, também, irrigar essas culturas com água salina durante o estádio de menor sensibilidade e usar água com baixa salinidade durante o estádio mais sensível. Trabalho realizado por Grattan et al. (1987) mostrou que a irrigação com água de 8 dS m-1, do início da floração até a colheita, não afetou significativamente a produção de melão (Cucumis melo L.) e tomate (Solanum lycopersicum L. var. Tabela 3. Nível de salinidade na redução de 50% do peso da matéria seca da parte aérea e das raízes de algumas culturas anuais Parte Raízes Aérea Cultura Cevada (Hordeum vulgare L.) Algodão (Gossypium hirsutum L.) Milho (Zea mays L.) Milho verde (Zea mays L.) Sorgo (Sorghum bicolor (L.) Moench) dS m-1 16,9 19,2 13,3 18,9 15,3 17,5 15,0 30,0 11,1 27,8 Fonte: Shalhevet et al. (1995). De acordo com Shalhevet et al. (1995), resultados de experimentos conduzidos em casa de vegetação mostram que o sorgo (Sorghum bicolor (L.) Moench), o trigo (Triticum aestivum L.) e o caupi (Vigna unguiculata (L.) Walp.) são mais sensíveis à salinidade durante o estádio vegetativo e no início da fase reprodutiva, menos sensíveis no estádio de floração e insensíveis durante o Figura 2. Relação hipotética mostrando a tolerância de uma dada cultivar à salinidade em função de ciclo de crescimento 210 Nand K. Fageria et al. lycopersicum), em comparação com a água de irrigação com salinidade de 0,2 dS m-1. Análise e interpretação de dados A tolerância à salinidade de uma espécie ou cultivar pode ser interpretada de três maneiras: 1. Pode ser considerada como a capacidade de sobrevivência da planta sob condições de elevada concentração salina. Uma espécie, em alta concentração de sal, pode crescer pouco ou não crescer, embora permaneça viva. Assim, a capacidade de sobrevivência de uma planta, quando submetida a aumentos crescentes de salinidade, é uma medida de tolerância à salinidade. 2. Pode ser considerada do ponto de vista da capacidade produtiva da planta, quando esta é exposta a um dado nível de salinidade. Por exemplo, ao se avaliar cultivares de uma mesma espécie em um solo contendo certo nível de salinidade pode-se considerar a cultivar mais produtiva como a mais tolerante. 3. Pode, ainda, ser considerada com base em um gradiente de salinidade, avaliando-se o comportamento de uma planta ou cultivar em solos com diferentes níveis de salinidade: baixos, médios e altos, de modo a verificar sua reação nessas condições. Após a condução de ensaios, os resultados da avaliação da tolerância de genótipos à salinidade devem ser analisados e interpretados adequadamente antes de serem aplicados na prática. Os critérios de avaliação podem compreender caracteres morfológicos (porcentagem de folhas mortas, redução em peso da matéria seca da parte aérea ou de grãos) e fisiológicos. Caracteres morfológicos Dentre as formas de avaliação de caracteres morfológicos, uma baseia-se na resposta das folhas da cultivar em dado nível de salinidade. Considerando a porcentagem de folhas mortas, os genótipos podem ser classificados como tolerantes, moderadamente tolerantes ou moderadamente suscetíveis e suscetíveis (Tabela 4). Conforme este critério, a Tabela 5 apresenta a classificação de 11 genótipos de arroz irrigado. Outros caracteres morfológicos compreendem a produção de matéria seca ou de grãos, avaliando-se as reduções na expressão dos mesmos que se verificam sob certo nível de salinidade, em relação à testemunha cultivada em solo não-salino. Este critério de avaliação é considerado como o mais adequado para aplicação em condições de campo. Conforme Fageria (1985a, 1985b, 1992), pode-se utilizar a seguinte fórmula no cálculo da redução da produção de matéria seca ou de grãos: Tabela 4. Classificação de genótipos de plantas cultivadas quanto à sua tolerância à salinidade, baseando-se na porcentagem de folhas mortas Folhas Mortas (%) Nota Classificação 0-20 1 Tolerante 21-35 2 Tolerante 36-50 3 Tolerante 51-70 Moderadamente 5 tolerante Moderadamente 71-90 7 suscetível 91-100 9 Suscetível Fonte: Ponnamperuma (1977). Tabela 5. Classificação de genótipos de arroz (Oryza sativa L.) irrigado segundo sua tolerância à salinidade Folhas Genótipo Nota Classificação Mortas (%) BG 11-11 18 1 Tolerante IR 9129-102-2 12 1 Tolerante TOX 711-6 25 2 Tolerante IR 22 47 3 Tolerante IR 3511-39-3-3 Moderadamente 53 5 tolerante Suvale 1 Moderadamente 59 5 tolerante IR 2070-414-3-9 Moderadamente 62 5 tolerante De Abril Moderadamente 71 7 suscetível Labelle Moderadamente 77 7 suscetível BR 4 91 9 Suscetível IR 8 100 9 Suscetível Fonte: Fageria et al. (1981). RP = [(PSTS - PCTS) / PSTS] x 100 onde: RP PSTS PCTS - redução da produção; - produção sem tratamento de salinidade; - produção com tratamento de salinidade. A maneira de interpretar esses resultados é apresentada na Tabela 6. Além desses critérios, pode-se utilizar o Índice de Eficiência de Produção (IEP) na classificação de diferentes genótipos quanto à tolerância à salinidade. Este índice pode ser calculado como descrito a seguir (Fageria, 1991): IEP = (PANS / PMANS) x (PBNS / PMBNS) onde: IEP PANS - Índice de Eficiência de Produção; - produção com alto nível de salinidade; Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade PMANS - produção média do experimento com alto nível de salinidade; PBNS - produção com baixo nível de salinidade; PMBNS - produção média do experimento com baixo nível de salinidade. Resultados obtidos empregando este critério são apresentados na Tabela 7. Tabela 6. Classificação de genótipos quanto à tolerância à salinidade, baseando-se na redução da produção de matéria seca ou de grãos Redução da Classificação Produção (%) 0-20 Tolerante 21-40 Moderadamente tolerante 41-60 Moderadamente suscetível > 60 Suscetível Fonte: Fageria (1985a). Tabela 7. Influência da salinidade no peso da matéria seca da parte aérea (g/5 plantas) de cultivares de arroz (Oryza sativa L.) e sua classificação para tolerância à salinidade Condutividade Elétrica Redução da Cultivar/ (dS m-1) Matéria Seca (%) Linguagem Testemunha 5 10 5 10 CNA 3,30 3,25 2,76 2 (T) 16 (T) 810098 CNA 3,76 2,85 0,97 24 (MT) 74 (S) 810112 CNA 4,66 3,33 1,67 29 (MT) 64 (S) 810115 CNA 2,99 2,89 1,13 3 (T) 62 (S) 810129 CNA 3,76 2,16 1,37 43 (MS) 64 (S) 810138 CNA 3,12 2,69 1,96 14 (T) 38 (MT) 810168 T = Tolerante, MT = Moderadamente tolerante, MS = Moderadamente suscetível e S = Suscetível A classificação de genótipos com base neste índice pode ser feita da seguinte maneira: genótipos tolerantes apresentam índice de eficiência maior que 1, genótipos moderadamente tolerantes relacionam-se a índices entre 0,5 e 1, e genótipos suscetíveis compreendem índices de eficiência entre 0 e 0,5. Observando esse critério, trabalho realizado em casa de vegetação utilizando solo pertencente à ordem Inceptissolo, possibilitou o seguinte agrupamento de cultivares de arroz, conforme sua tolerância à salinidade (Tabela 8). Características fisiológicas A seleção baseada em parâmetros fisiológicos pode resultar em maior sucesso no desenvolvimento de cultivares tolerantes à salinidade. Alguns trabalhos de 211 Tabela 8. Influência da salinidade no peso da matéria seca da parte aérea (g) de cultivares de arroz (Oryza sativa L.) e sua classificação para tolerância à salinidade, conforme Índice de Eficiência de Produção (IEP) Nível de Cultivar/ IEP e Salinidade (dS m-1) Classificação1 Linhagem Testemunha 10 g GA 3459 1,16 0,42 0,60 (MT) L 440 1,99 0,47 1,16 (T) IET 2881 1,87 0,81 1,88 (T) GA 3461 1,32 0,49 0,80 (MT) CNA 12 1,92 0,56 1,33 (T) GA 3452 1,96 0,59 1,53 (T) CNA 294-B-BM-4-4 1,85 0,61 1,40 (T) CNA 237-F-130-1 1,57 0,56 1,09 (T) CNA 108-B-28-2-1 1,15 0,16 0,23 (S) CNA 296-B-BM-M-4 1,63 0,28 0,56 (MT) Média 1,64 0,49 T = Tolerante, MT = Moderadamente tolerante, MS = Moderadamente suscetível e S = Suscetível. Fonte: Fageria (1985b). 1 revisão publicados neste sentido (Lauchli & Epstein, 1990; Noble & Rogers, 1992) mostram que vários mecanismos de tolerância são envolvidos e que, além disso, a importância relativa de muitos mecanismos pode variar entre espécies de plantas (Rush & Epstein, 1981) e entre cultivares da mesma espécie (Yeo & Flowers, 1983). Faltam informações, entretanto, sobre o controle genético desses mecanismos. Alguns parâmetros fisiológicos de avaliação, como acumulação e exclusão de íons e ajustamento osmótico, estão entre os mais importantes. Plantas halófilas, que habitam meios ricos em sal, acumulam certos íons inorgânicos em altas concentrações e utilizam-se deles para manter o potencial osmótico de seus tecidos abaixo do que o potencial externo apresenta. Em muitas alicofíticas, a diferença entre cultivares tolerantes à salinidade está associada ao baixo teor de absorção e à acumulação de Na+ ou Cl- em toda a planta ou na parte aérea. Neste caso, a tolerância é relacionada ao mecanismo de exclusão de íons. A Tabela 9 mostra a acumulação de Na + na parte aérea de sete cultivares de arroz. Nas cultivares tolerantes, o teor de Na + na parte aérea foi muito menor que nas suscetíveis. Lauchli (1984) observou que a maioria das leguminosas responde à salinidade pela exclusão de sais das folhas. A tolerância à salinidade em soja (Glycine max (L.) Merr.), alfafa (Medicago sativa L.) e trigo também se relaciona à exclusão de Na+ e/ou de Cl- na parte aérea (Noble & Rogers, 1992). Assim, a avaliação da tolerância à salinidade de genótipos dessas espécies com base na exclusão de Na+ ou Cl- pode ser um bom critério de seleção. Plantas tolerantes à salinidade devem ser capazes de ajustar seu potencial osmótico, o que envolve tanto a 212 Nand K. Fageria et al. Tabela 9. Concentração de Na+ na parte aérea de cultivares de arroz (Oryza sativa L.) e sua classificação quanto à tolerância à salinidade Teor de Na+ Cultivar Classificação (mol m-3) Pokkali 39 Tolerante Nova Bokra 62 Tolerante IR 2153 50 Tolerante 99 Moderadamente IR 5 tolerante 125 Moderadamente IR 58 tolerante IR 36 150 Suscetível IR 22 247 Suscetível Fonte: IRRI (1994). absorção e a acumulação de íons como a síntese de solutos orgânicos. Esses mecanismos, usados como base de classificação de plantas halófilas (Waisel, 1972), geralmente operam juntos. O mecanismo dominante varia entre espécies de planta e, em alguns casos, entre partes da planta. A contribuição relativa de vários íons no ajustamento osmótico depende do mecanismo regulador do transporte de íons, como permeabilidade da membrana, cinética de transporte, energia e seletividade. A taxa de absorção é variável de íon para íon e, por isso, influencia o balanço iônico na planta. A contribuição do Cl - para o ajustamento osmótico é muito maior que a do SO 42-, porque a absorção de Cl- é muito mais rápida que a de SO42-. Quando a salinidade consiste predominantemente de cátions monovalentes e ânions divalentes, como Na2SO4, a taxa de absorção de cátions é maior que a de ânions. Nesta situação, o balanço iônico é alcançado através da síntese e da acumulação de ácidos orgânicos (Maas & Nieman, 1978). É possível que o mecanismo mais importante para regular o potencial osmótico seja a absorção seletiva de íons. Plantas tolerantes possuem capacidade de absorver nutrientes essenciais na solução salina em que a concentração de íons não-essenciais (tóxicos) é muito maior que a de íons essenciais. Por exemplo, em solução de solos salinos a concentração de Na+ é maior que a de K+. Entretanto, a relação Na/K, em plantas que crescem nesse tipo de solo, é aproximadamente um ou menos. Esta alta especificidade para absorção de K + está presente em várias espécies de plantas (Pitman, 1970). Entre as plantas halófilas, uma classe de eualofíticas ajusta-se ao ambiente salino pela acumulação de grande quantidade de sal, geralmente NaCl (Waisel, 1972). Essas plantas possuem adaptação para alta concentração de sais pelo aumento de suculência (exemplo: Salicornia herbacea (L.) L.), pelo acúmulo de sais em partes menos sensíveis (exemplo: Atriplex sp.), pela secreção do excesso de sais de seus órgãos (exemplo: Spartina alterniflora Loisel.), ou por várias combinações desses mecanismos. MELHORAMENTO GENÉTICO VEGETAL PARA TOLERÂNCIA À SALINIDADE Variação em germoplasma Existem grandes diferenças entre espécies e entre cultivares de uma mesma espécie com relação à tolerância à salinidade (Figuras 3 e 4). Algodão (Gossypium hirsutum L.) e cevada (Hordeum vulgare L.) seguidas pelo trigo, estão entre as espécies mais tolerantes à salinidade. A maioria das leguminosas é suscetível à salinidade, estando entre as exceções a alfafa (Munns, 2001). Quando ao nível de salinidade encontra-se em torno de 10 dS m -1 , a maioria das leguminosas morre antes da maturação. Nessas condições, porém, culturas como a cevada e o trigo Figura 3. Curva de resposta de espécies de plantas à salinidade (Adaptada de Shannon, 1984) Figura 4. Influência da salinidade no peso da matéria seca da parte aérea de duas cultivares de arroz (Oryza sativa L.) (Adaptada de Fageria, 1989) Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade chegam a produzir, embora com baixas produtividades (Munns, 2001). François et al. (1989) estudaram os efeitos da salinidade na produtividade de centeio (Secale cereale L.). A produção relativa de duas cultivares não foi afetada até 11,4 dS m-1. A cada aumento de uma unidade de salinidade, acima de 11,4 dS m-1, verificou-se redução na produção em 10,8%. Esses resultados colocam o centeio na categoria de espécie tolerante à salinidade. François et al. (1984) também estudaram os efeitos da salinidade na produção de duas cultivares de sorgo granífero. A produtividade não foi afetada até 6,8 dS m-1. Após este nível, a cada aumento de uma unidade de salinidade houve diminuição na produção de grãos em 16%. O sorgo foi classificado por esses autores como espécie moderadamente tolerante à salinidade. Devitt et al. (1984) mostraram que, sob condições salinas, o sorgo é bem adaptado para explorar regiões com potencial osmótico mais favorável. François et al. (1990) determinaram os efeitos da salinidade do solo sobre a produtividade de duas cultivares de guar (Cyamopsis tetragonoloba (L.) Taub.), sendo esta espécie classificada como moderadamente tolerante à salinidade. Subbarao & Johansen (1994b) também relataram diferenças significativas entre espécies leguminosas em relação à sua tolerância à salinidade. As Figuras 5 e 6 mostram a tolerância à salinidade de seis cultivares/ linhagens de arroz irrigado. Duas cultivares brasileiras, EEA 304 e IAC 435, morreram, mas quatro linhagens do International Rice Research Institute - IRRI sobrevieram sob o nível de salinidade de 10 dS m-1. Figura 5. Tolerância à salinidade de genótipos de arroz (Oryza sativa L.) - EEA 304, IR4422-164-3-6 e IR4432-22-5, irrigado durante fase inicial de crescimento sob 10 dS m-1 nível de salinidade aplicado com 2% de solução de NaCl Plantas nativas e exóticas como fontes de tolerância à salinidade Plantas nativas e exóticas são frequentemente empregadas como fontes de tolerância à salinidade. Em nível mundial, várias instituições são responsáveis pela 213 Figura 6. Tolerância à salinidade de genótipos de arroz (Oryza sativa L.) - IAC 435, IR9129-102-2 e IR5624-2-1, irrigado durante a fase inicial de crescimento sob 10 dS m -1 nível de salinidade aplicado com 2% de solução de NaCl coleção, manutenção e distribuição desse germoplasma para pesquisadores, com vistas à sua utilização em programas de melhoramento genético. Diversos estudos mostram que muitas plantas nativas e exóticas possuem alta tolerância à salinidade e que esta pode ser transferida para plantas cultivadas mediante a aplicação de técnicas de melhoramento genético. Lycopersicon cheesmani, por exemplo, é uma espécie silvestre relacionada ao tomateiro, distinguindo-se por sua alta tolerância à salinidade, podendo produzir satisfatoriamente mesmo quando irrigada com água do mar, cujo nível de salinidade é altamente tóxico para tomateiros cultivados. Semelhantemente, considerando o trigo, a espécie silvestre Elytrigia elongata (Host) Nevski também mostrou alta tolerância à salinidade em relação à espécie cultivada Triticum aestivum. Por outro lado, plantas silvestres relacionadas à cevada, como Hordeum jubatum L. e Hordeum marinum Huds., em comparação com a espécie cultivada Hordeum vulgare, não possuem alta tolerância a sais (Subbarao & Johansen, 1994a). Estratégias relacionadas ao melhoramento genético O melhoramento genético de cultivares para tolerância a sais é plenamente viável, uma vez que não se verificam relações de antagonismo entre alta produtividade e tolerância à salinidade (Akbar & Ponnamperuma, 1980). Dentre híbridos obtidos de cruzamentos entre cultivares de arroz, tolerantes e suscetíveis à salinidade, alguns apresentaram alta tolerância a sais, conforme Akbar & Ponnamperuma (1980), que constataram, em geração F2, ampla faixa de variação entre genótipos, permitindo a seleção, nas gerações F3 e F4, de plantas tolerantes à salinidade. A tolerância a sais varia em conformidade com o estádio de crescimento da planta. Assim sendo, em 214 Nand K. Fageria et al. programas de melhoramento genético, deve-se concentrar esforços nos estádios críticos da planta. Não se deve esquecer, todavia, que a resposta da planta à salinidade está diretamente relacionada à duração da exposição ao estresse, e que, na seleção, o desempenho geral deve levar em conta todos os estádios de crescimento do vegetal. São poucos os trabalhos realizados em melhoramento genético para tolerância de cultivares a sais. Nesse contexto, verifica-se a necessidade da formulação de métodos que permitam uma rápida e eficiente avaliação do material em teste. As técnicas de seleção e os métodos de melhoramento genético para tolerância a sais foram discutidos por vários pesquisadores (Nieman & Shannon, 1976; Ponnamperuma, 1977), tendo sido sugerido o uso de técnicas de genética quantitativa, uma vez que diversos genes podem estar envolvidos no comportamento da tolerância à salinidade. No processo de geração de cultivares tolerantes à salinidade é importante definir corretamente os níveis de salinidade a serem aplicados durante o crescimento e desenvolvimento dos genótipos sob avaliação; deve-se ter em mente a não viabilidade de utilização de uma só cultivar em diferentes tipos de solos salinos. Portanto, é necessário o conhecimento da composição de sais existente nos solos para os quais as novas cultivares serão desenvolvidas. Inicialmente os genótipos podem ser avaliados sob condições controladas, devendo os testes finais, entretanto, serem conduzidos sob condições de campo, de modo a se avaliar sua produtividade. Nas avaliações preliminares de germoplasma, da germinação à maturação, o emprego de soluções nutritivas é a melhor opção para a identificação de genótipos tolerantes à salinidade (Subbarao & Johansen, 1994b). O IRRI desenvolveu a cultivar de arroz IR50 tolerante à salinidade. Em média, esta variedade produziu 3 t ha-1 em ensaios de rendimento em locais onde as cultivares tradicionais não conseguiram sobreviver. O IRRI demonstrou, também, que o uso de cruzamento cumulativo, envolvendo várias cultivares tolerantes à salinidade, pode possibilitar o desenvolvimento de cultivares mais tolerantes que seus respectivos parentais. Progênies de cruzamentos entre duas cultivares tolerantes à salinidade manifestaram alta tolerância em F1 e F3, superior à de seus parentais. Introdução de cultivares tolerantes à salinidade Apesar da existência, entre e dentro de espécies, de variabilidade genética suficiente para a geração de indivíduos tolerantes à salinidade (Venables & Wilkins, 1978; Norlyn, 1980; Fageria, 1985b, 1991), poucos são os exemplos de lançamento de cultivares que apresentam essa característica (Tabela 10). Tomando-se por base o conhecimento da variabilidade genética existente em nível de cultivares de culturas anuais, relativamente à tolerância à salinidade, conclui-se que esta ainda não foi suficientemente explorada em programas de melhoramento genético. Dentre as razões que levaram a essa situação encontram-se: 1. Falta de conhecimento da complexidade da natureza da tolerância e do modo como esta é modificada pelas condições ambientais. 2. Variação da tolerância da planta à salinidade em conformidade com sua idade. 3. Em geral, os melhoristas estão preocupados com outros objetivos, como: alta produtividade, resistência a doenças e ao acamamento e qualidade do que se pretende produzir. Pouquíssima atenção tem sido dada aos estresses de natureza abiótica relacionados ao solo. ESPÉCIES DE PLANTAS ADAPTADAS AO CULTIVO SOB CONDIÇÕES SALINAS Várias espécies de plantas possuem alta tolerância à salinidade, tendo adaptação ao cultivo em solos salinos; Tabela 10. Cultivares de diferentes espécies de plantas tolerantes à salinidade lançadas comercialmente Cultivar (Espécie) Arizona 8601 (Milho, Zea mays L.) Arsola 1-18 (Abacate, Persea americana Mill.) AZ Germ Salt 1 (Alfafa, Medicago sativa L.) AZ Germ Salt 2 (Alfafa, Medicago sativa L.) BG 84-3 (Melão, Cucumis melo L.) Edkway (Tomate, Solanum lycopersicum L. var. lycopersicum) Giza 159 (Arroz, Oryza sativa L.) Giza 160 (Arroz, Oryza sativa L.) Nebraska 10 (Agropiro, Agropyron spp.) Saltol (Festuca vermelha, Festuca rubra L.) Adaptado de Shannon (1996), Noble & Rogers (1992). Método de seleção Programa de seleção natural Cruzamento de variedades Seleção recorrente Seleção recorrente Seleção natural de ecotípica Programa de seleção natural Cruzamento de variedades Cruzamento de variedades Seleção natural de ecotípica Seleção natural de ecotípica País (ano de lançamento) Estados Unidos (1987) Estados Unidos (1951) Estados Unidos (1983) Estados Unidos (1990) Israel (1990) Egito (1982) Egito (1966) Egito (1984) Estados Unidos (1962) Canadá (1981) Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade Tabela 11. Espécies de plantas tolerantes à salinidade Nome comum Culturas de fibra, sementes e açúcar Algodão Beterraba açucareira Cevada Jojoba Culturas forrageiras e gramíneas Agropiro alto Agropiro crestado “Alkali sacaton” Capim-bermuda “Desert saltgrass” Elimo de Altai Elimo da Rússia Grama “Karnal” “Nuttall” Hortaliças Aspargo Fruteiras Tâmara 215 Nome científico Gossypium hirsutum L. Beta vulgaris L. Hordeum vulgare L. Simmondsia chinensis (Link) C. K. Schneid. Agropyron elongatum (Host) P. Beauv. Agropyron crestalum (L.) Gaertn. Sporobolus airoides (Torr.) Torr. Cynodon dactylon (L.) Pers. Distichlis stricta (Torr.) Rydb. Elymus angustus Trin. Elymus junceus Fisch. Diplachne fusca (L.) P. Beauv. ex Roem. & Schult. Puccinellia airoides S. Watson & J. M. Coult. Asparagus officinalis L. Phoenix dactylifera L. Fonte: Maas (1986). dentre as mesmas, algumas são apresentadas na Tabela 11. Espécies de Chenopodiaceae são bem conhecidas quanto à sua capacidade de acumular altos teores de Na+ na parte aérea da planta, associada a uma baixa relação K+/Na+, em torno de 2,2 (Haneklaus et al., 1998). Além disso, a alta tolerância à salinidade está associada à exclusão de íons tóxicos no processo de absorção (Greenway & Munns, 1980). PERSPECTIVAS FUTURAS A salinização, do solo e da água, é um dos problemas mais graves na produção agrícola, particularmente em regiões áridas e semiáridas. Em nível das diferentes culturas, a avaliação do germoplasma disponível, incluindo o silvestre, pode fornecer fontes de tolerância à salinidade para programas de melhoramento genético. Além disso, diversas técnicas relacionadas à moderna biotecnologia não foram suficientemente utilizadas em programas de melhoramento genético dirigidos ao desenvolvimento de cultivares tolerantes à salinidade. Em futuro próximo, o desenvolvimento de novos genótipos tolerantes à salinidade dependerá de esforços multidisciplinares e multi-institucionais, envolvendo pesquisadores de diversas áreas do conhecimento, como melhoramento genético, fisiologia, física de solo, fertilidade do solo e nutrição, cultura de tecidos, citogenética, transgenia, métodos quantitativos, entre outras. CONCLUSÕES Em nível mundial, o maior potencial de expansão da fronteira agrícola situa-se em regiões tropicais, que incluem o Brasil, país onde existem grandes áreas afetadas por sais. Práticas comuns de recuperação de solos salinizados compreendem o uso de corretivos e da água para lixiviação de sais. Essas práticas, entretanto, são muito dispendiosas, tornando o emprego de espécies ou cultivares adaptadas a tais condições adversas uma estratégia promissora para a sustentabilidade da produção de alimentos. No futuro, prevê-se a expansão do emprego da irrigação, com vistas à produção de alimentos em quantidade suficiente para satisfazer à demanda da crescente população mundial. Com isso, corre-se o risco de ampliação das áreas que apresentam solos salinos e sódicos, caso não sejam adotadas medidas adequadas de manejo do solo e da água. Nesse sentido, será fundamental o uso conjunto de práticas que envolvam o manejo do solo, da água e da planta. Embora as diferenças entre espécies com relação à tolerância à salinidade sejam bem relatadas, é necessário intensificar a realização de trabalhos, de natureza básica e aplicada, nas áreas de fisiologia, genética e melhoramento das plantas, de modo a permitir um melhor entendimento dos processos envolvidos nas respostas de tolerância à salinidade. 216 Nand K. Fageria et al. REFERÊNCIAS Akhtar, J.; Haq, T.; Shahzad, A.; Haq, M. A.; Ibrahim, M.; Ashraf, N. Classification of different wheat genotypes in salt tolerance categories on the basis of biomass production. International Journal of Agriculture and Biology, v.5, p.322-325, 2003. Akbar, M.; Ponnamperuma, F. N. Saline soils of South and Southeast Asia as potential rice lands. Paper presented at Special International Symposium Rice Research Strategies for the Future, IRRI, Los Baños, 1980, p.21-25. Ashraf, M.; Foolad, M. A. Improving plant abiotic-stress resistnce by exogenous application of osmoprotectants glycine betaine and praline. Environmental Experimental Botany, v.59, p.206-216, 2007. Ashraf, M.; Foolad, M. R. Pre-sowing seed treatment-a shotgun approach to improve germination, plant growth, and crop yield under saline and non-saline conditions. Advances in Agronomy, v.88, p.223-271, 2005. Bayuelo-Jimenez, J. S.; Debouck, D. G.; Lynch, J. P. Growth, gas exchange, water relations, and íon composition of Phaseolus species grown under saline conditions. Field Crops Research, v.80, p.207-222, 2003. Davenport, R.; James, R. A.; Zakrisson-Plogander, A.; Tester, M.; Munns, R. Control of sodium transport in durum wheat. Plant Physiology, Minneapolis, v.137, p.807-818, 2005. Devitt, D.; Stolzy, L. H.; Jarrell, W. M. Response of sorghum and wheat to different K+/Na+ ratios at varying osmotic potentials. Agronomy Journal, v.76, p.681-688, 1984. Epstein, E.; Bloom, A. J. Mineral nutrition of plants: Principles and perspectives, 2nd edition. Sunderland, Massachusetts: Sinauer Associates, Inc. Publishers, 2005. 400p. Evans, L. T. Feeding the ten billion: Plants and population growth. Cambridge,:Cambridge University Press, 1998. 264p. Fageria, N. K. Relatório do projeto “Avaliação de cultivares de arroz para condições adversas do solo”. Goiânia: EmbrapaCNPAF, 1985a. Fageria, N. K. Salt tolerance of rice cultivars. Plant and Soil, v.88, n.2, p.237-243, 1985b. Fageria, N. K. Solos tropicais e aspectos fisiológicos das culturas. Brasília: Embrapa-DPU, 1989. 425p. EMBRAPACNPAF. Documentos, 18 Fageria, N. K. Tolerância de cultivares de arroz à salinidade. Pesquisa Agropecuária Brasileira, v.26, n.2, p.281-288, 1991. Fageria, N. K. Maximizing crop yields. New York: Marcel Dekker, 1992. 274p. Fageria, N. K.; Barbosa Filho, M. P.; Gheyi, H. R. Avaliação de cultivares de arroz para tolerância à salinidade. Pesquisa Agropecuária Brasileira, Brasília, v.16, n.5, p.677-681, 1981. Francois, L. E. Growth, seed yield, and oil content of canola grown under saline conditions. Agronomy Journal, v.86, n.2, p.233-237, 1994. François, L. E. Salinity effects on four sunflower hybrids. Agronomy Journal, v.88, n.2, p.215-219, 1996. François, L. E.; Donovan, T. J.; Lorenk, K.; Maas, E. V. Salinity effects on rye grain yield, quality, vegetative growth and emergence. Agronomy Journal, v.81, p.707-712, 1989. François, L. E.; Donovan, T. J.; Maas, E. V. Salinity effects on seed yield, growth and germination of grain sorghum. Agronomy Journal, v.76, p.741-744, 1984. François, L. E.; Donovan, T. J.; Maas, E. V. Salinity effects on emergence vegetative growth and seed yield of guar. Agronomy Journal, v.82, p.587-592, 1990. Gama, P. B. S.; Tanaka, K.; Eneji, A. E.; Eltayeb, A. E.; Siddig, K. E. salt-induced stress effect on biomass, photosynthetic rate, and reactive oxygen species-scavenging enzyme accumulation in common bean. Journal of Plant Nutrition , v.32, p.837-854, 2009. Gorham, J. Salt tolerance in triticease K/Na discrimination in synthetic hexaploid wheat. Journal of Experimental Botany, v.41, p.623-627, 1990. Grattan, S. R.; Shennan, C.; May, D. M.; Mitchell, J. P.; Burau, R. G. Using drainage water for irrigation of melons and tomatoes. California Agriculture, v.41, p.27-28, 1987. Greenway, H; Munns, R. Mechanism of salt tolerance in nonhalophytes. Annual Review of Plant Physiology, v.31, p.149-190, 1980. Haneklaus, S.; Knudsen L.; Schnug, E. Relationship between potassium and sodium in sugar beet. Communications in Soil Science and Plant Analysis, v.29, p.1793-1798, 1998. Heuer, B. Influence of exogenous application of praline and glycinebetaine on growth of salt-stresses tomato plant. Plant Science, v.165, p.693-699, 2003. Hillel, D. Rivers of Eden: The struggle for water and the quest for peace in the Middle East. New York: Oxford University Press, 1994. 355p. IRRI - International Rice Research Institute (Los Baños, Philippines). Program Report February, 1993. Los Baños, 1994. 317p. Khadri, M.; Tejera, N. A.; Lluch, C. Sodium chloride-ABA interaction in two common bean (Phaseolus vulgaris) cultivars differing in salinity tolerance. Environmental and Experimental Botany, v.60, p.211-218, 2006. Kant, C.; Aydin, A.; Turan, M. Ameliorative effect of hydrogel substrate on growth, inorganic ions, praline, and nitrate contents of bean under salinity stress. Journal of Plant Nutrition, v.31, p.1420-1439, 2008. Kumar, V.; Shriram, V.; Nikam, T. D., Jawali, N.; Shitole, M. G. Sodium chloride-induced changes in mineral nutrients and proline accumulation in indica rice cultivars differing in salt tolerance. Journal of Plant Nutrition, v.31, p.1999-2017, 2008. Lauchli, A. Salt exclusion: an adaptation of legumes for crops and pastures under saline conditions. In: Staples, R. C.; Toenniessen, G. H. (ed.). Salinity tolerance in plants: strategies for crop improvement. New York: Wiley, 1984. p.171-187. Lauchli, A.; Epstein, E. Plant responses to saline and sodic conditions. In: Tanji, K. K. (ed.) Agricultural salinity assessment and management. New York: ASCE, 1990. p.113137. Maas, E. V. Salt tolerance of plants. Applied Agricultural Research, v.1, p.12-25, 1986. Maas, E. V.; Nieman, R. H. Physiology of plant tolerance to salinity. In: Crop tolerance to suboptimal land conditions. Madison: American Society of Agronomy, 1978. p.277-299. ASA. Special Publication, 32 Melhoramento genético vegetal e seleção de cultivares tolerantes à salinidade Maathuis, F. J. M. The role of monovalent cation transporters in plant responses to salinity. Journal of Experimental Botany, v.57, p.1137-1147, 2006. Mansour, M. M. F.; Salama, K. H. A.; Ali, F. Z. M.; Abou Hadis, A. F. Cell and plant responses to NaCl in Zea mays L. cultivars differing in salt tolerance. General and Applied Plant Physiology, v.31, p.29-41, 2005. Mengel, K; Kirkby, E. A.; Kosegarten H.; Appel, T. Principles of plant nutrition, 5. ed. Dordrecht: The Kluwer Academic Publishers, 2001. 849p. Munns, R. Physiological processes limiting plant growth in saline soils: Some dogmas and hypothese. Plant Cell Environment, v.16, p.15-24, 1993. Munns, R. Avenue for increasing salt tolerance of crops. In:W. J. Horst (ed.) Plant Nutrition-Food security and sustainability of agro-ecosystems, Dordrecht: Kluwer Academic Publishers, 2001, p.370-371. Munns, R.; Hare, R. A.; James, R. A.; Rebetzke, G. J. Genetic variation for improving the salt tolerance of durum wheat. Australian Journal of Agricultural Research, v.51, p.69-74, 2000. Murtaza, G.; Ghafoor, A.; Kahlon, U. Z.; Bhatti, A. S.; Sabir, M. Evaluation of rice and wheat cultivars for tolerance to salinity and sodicity in soil. Communications in Soil Science and Plant Analysis, v.40, p.1268-1281, 2009. National Academy of Sciences. Water for the future: The West Bank Gaza strip, Israel, and Jordan. Washington, DC: National Academy Press, 1999. 244p. Nieman, R. H. Z.; Shannon, M. C. Screening for salinity tolerance. In: Workshop on plant adaption to mineral stress, 1976, Beltsville, Maryland. Proceedings. Ithaca: Cornell University Agricultural Experiment Station, 1976. p.359-367. Noble, C. L.; Rogers, M. E. Arguments for the use of physiological criteria for improving the salt tolerance in crops. Plant and Soil, v.146, n.1-2, p.99-107, 1992. Norlyn, J. D. Breeding salt tolerant crop plants. In: Rains, D. W.; Valentine, R. C.; Hullaender, A. (ed.). Genetic engineering of osmoregulation: basic life science. New York: Plenum Press, 1980. v.14, p.213-309. Pardo, J. M.; Cubero, B.; Leidi, E. O.; Quintero, F. J. Alkali cátion exchangers: Roles in cellular homeostasis and stress tolerance. Journal of Experimnetal Botany, v.57, n.5, p.11811199, 2006. Pessarakali, M.; Szabolcs, I. Soil salinity and sodicity as particular plant/crop stress factors. In: Pessarakali, (ed.). Handbook of plant and crop stress, 2. ed. New York: Marcel Dekker, 1999. p.1-15. Pitman, M. Ion transport in plant cell. In: Skoryna, S. C.; Edward, D. W. (eds). Intestinal absorption of metal ions, trace elements and radionuclides. London: Pergamon Press, 1970. p.115-133. Ponnamperuma, F. N. Screening rice for tolerance to mineral stress. Los Baños: International Rice Research Institute, 1977. 21p. IRRI. Paper Series, 6 Rains, D. W.; Goyal, S. S. Strategies for managing crop production in saline environments: An overview. In: Goyal, S. S.; Sharma, S. K.; D. W. Rains; Morgan, R. L. (ed.) New York: The Haworth Press, 2003. p.1-10. 217 Rengasamy, p. World salinization with emphasis on Australia. Journal of Experimental Botany v.57, p.1017-1023, 2006. Ribeiro, M. R.; Freire, F. J.; Montenegro, A. A. Solos halomórficos no Brasil: ocorrência, gênese, classificação, uso e manejo sustentável. In: Curi, N.; Marques, J. J.; Guilhermes, L. R. G. G.; Lima, J. M.; Lopes A. S.; Alvarez, V. H. (ed.) Tópicos em ciência do solo. Viçosa, MG: Sociedade Brasileira de Ciência do Solo, 2003. v.3, p.165-208. Ribeiro, M. S.; Barros, M. F. de C.; Santos, M. B. G. dos. Química dos solos salinos e sódicos. In: Melo, V. de F.; Alleoni, L. R. F. (ed.) Quimica e mineralogia do solo, Parte II-Aplicações. Viçosa, MG: Sociedade Brasileira de Ciência do Solo, 2009. p. 449-484. Romero, J. M.; Maronon, T.; Murillo, J. M. Long term responses of Melilotus segatalis to salinity. II. Nutrient absorption and utilization. Plant Cell and Environment, v.17, p.1249-1255, 1994. Rush, D. W.; Epstein, E. Breeding and selection for salt tolerance by the incorporation of wild germplasm into a domesticated tomato. Journal of the American Society for Horticultural Science, v.106, n.2, p.669-704, 1981. Sairam, R. K.; Rao, K. V.; Srivastava, G. C. Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress, antioxidant activity and osmolytes concentration. Plant Science, v.163, p.1037-1046, 2002. Saqib, M.; Akhtar, J.; Qureshi, R. H. Pot study on wheat growth in saline and waterlogged compacted soil: I. Root growth and leaf ionic relations. Soil and Tillage Research, v.77, p.179-187, 2004. Saqib, M.; Akhtar, J.; Qureshi, R. H. Sodicity intensifies the effect of salinity on grain yield and yield components of wheat. Journal of Plant Nutrition, v.31, p.689-701, 2008. Saqib, M.; Zorb, C.; Rengel, Z.; Schubert, S. Na+ exclusion and salt resistance of wheat (Triticum aestivum) are improved by the expression of endogenous vacuolar Na + /H + antiporters in roots and shoots. Plant Science, v.169, p.959965, 2005. Saqib, M.; Zorb, C.; Schubert, S. Salt-resistant and salt sensitive wheat genotypes show biochemical reaction at protein in the first phase of salt stress Journal of Plant Nutrition and Soil Science, v.169, p.542-548, 2006. Shalhevet, J.; Morris, G. H.; Scroeder, B. P. Root and shoot growth response to salinity in maize and soybean. Agronomy Journal, v.87, n.3, p.512-516, 1995. Shannon, M. C. Breeding, selection, and the genetics of salt tolerance. In: Staples, R. C.; Toenniessen, G. H. (ed.). Salinity tolerance in plants. New York: John Wiley & Sons, 1984. p.231-254. Shannon, M. C. New insights in plant breeding efforts for improved salt tolerance. HortTechnology, v.6, p.96-98, 1996. Sharma, S. K.; Goyal, S. S. Progress in plant salinity resistance research: Need for an integrative para digma. In: In: Goyal, S. S.; Sharma, S. K.; D. W. Rains; Morgan, R. L. (ed.) New York: The Haworth Press, 2003. p.387-407. Soil Science Society of America. Glossary of soil science terms. Madison: American Society of Soil Science, 1997. 44p. 218 Nand K. Fageria et al. Subbarao, G. V.; Johansen, C. Strategies and scope for improving salinity tolerance in crop plants. In: Pessarakali, M. (ed.). Handbook of plant and crop. New York: Marcel Dekker, 1994a. p.559-579. Subbarao, G. V.; Johansen, C. Potential for genetic improvement in salinity tolerance in legumes: Pigeonpea. In: Pessarakali, M. (ed.). Handbook of plant and crop. New York: Marcel Dekker, 1994b. p.581-595. Szabolcs, I. 1994. Soil salinization. In: Pessarakali, M. (ed.). Handbook of plant crop stress. New York: Marcel Dekker, 1994. p.3-11. Venables, A. V.; Wilkins, D. A. Salt tolerance in pasture grasses. New Phytologist, Oxford, v.80, n.3, p.613-622, 1978. Tester, M.; Davenport, R. Na + tolerance and Na + transport in higher plants. Annals of Botany, London, v.91, p.1-25, 2003. Waisel, Y. Biology of halophytes. New York: Academic Press, 1972. 395p. Yeo, A. R.; Flowers, T. J. Varietal differences in the toxicity of sodium íons in rice leaves. Physiologia Plantarum, v.59, n.2, p.189-195, 1983. Wei, W.; Bilsborrow, P. E.; Hooley, P.; Fincham, D. A. Lombi, E.; Forster, B. P. Salinity induced differences in growth, ionic distribution, and partitioning in barley between the cultivar Maythorpe and its derived mutant Golden Promise. Plant Soil, v.250, p.183-191, 2003.
Download