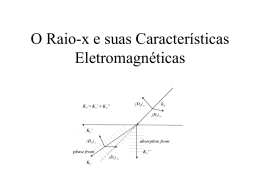
DETERMINAÇÃO DA ESTRUTURA TRIDIMENSIONAL DE PROTEÍNAS POR DIFRAÇÃO DE RAIOS-X Disciplina: Engenharia de Proteínas Ma. Flávia Campos Freitas Vieira NÍVEIS ESTRUTURAIS DAS PROTEÍNAS Fonte: Lehninger, 2010. 5ªed. ESTRUTURA PROTEICA • A conformação tridimensional (3D) depende da sequência de aminoácidos • A função depende da estrutura • Cada proteína existe em um ou em pequeno número de formas estruturalmente estáveis • As principais forças para a estabilização de estruturas são forças não-covalentes ESTRUTURA TRIDIMENSIONAL • Arranjo espacial de todos os átomos de uma proteína conformação • As conformações possíveis de uma proteína incluem qualquer estado estrutural que ela possa assumir sem a quebra das ligações covalentes. • Porém, poucas são as conformações nativas. • Algumas proteínas são formadas por mais de um complexo polipeptídico (quaternária) DETERMINAÇÃO DA ESTRUTURA TRIDIMENSIONAL PROTEICA • O primeiro passo para o estudo sobre as propriedades de um composto orgânico é a determinação de suas estruturas cristalinas. • Diversas propriedades estão intimamente ligadas à maneira como os átomos estão dispostos pela molécula. MAS...O QUE SÃO CRISTAIS? • Cristais são arranjos atômicos ou moleculares cuja estrutura se repete numa forma periódica tridimensional. • Exemplo: NaCl, cuja estrutura consiste em átomos de Sódio e Cloro dispostos de forma que um átomo de sódio terá sempre átomos de cloro como vizinhos e vice-versa. SÓLIDOS CRISTALINOS • Formas regulares e simétricas assim como a ordenação das partículas que os formam. COMO OBSERVAR OS CRISTAIS? • O estudo da estrutura cristalina não é possível através da microscopia óptica. • Os microscópios ópticos possuem uma limitação física, ditada pelo comprimento de onda da luz visível. COMO OBSERVAR OS CRISTAIS? • Para resolver objetos tão pequenos quanto proteínas, precisamos usar raios X, que possuem comprimentos de onda na faixa de 0,7 a 1,5 Å (0,07 a 0,15 nm). CRISTALOGRAFIA DE RAIOS-X • Uma das técnicas mais conhecidas para a determinação dos padrões de uma estrutura é cristalografia por difração de raios-X. CRISTALOGRAFIA DE RAIOS-X Fonte: Paula Kuser Falcão. CRISTALOGRAFIA DE RAIOS-X • Não há lentes que reagrupem os raios X para formar a imagem. • Ao invés disso, o padrão de difração dos raios X é coletado diretamente e a imagem é reconstruída por técnicas matemáticas. CRISTALOGRAFIA DE RAIOS-X • Raio X incide no cristal, onde parte de sua energia é absorvida e reemitida em todas as direções (cada átomo se torna uma fonte secundária de raios X); PADRÃO DE DIFRAÇÃO DOS RAIOS X Fonte: Paula Kuser Falcão. PADRÃO DE DIFRAÇÃO DOS RAIOS X • Na Cristalografia o padrão de difração é usado para determinar o arranjo e os espaçamentos entre os átomos que funcionam como fendas nos cristais. • A observação das franjas de difração (ou franjas de interferência) permite calcular a separação entre as fendas. CRISTALOGRAFIA DE RAIOS-X • A quantidade de informação obtida em uma cristalografia por raios X depende do grau de organização estrutural da amostra. • Informações da estrutura 3D detalhadas precisam de cristais proteicos altamente ordenados. • Dificuldade em cristalizar várias proteínas. CRISTALOGRAFIA DE RAIOS-X • O ambiente físico em um cristal não é idêntico ao em solução ou na célula viva. • Poucas informações são fornecidas em termos de movimentos moleculares no interior da proteína. CRISTALOGRAFIA DE RAIOS-X • Comparação da estrutura de cristais com informações estruturais de outras fontes (como RMN). • Estrutura de cristais podem representar a conformação funcional da proteína. • Utilizada para proteínas grandes demais para análises de RMN. CRISTALOGRAFIA DE RAIOS-X • A difração de raios-X aplicada à análise de cristais de macromoléculas biológicas tem influenciado a bioquímica estrutural, tendo contribuído para o conhecimento da estrutura 3D de proteínas, ácidos nucleicos, vírus e outras macromoléculas. A PARTIR DA CRISTALOGRAFIA DE RAIOS-X, É POSSÍVEL... • Compreender melhor os princípios básicos da arquitetura proteica; • Estudar em nível atômico os centros catalíticos de enzimas; • Compreender a especificidade das reações que as enzimas catalisam; • Compreender a relação existente entre sequencia primária, estrutura e função. ESQUEMA DA DETERMINAÇÃO DA ESTRUTURA 3D DE PROTEÍNAS EXEMPLO DE PROTEÍNAS CRISTALIZADAS Fonte: Paula Kuser Falcão. RESSONÂNCIA MAGNÉTICA NUCLEAR • Análise com macromoléculas em solução. • Pode esclarecer o lado dinâmico da estrutura • Mudanças conformacionais; • Dobramento proteico; • Interação com outras moléculas. DETERMINAÇÃO DA ESTRUTURA TRIDIMENSIONAL PROTEICA • Estruturas determinas por cristalografia de raios-X ou por RMN são, em geral, coincidentes. • Essas duas técnicas são responsáveis pelo rápido aumento da disponibilidade de informações estruturais sobre as macromoléculas das células vivas. REFERÊNCIAS • FALCÃO, P. K. Determinação da estrutura tridimensional de proteínas utilizando difração de raios-X. • FIGUEIREDO, M. O. R. Cristalografia e Difração de Raios-X. • NELSON, D. L.; COX, M. M. Lehninger, Princípios de Bioquímica. São Paulo: Câmara Brasileira do Livro, 5ªed. 2010. • ROMÃO. M. J. Cristalografia de Proteínas: metodologias e aplicações em bioquímica. Boletim de Biotecnologia. • SILVA, R. da. Cristalografia por difração de Raios-X e a Ciência dos Materiais. Fenômenos Ondulatórios.
Baixar