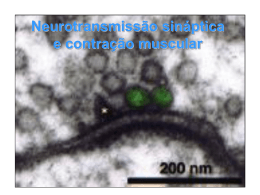
PARTE I Neurociência Celular Capítulo 4 Os Chips Neurais Processamento de Informação e Transmissão de Mensagens através das Sinapses Clique nas setas verdes para avançar/voltar ou ESC para retornar ao menu geral • A primeira demonstração da existência das sinapses foi feita em 1959, utilizando o microscópio eletrônico. A sinapse circulada é do tipo assimétrico (excitatória), enquanto a sinapse marcada com a letra a é do tipo simétrico (inibitória) Principais abreviaturas: den = dendrito apical de um neurônio cortical; pre = terminal pré-sináptico; post = elemento pós-sináptico. As junções comunicantes (A) acoplam células elétrica e metabolicamente, através do alinhamento de canais iônicos (conexons) que formam grandes poros (B). O acoplamento elétrico pode ser detectado registrando a passagem dos potenciais elétricos de uma célula a outra (C) com mínimo retardo “sináptico”. A ultraestrutura da sinapse pode ser visualizada ao microscópio eletrônico (A). Alguns dos seus componentes aparecem na foto, e outros podem ser vistos no esquema em B. O esquema não reproduz exatamente as proporções reais. As sinapses (círculos vermelhos) podem apresentar diferentes tipos morfofuncionais. As sinapses assimétricas são excitatórias, e as simétricas são inibitórias (A). Tanto umas como as outras, entretanto, podem estar localizadas em dendritos, no soma ou em axônios (B). A sinapse neuromuscular tem características estruturais especiais, visíveis ao microscópio eletrônico. As mais evidentes são as dobras juncionais da membrana pós-sináptica (muscular), e a presença da lâmina basal na fenda sináptica. Na foto em A, o terminal nervoso está delineado em amarelo. Os filamentos contráteis da célula muscular são vistos à direita, embaixo. Na foto em B a ampliação foi um pouco maior, tornando possível visualizar mais detalhes. Neste caso, os filamentos contráteis foram cortados obliquamente. A. Os neurotransmissores atravessam um ciclo que começa com a síntese de enzimas no citoplasma do neurônio. Segue-se o transporte axônico dessas enzimas até o terminal, a síntese e o armazenamento dos neurotransmissores em vesículas, e a liberação vinculada à chegada de potenciais de ação. O neurotransmissor então se difunde na fenda, pode ser aí desativado e as moléculas assim formadas, recaptadas como precursores para dentro do terminal, diretamente ou através de astrócitos posicionados ao redor das sinapses. B. Os neuropeptídeos são sintetizados a partir de proteínas precursoras, e transportados dentro de grânulos até o terminal, onde são armazenados e liberados quando necessário. Após a ação sináptica difundem-se e são depois inativados por degradação. C. Lipídios e gases são neuromediadores diferentes, porque não podem ser contidos dentro de vesículas, já que se difundem livremente através das membranas. Por isso, logo após a síntese enzimática, espalham-se em todas as direções, agindo sobre os elementos pós-sinápticos situados nas redondezas. O glutamato e a glicina são sintetizados no citoplasma a partir de glicose ou de proteínas degradadas. O ácido gama-aminobutírico (GABA) é sintetizado no terminal axônico a partir do glutamato, por meio da enzima GAD, que retira uma de suas carboxilas. A síntese da acetilcolina é realizada por uma só enzima, a partir de colina e acetilcoenzima A (acetil-CoA). B. A síntese de serotonina (5-HT) é realizada por uma cadeia de duas enzimas a partir do aminoácido triptofano. C. As catecolaminas são sintetizadas por uma cadeia de enzimas (duas para a dopamina, três para a noradrenalina e quatro para a adrenalina). Os neurônios dopaminérgicos só expressam as duas primeiras enzimas, os noradrenégicos, as três primeiras, e os adrenérgicos todas elas. As primeiras etapas da transmissão sináptica consistem na chegada do potencial de ação ao terminal axônico (A e B). Segue-se a abertura dos canais de Ca++ dependentes de voltagem (C), e a grande entrada de Ca++ que ocorre provoca a ancoragem das vesículas contendo neurotransmissor nas zonas ativas da membrana pré-sináptica (D). O resultado é a liberação do neurotransmissor na fenda sináptica. Neurônios e gliócitos da retina de embrião de galinha podem ser cultivados em laboratório, e marcados por meio de anticorpos fluorescentes específicos que revelam as moléculas que essas células possuem. Em A, vê-se um neurônio portador do receptor A2a de adenosina (em vermelho), e em B, gliócitos da retina identificados por uma proteína específica (2M6, em verde), além do receptor A2a em vermelho. O neurotransmissor liberado na fenda sináptica difunde-se até os receptores situados na membrana pós-sináptica (A). Como muitos receptores são ao mesmo tempo canais iônicos, a reação do neurotransmissor com eles provoca a abertura dos canais e a entrada de cátions (B). Resulta um potencial pós-sináptico (PPS). Quando se registra o potencial de membrana do terminal axônico, sempre se obtém um potencial de ação cuja forma de onda é semelhante em todos os neurônios (gráficos de cima em A e B). Mas quando se registra o potencial pós-sináptico que ocorre como consequência da transmissão sináptica, em alguns neurônios a resposta é despolarizante (gráfico de baixo em A) e o potencial pós-sináptico é dito excitatório (PPSE), enquanto em outros é hiperpolarizante (gráfico de baixo em B) e o potencial pós-sináptico é inibitório (PPSI). Isso resulta da combinação do neurotransmissor específico com o receptor correspondente, que no primeiro caso deixa passar cátions de fora para dentro da célula, e no segundo deixa passar Cl− (ou K+, no sentido contrário). Os principais receptores ionotrópicos do SNC são glutamatérgicos e GABAérgicos. A mostra um receptor glutamatérgico do tipo NMDA, com seus sítios de ligação para os dois cotransmissores (glutamato e glicina), e para o bloqueador Mg++. B mostra o receptor GABAA, com seus sítios de ligação para o neurotransmissor e para alguns de seus agonistas (esteroides, barbitúricos e benzodiazepínicos) e um antagonista (a picrotoxina). Os receptores metabotrópicos • atuam por meio de reações químicas intracelulares. Muitos empregam a proteína G para colocar em comunicação o receptor com a proteína efetora (A). Neste caso, quando o receptor é ativado pelo neurotransmissor (B), uma das subunidades da proteína G desliza na membrana até encontrar a proteína efetora (C), ativando-a por fosforilação (D). É a proteína efetora que irá ativar canais iônicos ou outras reações intracelulares. A inervação colinérgica do coração apresenta um exemplo de receptor metabotrópico cuja proteína efetora é um canal iônico. Neste caso (A), o neurotransmissor é a acetilcolina (ACh), o receptor é do tipo muscarínico e a proteína efetora é um canal de K+. O canal é ativado (B) pela subunidade α da proteína G ligada ao receptor. O experimento de Bernard Katz revelou que os potenciais pós-sinápticos são sempre múltiplos de um valor mínimo – quantum – que presumivelmente representa o efeito da liberação do conteúdo de uma única vesícula sináptica. Em A, oito registros de PPSs em uma sinapse neuromuscular após estímulos elétricos aplicados na fibra nervosa (linha vermelha) mostram potenciais múltiplos de um valor quântico (Q). Em B, o número de observações de PPSs de diferentes amplitudes mostra maior incidência de potenciais unitários (Q), duplos (2Q), triplos (3Q) etc. Os axônios noradrenérgicos apresentam exemplos de receptores metabotrópicos, cujas proteínas efetoras são canais iônicos diferentes. A mostra a ação da noradrenalina (NA) sobre os receptores do tipo α2, presentes na musculatura lisa dos vasos sanguíneos. O efeito da sinalização intracelular é a inibição da adenililciclase, provocando assim o fechamento de canais de K+. Resultado: aumento da duração dos PPSEs. B mostra o exemplo oposto, em que a NA atua sobre receptores ß, presentes no coração e nas vias respiratórias. A sinalização intracelular causa abertura dos canais de Ca++, resultando no aumento de amplitude dos PPSEs. Alguns receptores para serotonina (5-HT) empregam como segundo mensageiro o trifosfato de inositol (ou IP3), que se difunde no citosol até encontrar e fosforilar canais de cálcio no retículo endoplasmático liso, liberando Ca++, que então terá diversos efeitos metabólicos, inclusive a ativação de canais iônicos. Ratos submetidos ao estresse de imobilização forçada mostram um aumento significativo de neurônios que expressam a enzima sintase do óxido nítrico (revelados aqui por uma técnica histoquímica que tinge a enzima) na porção dorsolateral da grísea periaquedutal, uma “áreachave” na elaboração de respostas de medo. Muitas vezes um neurônio tem que decidir se produzirá ou não potenciais de ação em sua zona de disparo. Faz isso com base nas informações que recebe de cerca de 10 mil sinapses de axônios aferentes vindos de neurônios longínquos ou de interneurônios situados nas proximidades, algumas excitatórias, outras inibitórias. A integração sináptica é justamente a computação de toda essa massa de informação, para definir como será a informação de saída do neurônio. A coativação é uma das formas de integração sináptica. A mostra a chegada de poucos potenciais de ação na fibra aferente (representados por apenas um PA), resultando na liberação de glutamato em pequena quantidade e assim um potencial pós-sináptico excitatório (PPSE) de baixa amplitude, insuficiente para atingir o limiar da zona de disparo. Em B ocorre a chegada de maior frequência de PAs, resultando na liberação de mais glutamato e também do cotransmissor glicina, o que provoca a ativação dos receptores nNMDA e dos receptores NMDA. Agora o PPSE é maior, e atinge o limiar da zona de disparo. A integração sináptica pode-se dar por somação temporal e espacial. Em A, o potencial pós-sináptico excitatório (PPSE) é insuficiente para atingir o limiar da zona de disparo do neurônio. Em B, como a frequência de PAs é mais alta, os PPSEs somam-se e já atingem o limiar: o PPSE final resulta da soma algébrica dos PPSEs subsequentes na mesma sinapse (somação temporal). Em C, somam-se os PPSEs de sinapses próximas, produzindo um PPSE resultante de amplitude superior ao limiar da zona de diparo (somação espacial). A integração de sinapses excitatórias e inibitórias (A) produz na zona de disparo do neurônio um potencial pós-sináptico resultante (B) que representa a soma algébrica dos PPSEs e PPSIs provocados pelas várias fibras aferentes.
Baixar