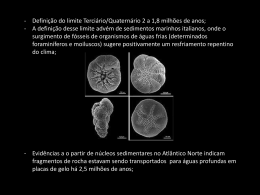
THARP’S FOOD TECHNOLOGY O EFEITO DA CONCENTRAÇÃO POR CONGELAMENTO NAS PROPRIEDADES DOS SORVETES SORVETES & CASQUINHAS Um elemento básico do processo de concentração por congelamento está ligado ao papel dos solutos no decréscimo do ponto de congelamento da água. 20 THARP’S FOOD TECHNOLOGY O termo concentração por congelamento refere-se ao conceito pelo qual a conversão de água líquida para gelo aumenta progressivamente a concentração de materiais dissolvidos na porção não congelada de um sistema em fase de congelamento. Este conceito tem um papel importante no comportamento do sorvete. Este artigo revê a natureza básica da concentração por congelamento e a forma como influência nas propriedades dos sorvetes. Fundamentos Um elemento básico do processo de concentração por congelamento está ligado ao papel dos solutos no decréscimo do ponto de congelamento da água. Como most ra a teoria da calorimetria, a água pura, sem qualquer material dissolvido, congela a uma temperatura de 0ºC (32ºF). Acima do ponto de congelamento, o calor removido da água pura é o calor sensível, isto é, sua remoção resulta em um decréscimo na temperatura. Quando a água pura atinge seu ponto de congelamento e o gelo começa a formar-se, todo o calor removido é o calor latente i.e., o calor removido quando se envolve uma mudança de estado físico, tal como quando a água é convertida de líquida para sólida. Quando o calor latente é removido da água pura em seu ponto de congelamento, nenhuma redução adicional na temperatura ocorre até que toda a água esteja congelada e a temperatura novamente diminui, à medida que todo o calor removido torna-se calor sensível. Quando a água contém um soluto, isto é, um material contido em solução real, os íons e moléculas dos materiais dissolvidos interferem com a formação dos cristais de gelo. O resultado desta interferência é tal que o calor adicional deve ser removido, a fim de se formar o gelo. Portanto, a presença de um soluto faz com que, necessariamente, a água deva atingir temperatura abaixo do ponto de congelamento da água pura para que o congelamento ocorra, ou seja, de forma resumida, os solutos abaixam o ponto de congelamento da água. Este decréscimo de temperatura é uma conseqüência inevitável da presença de materiais dissolvidos, como os açúcares e os sais de leite presentes em uma mistura para sorvete (ice cream mix). Como resultado, o ponto de congelamento de uma típica mistura para sorvete é empurrado para abaixo de 0ºC (32ºC), para cerca de -2,7ºC (27ºF) - dependendo da composição da mistura -, em uma amplit ude que é relacionada com a quantidade de material dissolvido. Existe uma relação direta entre a quantidade de material dissolvido presente e o ponto, em Cº, para o qual o ponto de congelamento é abaixado. Essa relação não envolve o peso percentual do material, mas sim o número de partículas – íons ou moléculas – em solução. Quanto maior o número de partículas dissolvidas, maior o decréscimo do ponto de congelamento. Por esta razão, a relação envolve o peso molecular do material dissolvido. À medida que o peso molecular diminui, o efeito de certo peso do material no decréscimo do ponto de congelamento aumenta, porque mais partículas por unidade de peso estão contidas na solução. Um exemplo prático da relação entre o peso molecular e o decréscimo do ponto de congelamento pode ser encontrado no uso comum de adoçantes de milho com alta frutose (HFCS, do inglês High Frutose Bruce Tharp tem toda uma vida de envolvimento com as indústrias de laticínios e sorvetes. Desde suas primeiras experiências no negócio de sorvetes de sua família - a Tharp’s Ice Cream, em Shamokin, PA -, Bruce partiu para completar três diplomas acadêmicos em Ciências Alimentares, com especialização em Produtos Lácteos. Após exercer cargos letivos e de pesquisa na Universidade de Wyoming e na Universidade Estadual de Ohio, Bruce passou 35 anos gerenciando os aspectos técnicos das duas maiores e mais modernas fornecedoras de ingredientes para sorvetes e laticínios do mundo. Dr ..S SS., ., ., M.S Dr.. Bruce W W.. Tharp B B..S Foi Diretor Técnico Internacional da Germantown S., ., Ph.D D D.. . em Ciências Alimentares, com especialização International Limited. Forneceu serviços técnicos em Produtos rodutos Lácteos, P para uma vasta gama de empresas de sorvetes e Penn em State University University.. laticínios ao redor do mundo, incluindo desenvolvimento de produtos, garantias de qualidade, solução de problemas, avaliação sensorial e programas educacionais concentrados em companhias específicas. Desenvolveu métodos sofisticados de geração e interpretação de dados objetivos a respeito da estrutura de sobremesas geladas, assim como seu comportamento no freezer e durante seu endurecimento, distribuição e derretimento. Concebeu e desenvolveu programas de computador para o cálculo da quantidade de água congelada em sobremesas geladas em várias temperaturas, e a aplicação e análise de dados gerados para auxiliar o desenvolvimento de produtos, solução de problemas e avaliação dos efeitos de mudanças em composição. Apresentou numerosos ensaios em encontros técnicos e científicos nos seis continentes. Contribuiu com mais de 150 artigos técnicos para publicações do ramo, incluindo uma coluna técnica sobre sorvetes para a Dairy Foods. Através destas realizações, Bruce obteve reconhecimento internacional de seu conhecimento técnico e consolidou sua reputação de palestrante entusiasmado e talentoso em uma variedade de cursos, seminários, workshops e conferências técnicas ao redor do mundo. Hoje, Bruce Tharp tem presença obrigatória em todo e qualquer evento de porte ligado ao mundo sorveteiro. Há 25 anos é palestrante do curso de sorvetes da Penn State University, ministra cursos nas universidades de Wisconsin, de Maryland, da Califórnia e na Politécnica da Califórnia, em Rudgers, no Utah, etc. Finalmente, é co-organizador e apresentador do curso comercial “Tharp &Young : On Ice Cream”, junto com o Dr. Steven Young, da Steven Young Worldwide. O Dr. Bruce Tharp é presidente da Tharp’s Food Technology. SORVETES & CASQUINHAS Introdução 21 THARP’S FOOD TECHNOLOGY Corn Syrup), para substituir a sacarose em sorvetes. A sacarose é um dissacarídeo, ou seja, sua estrutura química consiste em uma molécula formada pela ligação glicosídica de dois monossacarídeos, a f rutose e a glicose (ou dextrose). Nestes adoçantes (HFCS), mais de 90% dos sólidos são constituídos por quantidades aproximadamente iguais de frutose e de dextrose, porém, estes componentes estão presentes como monossacarídeos individuais. Portanto, um determinado peso de HFCS conterá cerca do dobro de moléculas quanto ao mesmo peso de açúcar. Disto resulta que o decréscimo do ponto de congelamento pelo uso de HFCS é cerca do dobro que o da sacarose, o que vem a ser uma consideração importante na seleção dos níveis de HFCS e de outros ingredientes solúveis aplicados na confecção de sorvetes. SORVETES & CASQUINHAS Efeitos diretos da concentração por congelamento 22 Existem dois fatores fundamentais no conceito de concentração por congelamento. O primeiro, é a relação entre o número de partículas em solução e o decréscimo do ponto de congelamento. O segundo fator, é o fato que a água cristalizada, ou seja, o gelo, não é mais capaz de agir como um solvente para materiais dissolvidos. Juntos, esses dois fatores combinam-se para criar uma sucessão de eventos repetitivos que interferem na temperatura de um sistema como o da mistura para sor vete -, e reduzem o seu ponto de congelamento. Vejamos como funciona. Assim que as primeiras partículas de gelo se formam, as partículas do soluto que estavam dissolvidas naquela água são excluídas dos cristais de gelo. Elas, então, tornam-se partes da solução que permanece não congelada, onde sua presença aumenta o número de partículas dissolvidas e, por isso, cria uma redução adicional no ponto de congelamento do material ainda não congelado. Como a transferência de calor para fora do mix congelado continua, a temperatura é reduzida a um novo ponto de congelamento. Quanto mais gelo é formado, mais uma vez as partículas excluídas desta porção adicional de gelo migram para a porção não congelada e produzem novas concentrações e maiores decréscimos no ponto de congelamento. Este processo continua em incrementos infinitos durante o congelamento normal e armazenamento de sorvetes, por todo o tempo que o calor continua a ser removido do sistema e o gelo continua a ser formado. Da mesma maneira que as moléculas de soluto são excluídas dos cristais de gelo, o mesmo ocorre com os componentes suspensos na mistura líquida. Estes componentes incluem partículas coloidais, como gomas e estabilizantes, ou par tículas suspensas maiores, como glóbulos de gordura, micelas de caseína e grandes moléculas de carboidratos insolúveis que são introduzidas através de adoçantes de milho (ou de outras fontes) e agentes de carga ou volume. O efeito da concentração por congelamento na composição é mostrado na Tabela 1 e demonstrado graficamente na Figura 1. Na Tabela 1, a segunda coluna Mix, apresenta a composição da mistura não congelada, enquanto que as duas colunas seguintes representam dois pontos importantes no manuseio de sorvetes. A coluna três reflete uma típica temperatura de saída do congelador, ou seja, -5,6ºC (22ºF), enquanto que a coluna quatro apresenta o efeito em uma temperatura comum para porcionamento e consumo, 15ºC (5ºF). Os valores para a composição do líquido remanescente, chamado aqui de soro, não congelado apresentados na Tabela 1 foram derivados, primeiramente, pelo cálculo das quantidades de água congelada nas temperaturas apropriadas, usando os métodos descritos por Tharp (9). Esses números foram, então, utilizados para calcular o peso percentual da quantidade de soro não congelado e o nível percentual de cada componente. As duas linhas de dados na seção inferior da Tabela 1 tencionam chamar atenção especial para o efeito de concentração por congelamento no componente estabilizante. Esta seção mostra o nível de estabilizante na fase aquosa da mistura, não na mistura em si, como está most rado na seção superior. Este tipo de informação é importante, porque a funcionalidade dos ingredientes estabilizantes está mais relacionada com sua concentração na fase aquosa do que com o nível global na mistura total. Como será visto, este conceito cresce em importância à medida que aumenta o grau de concentração por congelamento. TABEL A 1 - EFEITO DA CONCENTR AÇÃO POR CONGEL AMENTO NA ABELA CONCENTRAÇÃO CONGELAMENTO COM PO SIÇÃO DA PORÇÃO NÃO CONGEL ADA DE SORVE COMPO POSIÇÃO CONGELADA SORVETT E Sor vete Sorvete COM PO SIÇÃO DE SORO NÃO CONGEL ADO (%) OMPO POSIÇÃO CONGELADO MIX @ -5.6ºC (22ºF) @ -1 5ºC (5ºF) -15ºC Gordura 10,00 14,67 19,79 MSNF* 10,00 14,67 19,79 Sacarose 12,00 17,61 23,75 6,00 8,80 11,88 CSS** (36 DE) Estabilizante 0,15 0,22 0,30 Sólidos Totais 38,15 55,97 75,51 8,03 15,26 30,39 Lactose (% em água) Estabilizante em água Nível (%) 0,24 0,50 1,20 Fator de concentração —- 2,1 X 5,0 X (*) Milk Solids Not Fat (Sólidos do leite não gordurosos) (**) Corn syrup solids (Sólidos de xarope de milho) A Figura 1 ilustra graficamente os efeitos da concentração por congelamento. O efeito concentrador do congelamento sobre os níveis de gordura, dos MSNF, da sacarose e dos CSS no sistema não congelado é mostrado pela marcação do nível de cada componente, através da faixa de temperatura normal encontrada em sorvetes. Os dados da Tabela 1 e da Figura 1 ilustram claramente o efeito direto da concentração por congelamento. No estado líquido, a água atua como um soluto e como um agente de suspensão para componentes insolúveis. A água que é convertida em gelo torna-se, de fato, um agente de volume que, por estar substituindo a água líquida, concentra todos os componentes não aquosos da mistura, como delineado na tabela e ilustrado no gráfico. O efeito dessa concentração é um aumento direto da viscosidade e, geralmente, uma modificação da reologia 1 da porção não congelada, fatores que contribuem diretamente com as propriedades estruturais do sor vete – corpo total, propriedades de porcionamento e percepções de consumo, como cremosidade e substância. 1 A reologia é o ramo da mecânica dos fluidos que estuda as propriedades físicas que influenciam o transporte de quantidade de movimento em um fluido. A viscosidade é a propriedade reológica mais conhecida e a única que caracteriza os fluidos newtonianos. Efeitos indiretos da concentração por congelamento Os efeitos indiretos são mais complicados que seus impactos diretos e têm uma maior influência nas propriedades do sorvete. Em geral, estes efeitos envolvem modificações no estado físico de todos os componentes do sorvete e afetam sua influência em todas as características do sorvete, como descrito a seguir. Efeitos indiretos envolvendo gordura. As pesquisas de Bolliger e outros (2,3) comprovaram que a aglomeração controlada de glóbulos de gordura traz uma contribuição signif icante às características estruturais do sorvete, tanto no congelador como durante o consumo. Em alguns casos, a aglomeração de gordura chega ao ponto de formar uma matriz semi-contínua, que contribui para a manutenção de uma estrutura seca e firma no congelador e em uma melhor retenção de forma quando o sorvete derrete. Também promove a percepção de cremosidade e riqueza de duas maneiras. A primeira pelo fato dos glóbulos de gordura, sendo eles aglomerados ou parcialmente dispersos, contribuem diretamente para a percepção de um paladar cremoso. Na segunda maneira, eles fornecem um efeito indireto propiciando maior estabilidade a uma estrutura de células de ar muito pequenas, que, por sua vez, contribuem à cremosidade e à substância. A aglomeração ocorre durante o processo de congelamento/batimento no tambor da sorveteira. A alta agitação laminar aplicada durante o processo cria uma infinidade de colisões entre os glóbulos de gordura. Quando a natureza das superfícies dos glóbulos em choque permite, algumas colisões resultam na adesão de glóbulos, uns aos outros, formando os aglomerados. A amplitude da aglomeração e o tamanho e funcionalidade da estrutura aglomerada estão relacionadas com a natureza da superfície dos glóbulos de gordura e o número de colisões que ocorre. À medida que aumenta a concentração de glóbulos de gordura na parte líquida não congelada, a maior proximidade dos glóbulos uns dos outros, resulta em um número maior de colisões e, portanto, em um grau mais elevado de aglomeração. Esta é a explicação primária para o fato de que a taxa de aglomeração torna-se maior em baixas temperaturas no congelador. Também é, aparentemente, responsável pela taxa de aglomeração relativamente baixa que ocorre quando a mistura de sorvete por si é agitada e que, sem os efeitos da concentração por congelamento, a aglomeração é limitada pelo relativamente baixo número de colisões entre os glóbulos. Efeitos indiretos envolvendo proteína. A estabilidade do sistema protéico do leite é mantida por um delicado equilíbrio de fatores. Alguns desses, como o equilíbrio de sal e influências do pH, são relacionados à concentração. Como a concentração por congelamento aumenta os níveis de íons envolvidos no pH e no próprio balanço de sal, qualquer instabilidade é ampliada. O resultado pode ser uma desestabilização do sistema protéico, que pode ter somente uma ou toda uma variedade de efeitos, positivos e negativos. Os efeitos positivos incluem: influências na imobilização da água, que pode acentuar o controle dos cristais de gelo; aumento da viscosidade, que SORVETES & CASQUINHAS THARP’S FOOD TECHNOLOGY 23 THARP’S FOOD TECHNOLOGY SORVETES & CASQUINHAS A solubilidade limitada de alguns dos açúcares presentes no sorvete, os tornam bastante sensíveis aos efeitos da concentração por congelamento. 24 aumenta a percepção de corpo; e formação de géis de proteína desestabilizada, o que contribui para estrutura. Os efeitos negativos envolvem primariamente: modificação do papel importante da proteína na aglomeração de gordura; perda da contribuição da proteína parcialmente desestabilizada para a estrutura do sorvete; e, mais visível, a liberação de soro, que pode ocorrer tanto no sor vete derretido ou, sob cer tas influências como baixo endurecimento, na própria embalagem de sorvete. Efeitos indiretos envolvendo açúcares. A solubilidade limitada de alguns dos açúcares presentes no sorvete, particularmente a lactose, os tornam bastante sensíveis aos efeitos da concentração por congelamento. Até hoje, não foi publicado nenhuma pesquisa com resultados relevantes quanto à limitação da solubilidade dos vários açúcares em temperaturas abaixo do ponto de congelamento. Entretanto, algumas idéias das diferenças em solubilidade podem ser obtidas observando os dados para solubilidade em temperaturas acima do ponto de congelamento; esses dados são apresentados na Figura 2. A reconhecida baixa solubilidade da a-lactose, a menos solúvel das duas formas isoméricas de lactose, é apresentada claramente na Figura 2. No ponto de congelamento da água, 0ºC (32ºF), a solubilidade máxima da a-lactose é menos de 5%, comparada aos cerca de 36% da glicose (um importante componente de adoçantes de milho de alta frutose) e aos mais de 60% da sacarose. Os dados para glicose e sacarose foram relatados por Belitz e Grosh, para lactose, e por Jenness e Patton. A cristalização da lactose não é uma questão simples, particularmente em um sistema complexo como o de sorvetes. Hipoteticamente, quando a concentração de um soluto excede o limite de solubilidade em uma dada temperatura, ocorrerá uma cristalização espontânea. Na prática, porém, o nível de lactose pode atingir um ponto bem acima do limite nominal de solubilidade, sem o desenvolvimento de cristalização. Quando isso ocorre, diz-se que a solução está em estado de supersaturação ou supersolubilidade. Nesta condição, a cristalização pode não ocorrer por um período de tempo considerável. Como indicado na Figura 2, o limite de solubilidade para lactose aumenta com a temperatura. O mesmo é válido para o grau de supersolubilidade. Foi relatado por Holsinger (7), que a supersolubilidade da lactose a uma dada temperatura é equivalente ao valor máximo de solubilidade por uma temperatura de cerca de 30ºC (54ºF) mais elevada. Alem disto, o ponto no qual ocorrerá a cristalização dependerá também das influências de outros fatores, tais como o tipo e nível de outros materiais em solução e suspensão. Como resultado, não é possível prever com alguma precisão as condições sob as quais a cristalização da lactose ocorrerá como um resultado da concentração por congelamento, em dada situação qualquer. Apesar disso, é razoável extrair-se algumas conclusões gerais. A curva para o limite de solubilidade da lactose é relativamente achatada, quando a temperatura passa abaixo do ponto de congelamento. Portanto, é aparentemente razoável assumir que os dados de solubilidade para a lactose acima do congelamento podem ser extrapolados para estimar os efeitos abaixo do ponto de congelamento. Tal conjetura é a base para as curvas do gráfico da Figura 3, as quais promovem uma base para a avaliação dos fatores de solubilidade relacionados à cristalização da lactose. O gráfico da Figura 3 mostra a curva de limite de solubilidade da lactose e uma segunda curva representando uma faixa de supersaturação relatada por Jenness e Patton. Ambas as curvas são ampliadas por linhas pontilhadas para mostrar a extrapolação dos dados abaixo do ponto de congelamento. Uma terceira curva mostra o efeito da concentração por congelamento sobre o nível de lactose na água do soro não congelado no referido sorvete. Nota-se que inicialmente no processo de congelamento/batimento, em uma temperatura em torno de -2,7ºC (27,1ºF), a concentração por congelamento compreende o nível de lactose na faixa de supersaturação. O nível excede à faixa de supersaturação em uma temperatura de cerca de -6ºC (21,2ºF). De qualquer forma, a cristalização da lactose naquela temperatura dependerá de uma gama de fatores, particularmente da influência de outros materiais em solução, como adoçantes, por exemplo. Porém, mesmo considerando a possibilidade de inexatidão na extrapolação dos dados de solubilidade acima do ponto de congelamento, parece claro que a composição típica do sorvete usada como referência nesta análise excede a faixa de supersaturação, enquanto ainda está no tambor do congelador, ou logo após. Assim, parece lógico esperar que ao tempo que o sorvete alcance sua temperatura de endurecimento, a concentração por congelamento terá levado o nível de lactose para um ponto onde a cristalização está iminente, ou já tenha ocorrido. Assim, parece claro afirmar, que o objetivo de se cont rolar o desenvolvimento de granulosidade está mais relacionado no controle de tamanho dos cristais de lactose do que na própria prevenção da cristalização. Efeitos indiretos envolvendo estabilizantes. Um dos efeitos mais evidentes da presença de ingredientes estabilizantes em um mix para sorvete é a influência destes materiais na viscosidade da mistura. Entretanto, a funcionalidade primária dos estabilizantes está diretamente envolvida com o seu comportamento ou resposta ao fenômeno de concentração por congelamento. Como mencionado na explanação da Tabela 1, a funcionalidade de estabilizantes é melhor avaliada considerando seu nível na água não congelada, e não no mix em si. O nível do estabilizante na água não congelada da mistura de referência na Tabela 1, antes do congelamento, é de cerca de 0,25%. O que é relativamente baixo em termos de sua contribuição para a viscosidade da mistura. Naquele nível, quase todos os ingredientes usualmente utilizados como estabilizantes teriam efeitos similares na viscosidade. Como a concentração por congelamento aumenta o nível de estabilizante na porção não congelada – por um fator de cerca de 5 vezes em uma temperatura de -15ºC (5ºF) – sua influência nas propriedades chaves do sorvete, relacionadas com a mobilidade da água, começam a aumentar. Estes efeitos podem ser avaliados pela medição da viscosidade da porção não congelada de acordo com o progresso da concentração por congelamento. Tal avaliação foi relatada por Goff e outros e a Figura 4 mostra os dados deste estudo. O gráfico aponta os efeitos da concentração por congelamento em três sorvetes com vários níveis de estabilizante (goma guar), 0%, 0,10% e 0,20%. A composição básica de sorvete usada foi a mesma daquela apresentada na Tabela 1. Para estudar o efeito da concentração por congelamento, os sistemas foram preparados para representarem a composição da porção não congelada que seriam produzidos pela conversão da água líquida em gelo. O conjunto inferior de dados no gráfico mostra que o efeito da concentração por congelamento na viscosidade de misturas não estabilizadas produz uma linha relativamente reta. Todavia, na presença de goma guar ocorre um desvio acentuado da curva de viscosidade uma vez que a concentração por congelamento resulta na remoção de 20 a 30 g de água por 100 g. Este fenômeno, ou seja, uma mudança marcante na inclinação da curva representando a viscosidade associada com o aumento da concentração por congelamento, foi observada em todos os níveis de goma guar estudados. Também foi observado em trabalhos correlatos envolvendo goma alfarroba (LBG). O fenômeno é reportado como ponto de ruptura (breakpoint). O grau de concentração que produz este ponto de ruptura aumenta com o nível de estabilizante, como pode ser visto na Figura 4. Um dos achados mais importantes deste estudo foi a existência de uma correlação útil entre o ponto de ruptura da viscosidade normalizado dos sistemas estudados e a taxa de recristalização do gelo. Um outro aspecto do efeito da concentração por congelamento na funcionalidade do estabilizante é fornecido por um estudo mais antigo, de natureza similar, realizada pelo grupo de Goff na Universit y of Guelph. Nesta pesquisa, foi estudada a viscosidade de sistemas representando as porções não congeladas de sor vetes com e sem estabilizante. Os resultados são mostrados SORVETES & CASQUINHAS THARP’S FOOD TECHNOLOGY 25 THARP’S FOOD TECHNOLOGY SORVETES & CASQUINHAS na Figura 5. O eixo X do gráfico indica a água percentual removida como gelo. Portanto, a viscosidade é plotada para cada mistura, em vários níveis de concentração por congelamento. A linha paralela abaixo do eixo X indica a temperatura correspondente para cada incremento de remoção de água. Por 26 exemplo, observando o ponto no qual uma linha vertical a partir de -7ºC (19,4ºF) intersecciona o eixo X, nota-se que pouco mais de 60% da água nesta mistura seria removida (ou seja, congelada) naquela temperatura. A observação dos dados da Figura 5 fornece uma perspectiva útil do efeito da concentração por congelamento no estabilizante. Nota-se que em temperaturas logo abaixo da temperatura de congelamento, onde ocorreu pouca concentração por congelamento, as curvas para as porções não congeladas dos sor vetes estabilizados e não estabilizados, são bem difíceis de ser distinguidas umas da outras. Isto consubstancia a visão que os ingredientes estabilizantes têm relativamente pouca influência nas características reológicas da porção não congelada da mistura. A interpretação prática destes dados, para sistemas representando quantidades crescentes de água congelada, demonstra claramente que a influência da concentração por congelamento é a responsável pelas principais diferenças de viscosidade entre os produtos estabilizados e não estabilizados. Diferenças similares podem ser demonstradas em sistemas utilizando materiais estabilizantes diferentes. Em baixas concentrações, não existe virtualmente nenhuma diferença no comportamento reológico. Entretanto, em altos níveis, que seriam produzidos pela concentração por congelamento, podese observar uma variação significante na reologia, a qual é associada com efeitos variáveis nas propriedades do sorvete. Tais observações confirmam a validade de que toda pesquisa nos efeitos variáveis de ingredientes estabilizantes envolveria concentrações que representam seu nível na porção não congelada do sorvete nas temperaturas de interesse, e não no próprio mix em si. Na Figura 5, que mostra os dados da pesquisa conduzida antes do conceito de ponto de ruptura haver sido identificado e estudado, pode-se observar um indício deste conceito, que é indicado em um ponto representando a concentração por congelamento na temperatura de cerca de 7ºC (19,4ºF). Neste ponto, ocorre um nítido aumento na ascendência da curva de viscosidade representando a mistura estabilizada. Já na curva da mistura não estabilizada, não existe nenhuma ocorrência deste tipo, digna de ser notada. Esses elementos, visíveis nos dados, são totalmente consistentes com as mais recentes pesquisas sobre o ponto de ruptura. THARP’S FOOD TECHNOLOGY CALOR, CALOR LATENTE, CALOR SENSÍVEL E CALOR ESPECÍFICO Os resultados das pesquisas mencionadas, em conjunto com observações empíricas, demonstram claramente que a concentração por congelamento do sistema estabilizante contribui para a sua função de fornecer proteção contra o desenvolvimento de uma textura mais grosseira, granulosa, resultante do crescimento de cristais de gelo. Esse mecanismo de proteção é ilustrado na Figura 6. Nos níveis relativamente baixos de estabilizante na água que são encontrados acima do ponto de ruptura, as partículas de estabilizante movem-se mais ou menos livremente, com pequeno contato entre elas, conforme indicado na seção A. Neste estágio, a influência do estabilizante na viscosidade é mais ou menos associada ao efeito das partículas individuais. À medida que a concentração por congelamento remove a água do sistema não congelado, as partículas de estabilizante são empurradas para um volume menor de água, decorrendo em uma distância menor entre elas, o que se identifica nas seções B e C da Figura 6. Quando isto ocorre, a interação direta entre as partículas inicia a formação de uma estrutura matricial, cuja força aumenta conforme o progresso da concentração por congelamento, o que é ilustrado pela diferença na proximidade relativa das partículas de estabilizante entre as seções B e C. Empiricamente, é bem reconhecido que nem todos os materiais estabilizantes respondem a concentração por congelamento na mesma forma. Os sistemas diferem no grau de proteção por choque térmico que fornecem e na contribuição às propriedades gustativas. Existem pesquisas científicas em curso visando SORVETES & CASQUINHAS O calor (abreviado por Q) é a energia térmica transferida entre dois corpos que estão a temperaturas diferentes. Logo, não há sentido em dizer que um corpo tem mais calor que outro. O calor é uma energia que se transfere de um sistema para outro, sem transporte de massa, e que não corresponde à execução de um trabalho mecânico. A unidade do Sistema Internacional (SI) para o calor é o joule (J). Todo corpo tem uma certa quantidade de energia interna que está relacionada ao movimento aleatório de seus átomos ou moléculas. Esta energia interna é diretamente proporcional à temperatura do objeto. Quando dois corpos ou fluidos em diferentes temperaturas entram em interação (por contato, ou radiação), eles trocam energia interna até a temperatura ser equalizada. A quantidade de energia transferida é a quantidade de calor trocado, se o sistema for isolado de outras formas de transferência de energia. Termodinamicamente falando, o calor não é uma função de estado, mas depende do caminho, no espaço de estados, que descreve o sistema em uma evolução quase-estática ou reversível (no sentido termodinâmico) de um estado inicial A até um estado final B. Calor latente é a quantidade de calor que a substância troca por grama de massa durante a mudança de estado físico. Representado pela letra L, é medido em caloria por grama (cal/g). Para calcular o calor latente é necessário utilizar a seguinte expressão: L = Q / m ¨ Q = m . L (onde L é o calor latente em cal/g, Q é a quantidade de calor recebida ou cedida pelo corpo em cal e m e a massa do corpo em g). Calor sensível é aquele que provoca variação da temperatura. A capacidade térmica, que é uma característica do corpo, corresponde à quantidade de calor (recebida ou cedida) que leva a uma variação de 1°C na temperatura do corpo. É dada pela relação da quantidade de calor recebida por um corpo e a variação de temperatura sofrida pelo mesmo. É representada pela letra C e é medida em calorias por grau Celsius (cal/°C) ou calorias por Kelvin (cal/K). C = Q / )t (Onde C é a Capacidade térmica, Q é a quantidade de calor recebida ou cedida pelo corpo e )t é a variação de temperatura sofrida pelo corpo). Q ) que um corpo de massa m recebe é diretamente A quantidade de calor sensível (Q proporcional ao seu aumento de temperatura. Logo, podemos calcular a quantidade de calor sensível usando a seguinte fórmula: Q = C . )t . Calor específico , ao contrário da capacidade térmica, não é característica do corpo, mas sim característica da substância. Corresponde à quantidade de calor recebida ou cedida por 1g da substância que leva a uma variação de 1°C na temperatura do corpo em questão. É dado pela relação da capacidade térmica do corpo pela sua massa. É representado pela letra c (minúscula) e é medido em cal/g . °C ou cal/g . K. c = C / m (Onde c é o calor específico, C é a capacidade térmica e m é a massa). 27 THARP’S FOOD TECHNOLOGY sorvete, desde o ponto onde se inicia o congelamento até o momento de seu consumo final. Um bom entendimento dos efeitos da concentração por congelamento é, conseqentemente, um elemento fundamental no controle das características e qualidade dos sorvetes. SORVETES & CASQUINHAS Referências 28 esclarecer os elementos específicos destas diferenças. Um bom exemplo de esclarecimento é fornecido pelo trabalho de Gof f e outros, que estudaram os efeitos da concentração por congelamento em sistemas modelo contendo diversos componentes de mistura para sorvete e goma alfarroba ou goma guar. A pesquisa consistiu em um processo permitindo dar visibilidade microscópica as gomas, utilizando-se cont raste fluorescente, incorporando aqueles materiais em vários sistemas e, então, examinando microscopicamente os sistemas com microscópio, enquanto congelados e depois de descongelados. Ent re out ras coisas, a pesquisa esclareceu as conhecidas características criogênicas da goma alfarroba. Sob a influência da concentração por congelamento, foram notadas as formações de células ou câmaras nos sistemas contendo a goma alfarroba. A identidade destas células manteve-se mesmo após o descongelamento dos sistemas, demonstrando que a interação entre as partículas da goma alfarroba ocorrida como resultado da concentração por congelamento era irreversível. É fácil visualizar que, durante as fases de choque térmico, é mais provavel que o gelo que se fundiu naquelas células durante o aquecimento se recristaliza nas mesmas quando a temperatura volta a ser reduzida, en vez de migrar e resfriar- se em outros cristais de gelo existentes, o que implicaria no aumento de tamanho dos cristais, cont ribuindo assim à aspereza da textura. A ausência de tais estruturas em sistemas usando a goma guar é consistente com o reconhecimento geral da superioridade da goma alfarroba em promover um melhor controle no crescimento de cristal de gelo e, desta forma, contribuir no aumento do shelf life da textura, em comparação com a goma guar. Parece então claro, em função dos estudos comentados no corpo do presente artigo que, devido ao efeito de concentração por congelamento, o envolvimento dos sistemas estabilizantes em afetar importantes propriedades do sorvete é mais significativo em temperaturas abaixo daquelas normalmente envolvidas no processo de congelamento/batimento. Tal interpretação reforça o conceito que a funcionalidade de estabilizantes é mais relevante para a proteção da qualidade de textura após o congelamento, ou seja, durante o armazenamento e a distribuição. Conclusão A concentração por congelamento tem se mostrado como um fenômeno extremamente importante, que afeta o comportamento e as propriedades do 1. Belitz, H. D. and Grosch, W. 1999. Food Chemistry, 2nd Edition. Springer-Verlag, Berlin. 801 2. Bolliger, S., Wildmoser, H., Goff, H. D. and Tharp, B. W. 2000. Relationships bet ween ice cream mix viscoelasticity and ice crystal growth in ice cream. International Dairy Journal 10. 791 - 797. 3. Bolliger, S., Kornbrust, B., Goff, H. D., Tharp, B. W. and Windhab, E.J. 2000. Influence of emulsifiers on ice cream produced by conventional freezing and low-temperature extrusion processing. International Dairy Journal 10. 497504. 4. Bolliger, S., Goff, H. D. and Tharp, B. W. 2000. Correlation bet ween colloidal properties of ice cream mix and ice cream. International Dairy Journal 10. 303-309. 5. Goff, H. D., Ferdinando, D. and. Schorsch, C. 1999. Fluorescence microscopy to study galactomannan structure in frozen sucrose and milk protein solutions. Food Hydrocolloids, 13. 353-364. 6. Gof f, H. D., Freslon, M., Sahagian, M. E., Hauber, T.D., Stone, A. P., and Stanley, D. W. 1995. Structure development in ice cream – dynamic rheological measurements. Journal of Texture Studies. 26. 517-536. 7. Holsinger, V.H. 1988, Lactose. in Fundamentals of Dairy Chemistry, N. P. Wong, ed. Van Nostrand Reinhold Company, New York, NY. 279-342 8. Jenness, R. and Patton, S. 1959. Principles of Dairy Chemistry. John Wiley and Sons, NY. 77. 9. Tharp, B. W. The use of freezing profile calculations to evaluate the effect of compositional variations on freezing properties and resistance to heat shock in f rozen desser ts. Tharp's Food Technology Technical Guidelines 22. SORVETES & CASQUINHAS THARP’S FOOD TECHNOLOGY 29
Download